一种防治近视的化合物
1.本发明属于药物制剂技术领域,具体涉及一种防治近视的化合物。
背景技术:
2.目前,近视已经成为全球流行的视力障碍,尤其是在亚洲,青少年近视的患病率约为80%-90%,伴随而来的高度近视患病率达到10%-20%。有研究预测,到2050年近一半的世界人口将发展为近视,其中高度近视占世界人口的10%。近视通常指在眼睛调节放松时,平行于视轴的光线经眼的屈光系统,在视网膜前形成焦点,从而使得视网膜上成像模糊。这主要由于眼球的前后轴过长,或角膜和(或)晶状体的屈光力过大造成的。通常,调节放松状态下,眼的等效球镜度小于-0.5d时为近视,小于-6.0d时为高度近视。高度近视可引发一系列的眼部病理性改变,如后巩膜葡萄肿,视网膜脱离和高度近视性脉络膜新生血管,进而导致不可逆性视力丧失。因此,探索开发近视治疗药物是亟待解决的重要问题。
3.当前治疗近视主要通过改变眼球轴向长度或者角膜、晶状体的屈光度来实现,具体手段包括光学和手术矫正视力,以及药物延缓近视进展三大类。光学矫正是指佩戴框架眼镜、角膜接触镜,以及渐进多焦点眼镜、双焦眼镜等。光学矫正并未从根本上解决屈光不正的问题,也不能阻止高度近视导致的眼部病变。手术矫正手段主要包括角膜屈光手术、巩膜屈光手术和眼内屈光手术。手术矫正视力的方式大部分效果较好,但均有局限性,且其长期风险仍有待评估。近视治疗药物拥有巨大的潜在市场,当前主要为毒蕈碱型受体(m受体)拮抗药,以阿托品为代表。研究显示,高(1%和0.5%)、中(0.1%)、低(0.01%)浓度的阿托品滴眼液均可有效延缓近视进展,屈光度和眼轴长度均得到一定程度地改善,但具体作用机制尚无定论。目前低浓度阿托品的药物研发备受关注,中、日、美多家药企正在开发低浓度硫酸阿托品眼用制剂,且均已进入ⅲ期临床研究,但如何在接近泪液ph值条件下,保持低浓度阿托品的稳定性是一大挑战。阿托品对近视具有一定的治疗效果,但会导致眼部一系列不良反应,如瞳孔散大、畏光、睫状肌麻痹和视近模糊等。此外,阿托品对组织器官的选择性不高,对近视的疗效往往需要长期使用才能显现,而长期使用的安全性和不良反应依然无法预估。
技术实现要素:
4.为解决现有技术中的上述问题,本发明提供了一种防治近视的化合物,该化合物可以靶定非经典wnt通路中sfrp-1蛋白,是一种对sfrp-1蛋白亲和力强、作用效果明显、副作用小的sfrp-1特异性抑制剂,能够有效防治近视。
5.为实现上述目的,本发明提供了如下技术方案:
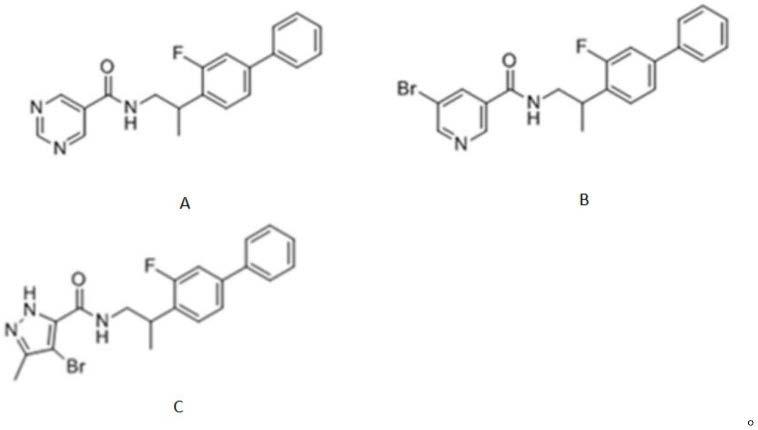
6.本发明提供了一种防治近视的化合物,所述化合物的化学结构为以下任意一种:
[0007][0008]
化合物a的英文名称为:n-(2-(3-fluoro-[1,1
’‑
biphenyl]-4-yl)propyl) pyrimidine-5-carboxamide,化学式为c
20h18
fn3o,相对分子量为335.3824;化合物b的英文名称为:
[0009]
5-bromo-n-(2-(3-fluoro-[1,1
’‑
biphenyl]-4-yl)propyl)nicotinamide,化学式为 c
21h18
brfn2o,相对分子量为413.2904;化合物c的英文名称为:4-bromo-n-(2-(3-fluoro-[1,1
’‑
biphenyl]-4-yl)propyl)-3-methyl-1h-pyrazole-5-carboxamide,化学式为c
20h19
brfn3o,相对分子量为416.2944。
[0010]
本发明还提供了上述所述的防治近视的化合物在制备防治近视的药物中的应用。
[0011]
进一步地,所述药物为sfrp-1特异性抑制剂。
[0012]
进一步地,所述化合物通过与sfrp-1蛋白的活性位点进行靶向结合,拮抗 sfrp-1引起的细胞内ca
2+
浓度升高,从而抑制非经典wnt/ca
2+
/camk信号通路的过度激活。
[0013]
本发明的技术原理:近视的病因十分复杂,主要与眼轴过度延长有关。近年来有研究者提出了一种“巩膜缺氧学说”,即模糊的视觉刺激作用于视网膜,引起视网膜的信号因子改变,进而使脉络膜变薄、血流减少,导致无血管的巩膜缺氧,胞外基质重塑,最终造成近视发生。上述学说提示,脉络膜血流减少而导致的巩膜缺氧与近视的发生、发展密切相关,但是具体的信号分子、细胞靶点及其作用机制尚不明确。
[0014]
基于此,本发明首先建立豚鼠形觉剥夺性近视(fdm)和光学离焦性近视 (lim)模型,通过对眼球后极部组织进行蛋白质组学分析和蛋白印迹验证,结果显示从造模后1周起,cochlin基因及其蛋白的表达水平,较正常对照组显著升高,并随着诱导时间延长,表达水平持续升高,且屈光度变化呈负相关,与眼轴变化成正相关,这表明cochlin可能是诱发近视的始动因素或重要的早期调控因素。
[0015]
在随后的细胞实验中,重组蛋白cochlin刺激视网膜色素上皮(rpe)细胞,基因芯片和实时定量pcr分析发现rpe细胞内sfrp-1基因表达较正常对照组显著上调,同时rpe细胞释放的sfrp-1蛋白也显著增加。用cochlin刺激rpe 细胞的条件培养基与猴脉络膜血管内皮细胞rf/6a孵育,可激活非经典 wnt/ca
2+
/camk信号通路,但并不影响经典wnt信号通路,从而在不影响细胞增殖的条件下,促进细胞凋亡和迁移,抑制细胞的成管能力。这些结果提示, cochlin过表达可通过促进rpe细胞分泌sfrp-1,进而在脉络膜血管内皮细胞中激
活非经典wnt/ca
2+
/camk信号通路,引起脉络膜血管内皮细胞功能障碍进而引起脉络膜血流灌注减少。实验同时证明,用已商业化的抑制剂way316606 抑制sfrp-1,可抑制非经典wnt/ca
2+
/camk信号通路的过度激活,进而在凋亡、迁移和成管方面恢复脉络膜血管内皮细胞功能,延缓近视进展。
[0016]
继而在豚鼠的fdm模型中,经玻腔注射携带针对豚鼠cochlin基因的shrna 的慢病毒颗粒,或经眼表滴加sfrp-1的抑制剂way316606,在造模后1周和6 周时,这两种干预手段均可显著抑制fdm诱导的屈光度加深和眼轴延长;同时眼底光相干断层血管成像(octa)和石蜡切片形态学分析显示这两种干预手段均可以显著减轻fdm引起的脉络膜血流减少;蛋白印迹也显示cochlin shrna 和way316606可以拮抗非经典wnt/ca
2+
/camk信号通路的激活。
[0017]
因此,体内、体外实验结果提示cochlin和sfpr-1在近视发病机制中起到至关重要的作用,可以作为近视对因治疗的干预靶点。
[0018]
虽然cochlin和sfrp-1两种蛋白均可作为近视干预的潜在靶点,但由于 cochlin蛋白结构复杂,当前难以作为药物设计的靶点。sfrp-1是一种分泌型糖蛋白,属于分泌型卷曲相关蛋白家族的成员。在多数情况下,sfrp-1与wnt卷曲蛋白受体有部分同源结构,因此,sfrp-1可直接与wnt蛋白结合,从而竞争性抑制受体与wnt蛋白结合,进而阻止wnt信号的传递。但在肿瘤新生血管的研究中,sfrp蛋白家族的另一成员,sfrp-2,在低浓度时可以直接结合肿瘤血管内皮细胞表面的卷曲蛋白5受体,进而激活非经典wnt/ca
2+
通路,这与上述研究中发现的cochlin刺激的rpe细胞分泌的sfrp-1对脉络膜血管内皮细胞的作用机制相一致。因此,本发明中通过制备可靶定非经典wnt/ca
2+
/camk信号通路中sfrp-1蛋白的化合物来达到防治近视的效果。
[0019]
与现有技术相比,本发明具有以下有益效果:
[0020]
本发明提供的化合物可以靶定非经典wnt/ca
2+
/camk信号通路中sfrp-1 蛋白,是一种对sfrp-1蛋白亲和力强,且半衰期长、作用效果明显、副作用小的sfrp-1特异性抑制剂,通过与sfrp-1蛋白的活性位点进行靶向结合,能够有效拮抗sfrp-1引起的细胞内ca
2+
浓度升高,从而抑制非经典wnt/ca
2+
/camk 信号通路的过度激活,达到有效防治近视的效果。
附图说明
[0021]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0022]
图1为中间体m4的hnmr图谱;
[0023]
图2为化合物a的hnmr图谱;
[0024]
图3为化合物a的hplc图谱,其中(a)为在210nm处的吸收峰,(b) 为在254nm处的吸收峰;
[0025]
图4为化合物a的lcms图谱,其中(a)为在254nm的吸收峰,(b)为在210nm的吸收峰,(c)为合成后物质各组分的分子量;
[0026]
图5为化合物b的hnmr图谱;
[0027]
图6为化合物b的hplc图谱,其中(a)为在210nm处的吸收峰,(b) 为在254nm处的吸收峰;
[0028]
图7为化合物b的lcms图谱,其中(a)为在254nm的吸收峰,(b)为在210nm的吸收峰,(c)为合成后物质各组分的分子量;
[0029]
图8为化合物c的hnmr图谱;
[0030]
图9为化合物c的hplc图谱,其中(a)为在210nm处的吸收峰,(b) 为在254nm处的吸收峰;
[0031]
图10为化合物c的lcms图谱,其中(a)为在254nm的吸收峰,(b) 为在210nm的吸收峰,(c)为合成后物质各组分的分子量;
[0032]
图11为sfrp-1蛋白一级序列(aah36503.1)模建后三维结构图;
[0033]
图12为sfrp-1蛋白结构的拉氏图(ramachandran图);
[0034]
图13中,a为同源蛋白frizzled 8的crd和xwnt8相互作用的复合物结构, b为way316606系列化合物通过盲法在sfrp-1表面的对接情况图,c为4f0a 与sfrp-1三维结构叠合的远距离视图,d为4f0a与sfrp-1三维结构叠合的近距离视图;
[0035]
图14为化合物a、b和c叠合在sfrp-1结合位点的构象图;
[0036]
图15为化合物a、b和c在脉络膜血管内皮细胞中的活性检测结果图;
[0037]
图16为化合物b与细胞内ca
2+
活性的浓度-效应拟合曲线;
[0038]
图17为化合物c与细胞内ca
2+
活性的浓度-效应拟合曲线;
[0039]
图18为0.8μm的化合物b和4.5μm的化合物c在脉络膜血管内皮细胞中的ca
2+
活性检测结果图;
[0040]
图19为蛋白印迹法检测2μm的化合物a、0.8μm的化合物b和4.5μm的化合物c对细胞内磷酸化camkii-α(p-camkii-α)、磷酸化camkii-β (p-camkii-α)、以及总camkii-α、camkii-β的表达影响的检测结果图。
具体实施方式
[0041]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。
[0042]
另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0043]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
[0044]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实
施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
[0045]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0046]
以下实施例中,化合物a、b、c合成所采用的原料均可在试剂公司常规采购。
[0047]
实施例1
[0048]
化合物a的合成:
[0049]
(1)首先设计合成化合物a、b、c的公共片段m5,合成路线如下所示:
[0050][0051]
a)中间体m3的合成:称取m1(3.0g,14.0mmol),m2(1.7g,4.67mmol),dme:水=5:1(v∶v)(30ml),搅拌下,称取1,1
”‑
双(二苯膦基)二茂铁二氯化钯(ii)二氯甲烷复合物(1.14g,0.467mmol),碳酸钾(5.8g,42.03mmol),加入反应体系,氮气置换3次,继续搅拌,升温回流反应2小时,tlc监控反应完毕,降温至室温,用乙酸乙酯100ml x 3萃取反应体系,合并有机相,无水硫酸钠干燥,抽滤,浓缩除去溶剂,柱层析得到中间体m3 2.24g,收率76%;
[0052]
b)中间体m4的合成:称取中间体m3(2.0g,9.5mmol),加入干燥的四氢呋喃20ml,冰盐浴降温至0℃以下,滴加双三甲基硅基胺基锂四氢呋喃溶液(双三甲基硅基胺基锂的浓度为1.0m)11.4ml,滴毕后,继续0℃搅拌30分钟,称取碘甲烷(1.62g,11.4mmol),加入干燥四氢呋喃5ml,将上述的碘甲烷四氢呋喃溶液滴加到体系中,滴加过程中控温0℃以下,加毕,继续搅拌2小时,取样,hplc检测,反应完毕,向反应体系中滴加5ml水淬灭反应,滴毕,继续搅拌15分钟,升温至室温,加入乙酸乙酯25ml,分出有机相,干燥有机相,浓缩有机相,柱层析得到1.43g,收率67%;m4的hnmr图谱如图1所示。
[0053]
c)中间体m5的合成:称取中间体m4(1.0g,4.44mmol),氯化镍(1.15g,8.88 mmol),加入甲醇20ml,搅拌,降温到0℃,加入硼氢化钠(0.5g,13.32mmol),继续搅拌反应2小时,tlc监控,反应完毕,滴加入2ml水,继续搅拌20分钟淬灭反应,再加入乙酸乙酯30ml,继续搅拌,分出有机相,干燥,浓缩,再向浓缩所得物中加入4m氯化氢二氧六环溶液10ml,继续搅拌,析出固体,过滤所得固体为m5的盐酸盐0.74g,收率63%,不经纯化,直接下一步。
[0054]
(2)化合物a的合成,合成路线如下所示:
[0055][0056]
称取ma(189mg,1.5mmol),加入5ml二氯甲烷,再加入草酰氯(565mg, 4.5mmol),再滴加一滴dmf,常温下继续搅拌反应2小时,体系变澄清,将体系减压浓缩干,再加入5ml二氯甲烷,使其溶解,即得到ma的酰氯二氯甲烷溶液,待用。
[0057]
再称取中间体m5的盐酸盐(265mg,1.0mmol),三乙胺(404mg,4.0mmol),加入5ml二氯甲烷,搅拌,降温0℃以下,将上述的ma酰氯的二氯甲烷溶液滴加到体系中,滴加过程中控温0℃以下,加毕,升温至室温继续反应2小时, tlc检测,反应完毕。加入5ml水淬灭反应,分出有机相,干燥有机相,浓缩,柱层析得到化合物a 132mg,收率39%。化合物a的hnmr图谱如图2所示;hplc图谱如图3所示,其中(a)为在210nm处的吸收峰,(b)为在254nm 处的吸收峰;lcms图谱如图4所示,其中(a)为在254nm的吸收峰,(b) 为在210nm的吸收峰,(c)为合成后物质各组分的分子量,由图4(c)可以看出其中包括分子量为335的组分。
[0058]
化合物b的合成路线如下所示:
[0059][0060]
化合物c的合成路线如下所示:
[0061][0062]
化合物中a、b、c合成路线类似,区别仅在于底物不同,此处不再重复描述化合物b和化合物c的具体合成步骤。化合物a、b、c分子中的手性计算表明不影响与受体的结合力,合成中暂未考虑手性分离。
[0063]
化合物b的hnmr谱图如图5所示;hplc图谱如图6所示,其中(a)为在210nm处的吸收峰,(b)为在254nm处的吸收峰;lcms图谱如图7所示,其中(a)为在254nm的吸收峰,(b)为在210nm的吸收峰,(c)为合成后物质各组分的分子量,由图7(c)可以看出其中包括分子量为413的组分(由于在质谱过程中加上了质子化的氢,因此hnmr谱图中显示的分子量比实际的
化合物的分子量多1)。
[0064]
化合物c的hnmr谱图如图8所示;hplc图谱如图9所示,其中(a)为在210nm处的吸收峰,(b)为在254nm处的吸收峰;lcms图谱如图10所示,其中(a)为在254nm的吸收峰,(b)为在210nm的吸收峰,(c)为合成后物质各组分的分子量,由图10(c)可以看出其中包括分子量为416的组分。
[0065]
效果验证
[0066]
1.sfrp-1三维结构确定
[0067]
利用蛋白结构同源模建平台swiss-model,alphafold及rosettafold的预测,结合sfrp-3的crd区域晶体结构数据。采用同源模建方法,以5xgp(pdbcode)晶体结构为模板,结合100ns的分子动力学采样,sfrp-1蛋白一级序列 (aah36503.1)模建后三维结构如图11所示的结构骨架图(backbone),分为 ntd与crd两个结构域;图12为蛋白结构的拉氏图(ramachandran图)。
[0068]
2.sfrp-1活性位点的确定
[0069]
如图13所示,蛋白结构中所有crd区域以白色分子表面显示,xwnt8以紫色ribbon表示,sfrp-1的ntd区域以棕色ribbon表示。图13a:frizzled 8 结合xwnt8复合物结构信息(pdb code:4f0a)(crystal structure of xwnt8 incomplex with the cysteine-rich domain of frizzled 8),借鉴蛋白与蛋白相互作用 (protein-protein interaction,ppi)抑制剂开发经验,我们预测与frizzled 8同源的sfrp-1的crd区可能为配体的结合区域(如a中所示凹槽分);图13b:文献报道的way316606系列化合物通过盲法对接方法(blind docking)寻找位点,如图13b中所示,即多个小分子占据位置,在对接中,共37个分子设定产生37*3=111个对接构象,其中有99个构象(接近90%)靶向此位点,剩余构象靶向ntd的表面,可见此位置是sfrp-1活性位点的可能性最大;图13c, 13d:是通过计算软件对sfrp-1的表面位点预测结果,其中图13c为4f0a与 sfrp-1三维结构叠合的远距离视图,图13d为4f0a与sfrp-1三维结构叠合的近距离视图,图中红白小球显示区域为打分最好的潜在活性位点;4f0a结构中的frizzled 8部分与sfrp-1的crd区三维结构叠合后发现,sfrp-1的ntd区域(棕色)并没有影响crd(白色表面)区域与xwnt8蛋白的作用(紫色),表明一旦sfrp-1的活性位点被配体分子占据后,将会干扰sfrp-1与wnt蛋白的结合,非经典wnt/ca
2+
信号通路将可能受到抑制。
[0070]
3.化合物a、b和c叠合在sfrp-1结合位点的构象图如图14所示,由图 14可以看出,化合物a、b和c不仅在结合能量上远远超过way316606,而且几何形状匹配完美。
[0071]
4.体外细胞实验
[0072]
基于已有的体外细胞实验技术,选取sfrp-1的抑制剂way316606作为阳性对照,对化合物a、b、c的测试实验采用如下技术方案:
[0073]
1)细胞培养
[0074]
将购自中国科学院典型培养物保藏委员会细胞库(中国上海)的rf/6a细胞(猴脉络膜血管内皮细胞系)培养于含有10%fbs,100u/ml青霉素,100 μg/ml链霉素和2mm l-谷氨酰胺的dmem/f12的培养基,置于37℃,5%co2条件的细胞培养箱内。
[0075]
2)细胞处理及实验分组
[0076]
将复苏后第2-3代的rf/6a细胞(4
×
104细胞/孔)种入白色非透明96孔板中,将细
胞分为12组(n=3/组):
[0077]
1.正常对照组(normal):完全培养基;
[0078]
2.sfrp-1组:完全培养基含30ng/ml sfrp-1;
[0079]
3.sfrp-1+10a组:完全培养基30ng/ml sfrp-1+10μm a药物;
[0080]
4.sfrp-1+2a组:完全培养基30ng/ml sfrp-1+2μm a药物;
[0081]
5.sfrp-1+0.4a组:完全培养基30ng/ml sfrp-1+0.4μm a药物;
[0082]
6.sfrp-1+10b组:完全培养基30ng/ml sfrp-1+10μm b药物;
[0083]
7.sfrp-1+2b组:完全培养基30ng/ml sfrp-1+2μm b药物;
[0084]
8.sfrp-1+0.4b组:完全培养基30ng/ml sfrp-1+0.4μm b药物;
[0085]
9.sfrp-1+10c组:完全培养基30ng/ml sfrp-1+10μm c药物;
[0086]
10.sfrp-1+2c组:完全培养基30ng/ml sfrp-1+2μm c药物;
[0087]
11.sfrp-1+0.4c组:完全培养基30ng/ml sfrp-1+0.4μm c药物;
[0088]
12 sfrp-1+way316606组:完全培养基30ng/ml sfrp-1+2μm way316606;
[0089]
3)细胞内ca
2+
的活性测定
[0090]
孵育21小时后,吸出培养基,每孔加入100μl含10%cck-8(dojindolaboratories,kumamoto,japan)的完全培养基,37℃,5%co2条件的细胞培养箱内孵育1小时,酶标仪(tecan group ltd.,switzerland)测量450nm 吸光度,代表每孔的细胞数目。然后根据fluo-8 medium removal calcium assaykit的说明书,测量细胞内ca
2+
的活性。然后用每孔细胞od450 nm的数值校正每孔细胞内的ca
2+
活性,最后,细胞内的ca
2+
活性用正常对照组的百分数来表示。
[0091]
化合物a、b、c在脉络膜血管内皮细胞中的活性检测结果如图15所示。rf/6a (猴脉络膜血管内皮细胞)细胞种在96孔板中,直接加入sfrp-1(30ng/ml) 重组蛋白,sfrp-1在这一浓度可以激活脉络膜血管内皮细胞内的非经典 wnt/ca
2+
信号通路,同时加上三种不同浓度(10μm,2μm,0.4μm;药物剂量爬坡)的新合成的sfrp-1抑制剂a、b、c;way316606采用前期研究的最佳浓度 (2μm),作为阳性对照。孵育19小时之后,用fura-8钙离子检测试剂盒检测每孔细胞内钙离子的浓度,并用每孔细胞数量(od450的读数为代表)进行校正。虚线代表正常组细胞内的钙离子水平。可见在sfrp-1的刺激下,细胞内钙离子浓度升高;而加入不同浓度的同一个药物(10μm,2μm,0.4μm),可以改变细胞内ca
2+
浓度。其中,2μm的a可使细胞内的钙离子浓度恢复到接近正常的水平(图15)。
[0092]
根据b和c的浓度(10μm,2μm,0.4μm,0μm),及相应的细胞内ca
2+
活性,利用curveexpert1.4这一软件进行曲线拟合,分别拟合出b化合物与细胞内 ca
2+
活性的浓度-效应曲线(图16)以及c化合物与细胞内ca
2+
活性的浓度-效应曲线(图17);根据浓度-效应曲线,推算出将细胞内ca
2+
活性恢复到正常水平所需b和c化合物的浓度分别为0.8μm和4.5μm。
[0093]
再进行细胞内ca
2+
的活性测定实验,设置实验组:
[0094]
1.正常对照组(normal):完全培养基;
[0095]
2.sfrp-1组:完全培养基含30ng/ml sfrp-1;
[0096]
3.sfrp-1+0.8b组:完全培养基30ng/ml sfrp-1+0.8μm b药物;
[0097]
4.sfrp-1+4.5c组:完全培养基30ng/ml sfrp-1+4.5μm c药物;
[0098]
5.sfrp-1+way316606组:完全培养基30ng/ml sfrp-1+2μm way316606;结果可见,
sfrp1可使细胞内ca
2+
活性增加,而0.8μm b和4.5μm c确实可以将细胞内ca
2+
的活性降至正常水平(图18)。
[0099]
4)蛋白印迹法确定细胞内信号通路的激活
[0100]
根据上述细胞内ca
2+
的活性测定的结果,将细胞复苏后第2-3代的rf/6a 种入6孔板中(1
×
106细胞/孔),将细胞分为7组:
[0101]
1.正常对照组(nor):完全培养基;
[0102]
2.sfrp-1组:完全培养基含30ng/ml sfrp-1;
[0103]
3.sfrp-1+2a组:完全培养基30ng/ml sfrp-1+2μm a药物;
[0104]
4.sfrp-1+0.8b组:完全培养基30ng/ml sfrp-1+0.8μm b药物;
[0105]
5.sfrp-1+4.5c组:完全培养基30ng/ml sfrp-1+4.5μm c药物
[0106]
6.sfrp-1+way316606组:完全培养基30ng/ml sfrp-1+2μm way316606;
[0107]
7.sfrp-1+dmso组:完全培养基30ng/ml sfrp-1+dmso(1/5000体积比);依照组别对细胞进行刺激21小时后,根据蛋白酶抑制剂与中性ripa裂解液=1∶ 99的比例,配制组织蛋白裂解液,6孔板每孔加300μl蛋白裂解液,充分裂解细胞。取出细胞裂解液,于冰上孵育20min,12,000rpm,低温离心20min,收集上清液于新的1.5ml离心管内。
[0108]
根据bca蛋白定量试剂盒(康为世纪,北京)操作说明,首先,稀释bsa 标准品,接着,用ripa中性裂解液5倍稀释蛋白样本,并将标准品和稀释后蛋白样本各25μl分别加入96孔板内。然后,将bca试剂盒中的a液和b液按 50:1的体积比,配制bca工作液,充分混匀。每孔加入200μl bca工作液,37℃孵育30min,待其冷却至室温后,用酶标仪(tecan group ltd., switzerland)混匀震荡30s,并在562nm处测定吸光值,最后绘制标准曲线,计算各样品中蛋白浓度值。
[0109]
将蛋白样品(50μg/孔)100℃,10min高温变性后,加入适量4x蛋白上样缓冲液混合,加入梳孔内,进行sds-page电泳,恒压100v,当指示剂到达胶板底部时停止电泳。将胶从玻璃板内取下,去掉上层浓缩胶,将相应大小的pvdf 膜在甲醇中浸泡15s后,取出并浸泡于去离子水中2min,然后从负极到正极按照滤纸-胶-膜-滤纸的顺序,放入转膜支撑夹内,最后将夹子放入转膜槽内,倒入转膜液,在低温的条件下进行恒压100v转膜100min。
[0110]
转膜完毕后,将pvdf膜在1x tbst缓冲液内漂洗3次,每次快速摇床10 min,最后用5%的脱脂奶粉室温封闭2h。封闭结束后,将膜分别与封闭液配制的抗camkⅱ(兔单抗:1:1000,cell signaling technology,美国),抗phospho-camkⅱ(兔多抗:1:1000,cell signaling technology,美国)和抗gapdh (gapdh鼠单抗:1:5000,abcam,美国)的一抗,在4℃摇床缓慢孵育过夜。
[0111]
转天,用tbst洗膜3次,每次10min。随后将膜与tbst稀释的辣根过氧化物酶标记的羊抗兔(1:10000,abcam,美国)或羊抗鼠(1:5000,abcam,美国)二抗,在室温慢速摇床孵育2h。然后,tbst快速洗膜4次,每次10min,将膜取出,平铺于发光成像仪(uvp,llc,upland,ca,usa)指定位置,均匀滴加显影液(amersham biosciences,piscataway,nj,usa)以覆盖要显影的膜,利用发光成像仪(uvp,llc,upland,ca,usa)拍摄图片。结果表明,sfrp-1 可以使p-camkii-α和p-camkii-β的表达增高,而2μm a,0.8μm b,4.5μm c 均可使p-camkii-α和p-camkii-β的表达降至正常水平,其效果与2μm way316606相似;而溶剂对照dmso没有效果(图19)。总的camkii-α和 camkii-β的表达趋势与其相应的磷酸化蛋白相似,但变化不如磷
酸化蛋白明显 (图19)。
[0112]
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1