一种富营养素益生菌菌粉制备及其在羊奶粉中应用
1.本发明涉及富营养素益生菌技术领域,特别是涉及一种富营养素益生菌菌粉制备及其在羊奶粉中应用。
背景技术:
2.硒、锌和铬是人和动物所必需的营养素,在维持正常生理代谢过程中起着重要的作用,其吸收与其状态有关,游离形式的硒、锌、铬不易被吸收,且毒性较强,无机态的生物学效价低于有机态,因此将无机态的硒、锌、铬转化为有机态是研究的热点。
3.益生菌亦被称为益生素或微生态制剂,是指能够定殖于宿主体内、通过调节微生态的平衡从而促进宿主生长繁殖的一类有益微生物。益生菌已被报道一系列治疗特性,如增强免疫防御系统,降低血清胆固醇预防结肠癌,胃肠道和泌尿系统感染,治疗动脉粥样硬化,动脉硬化,类风湿关节炎等。因此,益生菌在健康食品,医药和畜牧业等领域广泛使用。
4.许多微生物都具有富集有益元素的功能,利用益生菌富集营养素,可将无机元素转化成有机元素。人体可以通过摄入这种富营养素益生菌,在补充营养素的同时摄入益生菌的功效。食品经过富营养素益生菌的发酵既具有了益生菌的保健功效,同时又可以补充其它营养素,比如利用富硒益生菌开发的食品主要有酸奶、酒、香肠、面包等发酵食品或是利用富锌益生菌开发的富锌酸奶发酵剂等。
5.alzate等人研究发现富硒益生菌将无机硒转化成的有机硒,提高硒摄入量和利用率的同时还不会引发毒性反应。yang等人利用嗜热链球菌和保加利亚乳杆菌在不同条件下进行富硒培养,使用响应面法优化富硒条件得到最适初始温度、ph值和接种量,分别为40℃、6.37、6.00%和33℃、5.96、6.73%,嗜热链球菌对硒的富集率达到97.05%,保加利亚乳杆菌则达到94.34%。靳志强等人研究表明mrs培养基中硒质量浓度≤12μg/ml,接种量5%培养48h时,动物双歧杆菌01达到最大硒耐受量,最佳硒质量浓度为8μg/ml,并在6h时加硒富硒效果最佳。刘东等人利用嗜酸乳杆菌ysh2、德氏乳杆菌保加利亚亚种1.1480和青春双歧杆菌ys01三株菌进行混合培养富锌,得到富锌混合菌体。
6.酵母菌具有易生长、对微量元素吸收率高等特点,是富集微量元素的理想载体,但目前的研究多集中于开发富硒、富锌、富铁等单富集营养素酵母,未见利用酵母菌同时富集两种或多种营养素的研究。
技术实现要素:
7.本发明的目的是提供一种富营养素益生菌菌粉制备及其在羊奶粉中应用,以解决上述现有技术存在的问题。
8.为实现上述目的,本发明提供了如下方案:
9.本发明技术方案之一:本发明提供一种富营养素益生菌菌粉的制备方法,包括以下步骤:
10.将保拉迪酵母l2接种于培养基中,添加硒源、锌源和铬源,进行培养,培养完成后,
收集菌泥,在所述菌泥中添加冻干保护剂,冷冻干燥得到所述富营养素益生菌菌粉。
11.所述保拉迪酵母l2保藏于美国典型培养物保藏中心,保藏编号为atcc 9763。
12.进一步地,所述硒源、锌源和铬源分别为亚硒酸钠、硫酸锌和三氯化铬。
13.进一步地,所述硒源的浓度为30μg/ml,所述锌源的浓度为300μg/ml,所述铬源的浓度为300μg/ml。所述富营养素益生菌菌粉中硒含量为702.33~1400.91μg/g,锌含量为890.23~4193.18μg/g,铬含量为754.42-1700.78μg/g,菌体量为10.75-28.20g/l。
14.进一步地,所述培养的条件为:培养时间36-60h,接种量为5-9%,ph为5.0-6.0。
15.进一步地,所述培养的条件为:培养时间48h,接种量为8.6%,ph为5.29。
16.进一步地,所述冻干保护剂包括以下质量百分含量的组分:精氨酸4.5%,低聚木糖7%,脱脂乳24%,磷酸氢钠0.8%,甘氨酸5.5%。保拉迪酵母l2的冻干存活率为83.65%,单位菌粉活菌数可达4.37
×
10
10
cfu/g。
17.进一步地,按照所述菌泥与冻干保护剂质量比1:1添加冻干保护剂。
18.本发明技术方案之二:本发明提供上述制备方法制备的富营养素益生菌菌粉。
19.所述富营养素益生菌菌粉失活速率常数的对数(lgk)对其绝对温度(1/t)的关系满足方程lgk=-5585.4/t+16.582,其在4℃(冷藏温度)和-18℃(冻藏温度)条件下的失活速率常数分别为k4=2.62
×
10-5
,k-18
=4.77
×
10-6
。
20.本发明技术方案之三:本发明提供上述富营养素益生菌菌粉在羊奶粉中的应用。
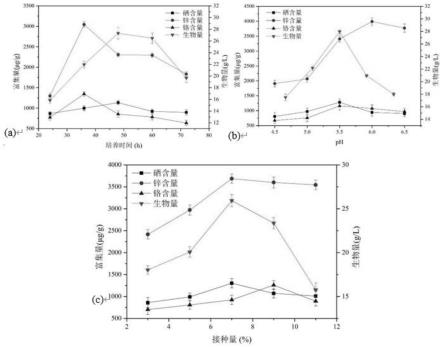
21.本发明技术方案之四:本发明提供一种富营养素益生菌羊奶粉,含有上述富营养素益生菌菌粉。
22.进一步地,所述富营养素益生菌菌粉的添加量为0.05%-1%。
23.每克富营养素益生菌羊奶粉中的益生菌活菌数为2.18
×
107~4.37
×
108cfu/g。
24.本发明公开了以下技术效果:
25.本发明以亚硒酸钠,硫酸锌和三氯化铬为硒源、锌源和铬源,以益生菌—保拉迪酵母l2为载体,获得了复合富营养素酵母,开发了复合富营养素益生菌羊奶粉,既能够补充微量元素,又能够促进肠道菌群平衡健康,为富集两种或多种营养素酵母的制备及功能性乳品开发提供了理论参考和技术支持。
附图说明
26.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
27.图1为保拉迪酵母l2的扫描电镜图,a和b分别为放大倍数为5k和10k的扫描电镜图;
28.图2为亚硒酸钠浓度对保拉迪酵母l2硒含量和生物量的影响;
29.图3中a-j为不同亚硒酸钠浓度培养的保拉迪酵母l2菌体的扫描电镜图,a、c、e、g和i放大倍数为5k,b、d、f、h和j放大倍数为10k;
30.图4为硫酸锌浓度对保拉迪酵母l2锌含量和生物量的影响;
31.图5中a-j为不同硫酸锌浓度培养的保拉迪酵母l2菌体的扫描电镜图,a、c、e、g和i
放大倍数为5k,b、d、f、h和j放大倍数为10k;
32.图6为三氯化铬浓度对保拉迪酵母l2铬含量和生物量的影响;
33.图7中a-j不同三氯化铬浓度培养的保拉迪酵母l2菌体的扫描电镜图,a、c、e、g和i放大倍数为5k,b、d、f、h和j放大倍数为10k;
34.图8中(a)-(d)分别为不同盐浓度及营养素组合对保拉迪酵母l2富集量和生长的影响;
35.图9为培养条件对保拉迪酵母l2制备富硒锌铬保拉迪酵母l2的影响,其中,(a)为培养时间;(b)为ph;(c)为接种量;
36.图10为培养时间、ph和保拉迪酵母l2接种量对硒含量的影响:(a)、(b)、(c)为2d等高线图,(d)、(e)、(f)为3d响应面图;
37.图11为培养时间、ph和保拉迪酵母l2接种量对锌含量的影响:(a)、(b)、(c)为2d等高线图,(d)、(e)、(f)为3d响应面图;
38.图12为培养时间、ph和保拉迪酵母l2接种量对铬含量的影响:(a)、(b)、(c)为2d等高线图,(d)、(e)、(f)为3d响应面图;
39.图13为培养时间、ph和接种量对保拉迪酵母l2生物量的影响:(a)、(b)、(c)为2d等高线图,(d)、(e)、(f)为3d响应面图;
40.图14为富硒锌铬保拉迪酵母l2的扫描电镜图;其中,a和b分别为放大倍数为5k和10k的扫描电镜图;
41.图15为富硒锌铬保拉迪酵母l2的edx分析图谱;
42.图16为不同冻干保护剂对保拉迪酵母l2菌粉产量(a)、冻干存活率和单位菌粉活菌数(b)的影响;
43.图17为富硒锌铬保拉迪酵母l2冻干菌粉加速试验;其中(a):活菌数随时间的变化;(b):arrhenius图;
44.图18为冻干菌粉在羊奶粉中的加速试验;其中(a):活菌数随时间的变化;(b):arrhenius图;
45.图19为益生菌羊奶粉在模拟胃液(a)、肠液(b)中处理不同时间后的活菌数变化。
具体实施方式
46.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
47.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
48.本发明实施例所用的保拉迪酵母l2在陕西科技大学食品与生物工程学院实验室1c419中以冻干菌粉的形式保藏,其来源于美国典型培养物保藏中心菌株atcc 9763。
49.本发明实施例所用的主要实验试剂如表1所示:
50.表1
[0051][0052][0053]
实施例1
[0054]
1.菌株活化
[0055]
将研究室保存的保拉迪酵母l2的冻干菌粉用ypd培养基溶解后,置于30℃、180r/min摇床培养箱中培养24h,以5%(v/v)的接种量连续活化三代后,使每株菌的活菌数均能达到108cfu/g,将其放置冰箱中4℃备用。
[0056]
2.保拉迪酵母l2电镜观察
[0057]
在无菌条件下,以5%(v/v)的接种量将活化好的保拉迪酵母l2接种在ypd肉汤培养基中并置于培养箱中30℃,180r/min摇床培养24h,待菌株的生长达到对数期后,离心收集菌体,利用sem测定了菌体的形态,如图1所示,保拉迪酵母l2菌体完整,为椭球型,形态体积较大,此外还有少量细胞呈圆形,部分母体细胞周围出现芽体,说明保拉迪酵母l2具有酵母菌的普遍特征,出芽生殖。图1中,a为5kx,b为10kx。
[0058]
3.营养素转化率测定
[0059]
转化率测定:用电感耦合等离子发射光谱(icp-aes)对亚硒酸钠,硫酸锌和三氯化铬的含量进行检测。将富含营养素的酵母菌转化液离心,取5ml上清液,加入硝酸和双氧水进行硝化,将硝化后的样品用纯水稀释至20ml后,置于icp-aes中检测硒、锌和铬的含量,并根据icp中建立相应标准溶液的校准曲线计算含量。
[0060]
转化率(%)=[(b-a)/b]
×
100
ꢀꢀꢀ
(1)
[0061]
式中:
[0062]
a——检测得到的硒、锌和铬的含量;
[0063]
b——加入硒、锌和铬的总含量。
[0064]
酵母生物量测定:发酵液经摇瓶培养后于6000r/min离心10min,收集菌体,蒸馏水洗涤3次,收集酵母,105℃烘干至恒重即可获得酵母生物量。
[0065]
4.扫描电镜与能谱分析(sem+edx)
[0066]
将富营养素酵母菌转化液离心去除上清液,向菌泥中添加2.5%的戊二醛并将其固定3h。离心后将其沉淀用磷酸盐缓冲液(ph7)清洗2次每次10min,对洗涤后的沉淀用乙醇(30%,50%,70%,80%,90%,100%)进行连续的梯度洗脱每次10min,最后用乙酸异戊酯洗涤,将沉淀进行30h真空冷冻干燥后得到富含营养素的酵母菌菌粉。取适量的富营养素酵母粉末,置于含有金属导电胶的载样台上,并进行喷金处理,将完成喷金的样品置于电镜的样品室中观察,加速电压为2kv,放大倍数为10000倍。对扫描电镜中观察到的细胞表面沉淀进行定性的元素分析,并用x射线能谱分析仪进行进一步分析。
[0067]
a.亚硒酸钠浓度对保拉迪酵母l2富集效果的影响及扫描电镜图像分析
[0068]
将亚硒酸钠浓度设置为10,20,30,40和50μg/ml,测定酵母中的硒含量和生物量,进行扫描电镜观察,结果如图2和图3所示。图3中,a,b:10μg/ml;c,d:20μg/ml;e,f:30μg/ml;g,h:40μg/ml;i,j:50μg/ml,且a、c、e、g、i为5kx,b、d、f、h、j为10kx。
[0069]
由图2可知,当亚硒酸钠的浓度小于30μg/ml时,保拉迪酵母l2富集在菌体内的硒含量和生物量随亚硒酸钠浓度增加而呈上升趋势;当浓度到达30μg/ml时,菌体的硒含量和生物量达到最大值,分别为1060.59μg/g和27.2g/l;当亚硒酸钠的浓度大于30μg/ml时,菌体生长受到抑制,导致菌体的富硒量和生物量逐渐下降,这主要是因为亚硒酸盐的还原主要由菌体中的相关还原酶进行作用,当亚硒酸钠过多时,菌体对亚硒酸钠转化达到饱和,且亚硒酸钠会抑制菌体的活性,使相关酶作用活性降低。
[0070]
培养基中硒的浓度会影响菌体生长和硒的富集,因此,在酵母发酵过程中不仅要减少硒对菌体生长的抑制作用,确保菌体生长的最大量,还要提高菌体对硒的转化以获得高含量的有机硒蛋白。观察图3,当亚硒酸钠浓度在10-30μg/ml时,相比对照组细胞表面褶皱逐渐消失、出现细小的裂纹。当浓度大于30μg/ml时,极少数细胞保持正常状态,大部分细胞出现凹陷、变形。综合考虑,选择亚硒酸钠浓度为30μg/ml。
[0071]
b.硫酸锌浓度对保拉迪酵母l2富集效果的影响及扫描电镜图像分析
[0072]
将硫酸锌浓度设置为200,300,400,500和600μg/ml,转化时间为24h,结果如图4和图5所示。图5中,a,b:200μg/ml;c,d:300μg/ml;e,f:400μg/ml;g,h:500μg/ml;i,j:600μg/ml,且a、c、e、g、i为5kx,b、d、f、h、j为10kx。
[0073]
由图4可知,保拉迪酵母l2富集的锌含量和菌体生物量均随着硫酸锌的浓度先增加后减少,当浓度为300μg/ml时,菌体中的锌含量和生物量都达到了最大值,分别是3164.76μg/g和35.45g/l。而当浓度到达600μg/ml时,锌含量和生物量分别降至1375.2μg/g和15.55g/l。这是由于锌离子是生物体内很多生物酶的辅助因子,随着硫酸锌浓度的增加从而促进了酵母菌的生长发育。然而,酵母菌所能耐受的锌浓度和渗透压有限,锌盐过量时,没有激活酵母细胞的酶活性,锌离子浓度增加到一定程度反而限制了其生长,引起了对
细胞的毒害作用,抑制了酵母细胞的酶活性。
[0074]
由图5可以看出,培养基中zn
2+
的浓度为200μg/ml时,细胞形态主要是圆形或是出芽状,体积略有减小;当浓度提升至300μg/ml时,细胞形态主要呈圆形,细胞表面褶皱减少,更加光滑平整且开始出现沉淀;当培养基中zn
2+
浓度达到500μg/ml时,可以明显看出极少数的细胞形态正常,绝大部分酵母细胞的形态不规则,细胞发生凹陷。
[0075]
酵母细胞中zn
2+
富集的主要部位是细胞壁,在酵母细胞细胞壁合成有关酶的过程中,zn
2+
可作为激活剂和抑制剂,添加低浓度的zn
2+
可激活相关的酶,以提高菌体生物量;而高浓度的zn
2+
不仅对培养液的渗透压造成影响,同时也抑制了部分酶的活性,酵母细胞壁的合成受到影响,从而影响酵母的生物量和形态。因此,综合锌含量,生物量及扫描电镜结果,最终确定硫酸锌浓度为300μg/ml。
[0076]
c.三氯化铬浓度对保拉迪酵母l2富集效果的影响及扫描电镜图像分析
[0077]
分别选用三氯化铬浓度为100,200,300,400,500μg/ml的ypd培养基培养保拉迪酵母l2,测定菌体中的铬含量和生物量,结果如图6和图7所示。图7中,a,b:100μg/ml;c,d:200μg/ml;e,f:300μg/ml;g,h:400μg/ml;i,j:500μg/ml,且a、c、e、g、i为5kx,b、d、f、h、j为10kx。
[0078]
图6显示,保拉迪酵母l2在不同三氯化铬浓度培养基中的生物量不同。当培养基中三氯化铬浓度在100-300μg/ml时,生物量随浓度的增加亦缓慢增加;三氯化铬浓度为300μg/ml时,生物量达到最大值27.725g/l;当培养基中三氯化铬浓度高于300μg/ml时,生物量随浓度增加迅速下降。保拉迪酵母l2的最大生物量没有出现在三氯化铬浓度最低的培养基中,而是出现在浓度为300μg/ml培养基中。主要由于低浓度的铬刺激了酵母的生长,而铬浓度过高时,酵母的生长和代谢受到了铬元素毒性作用的抑制。当菌体铬含量高时,菌体量很低;相反,当菌体量较高时,铬含量较低。
[0079]
从图7中可以发现,与未添加三氯化铬培养的保拉迪酵母l2(图1)相比,随着三氯化铬浓度的增加,酵母细胞壁上富集的沉淀在逐渐增加。三氯化铬浓度在100μg/ml和200μg/ml时,酵母细胞形状没有发生变化。当浓度为300μg/ml和400μg/ml,酵母细胞形状逐渐变长。浓度到达500μg/ml时,细胞形变加剧,表面甚至发生凹陷。然而,图中各个三氯化铬浓度条件下,保拉迪酵母l2细胞壁均未受到明显破坏,说明在上述三氯化铬浓度下可以正常繁殖。
[0080]
微生物对有害物质和环境变化表现出一定的适应性和抵抗力。铬作为重金属,对微生物具有一定毒性。从富铬酵母扫描电镜图可以看出,随着三氯化铬浓度增加(100~500μg/ml),酵母细胞壁上开始出现沉淀。这是由于酵母在富集铬的过程中,向体外分泌出蛋白质、脂类等生物大分子,并与铬结合形成颗粒物附着于细胞表面;或是菌体表面的铬浓度过高从而形成一定的破坏作用。叶锦韶等人研究了酵母对重金属铬的吸附作用,发现某些重金属在低浓度时可促进微生物的生长,主要由于这些金属是微生物细胞中的某些酶的必要成分;但当重金属含量超过其临界浓度时,对微生物具有一定的毒性,甚至可以杀死微生物。张晓青等人研究发现酵母菌吸附铅之前的结构为椭圆形,且形态规则整齐;酵母菌吸附铅之后的表面却十分粗糙,凹凸不平。这表明细胞表面的物质与pb
2+
发生了作用,生成的沉淀物附着在细胞壁上,从而引起细胞形态的变化。本发明中cr
3+
对保拉迪酵母l2的作用与pb
2+
对其细胞表面作用类似。根据铬含量,生物量及扫描电镜结果分析综合衡量,选择培养
基中的三氯化铬浓度为300μg/ml。
[0081]
5.不同营养素浓度组合及硒锌铬富集量
[0082]
以单因素试验得出的三种盐浓度为中心,研究了不同盐类,不同浓度组合下菌体的富集情况。在培养基中添加不同浓度的亚硒酸钠,硫酸锌和三氯化铬并分为4组不同的组合添加,分别为:a组se+zn;b组se+cr;c组zn+cr;d组se+zn+cr。a组中浓度1为10+100μg/ml,浓度2为15+150μg/ml,浓度3为30+300μg/ml;b组中浓度1为10+100μg/ml,浓度2为15+150μg/ml,浓度3为30+300μg/ml;c组中浓度1为100+100μg/ml,浓度2为150+150μg/ml,浓度3为300+300μg/ml;d组中浓度1为10+100+100μg/ml,浓度2为15+150+150μg/ml,浓度3为30+300+300μg/ml。培养结束后测定酵母富集的硒、锌和铬量及生物量。
[0083]
研究不同营养素组合及浓度对保拉迪酵母l2富集及生长的效果,结果如图8所示,(a):se+zn;(b):se+cr;(c):zn+cr;(d):se+zn+cr。
[0084]
由图8可知,4组实验中酵母对硒,锌和铬的富集量均随着浓度的增加而增加,菌体生物量均有不同程度的下降。a组中,随着亚硒酸钠和硫酸锌浓度的增大,酵母中的硒含量与锌含量均随浓度的增加逐渐增大,在浓度3时单位菌体的硒含量和锌含量达到了732.5μg/g和1407.77μg/g,生物量达到了26.78g/l。b组中,在浓度3时单位菌体的硒含量和铬含量达到533.745μg/g和632.02μg/g。c组中生物量变化明显。d组中同时富集三种营养素,在浓度3时,硒含量,锌含量和铬含量达到588.76μg/g,1061.54μg/g和930.57μg/g,生物量为21.75g/l。综合考虑酵母的产量和共富集硒锌铬的效果,在本试验条件下选择d组试验结果(亚硒酸钠30μg/ml,硫酸锌300μg/ml,三氯化铬300μg/ml)进行下一步研究。
[0085]
6.富硒锌铬酵母培养条件优化响应面设计
[0086]
根据前期筛选结果,得到了富集三种营养素能力较强的菌株,为了进一步提高益生菌对三种营养素的富集能力,对菌株进行单因素试验,研究培养时间(24-72h)、接种量(3-11%)、ph(4.5-6.5)对酵母菌富集营养素的影响,并根据单因素的结果,选取影响最显著的因素的和其最适值作为中心点,进行3因素3水平响应面设计,优化制备富硒锌铬酵母的工艺,得到最佳工艺条件并对其进行验证。
[0087]
(1)培养条件对富硒锌铬保拉迪酵母l2制备的影响
[0088]
为探究培养条件对保拉迪酵母l2富集效果及生长的影响,以5%接种量、30℃培养温度和180r/min的摇床转速为基础培养条件,对培养时间、初始ph值和接种量进行单因素试验,测定三种营养素富集量及菌体生物量,考察其影响,结果如图9所示。图9中,(a)-(c)分别为培养时间、初始ph值和接种量对三种营养素富集量及菌体生物量的影响。
[0089]
由图9(a)可以看出,随着时间的增加,酵母的生物量和富集量呈先上升后下降的趋势。在48h时,菌体生物量和硒含量分别达到最大值27.325g/l和1135.685μg/g。在36h时,菌体的富锌量和富铬量达到最大值分别为3044μg/g和1346.25μg/g。综合两方面的考虑。选择保拉迪酵母l2的培养时间48h为宜。
[0090]
由图9(b)可以看出,菌体生物量及富集量均随ph的增加先增加后减少。在ph为5.5时,菌体硒含量和铬含量达到最大值分别为1280.851μg/g和1159.609μg/g。此时,生物量为27.99g/l。在ph为6时,菌体富集的锌含量达到最大值为3990.493μg/g。当ph继续增大时,菌体富集营养素的含量均有所下降,生物量也随之下降。suhajda等人评估了培养条件对酿酒酵母吸收硒的影响,最重要的影响是培养基中的酸度和溶解氧的含量。综合考虑选择ph为
5.5进行下一步的工艺优化。
[0091]
微生物合成有用的生物制品依赖于营养物质消耗,而营养物质消耗反过来又在很大程度上取决于菌体在一个培养液有限体积内的密度。这就要求控制菌体的接种量,以确保有利于高产物合成的最佳养分吸收。在图9(c)中,不同的接种量对酵母生物量、硒、锌和铬富集的影响有所不同。接种量为7%时,菌体的硒含量,锌含量及生物量均达到最大值为25.935g/l,1302.74μg/g和3686.83μg/g。在接种量为9%时,铬含量达到最大值为1260.224μg/g。综合考虑酵母生物量,菌体对各营养素的富集量两个因素的影响,后续选取保拉迪酵母l2为7%进一步优化。
[0092]
(2)富硒锌铬保拉迪酵母l2发酵工艺的响应面法优化
[0093]
根据上述单因素试验结果,以保拉迪酵母l2r1(硒含量),r2(锌含量),r3(铬含量)和r4(生物量)为响应值,对a(培养时间)、b(ph)和c(接种量)进行n=15的三因素三水平的box-behnken试验设计。各因子水平编码表如表2所示,试验设计及结果如表3所示。
[0094]
表2 box-behnken试验优化富硒锌铬保拉迪酵母l2发酵工艺的因素水平表
[0095][0096][0097]
表3富硒锌铬保拉迪酵母l2发酵工艺优化的box-behnken试验设计及结果
[0098][0099]
根据上表的试验结果构建了回归方程如下:
[0100]
r1=1242.06-134.07a+1.22b-19.32c+148.95ab-120.80ac-40.35bc-300.38a2+85.94b2+27.49c2[0101]
r2=2830.96-466.66a-176.47b+124.88c+83.65ab-965.88ac-175.80bc-912.03a
2-588.53b2+511.85c2[0102]
r3=1535.86-87.75a-56.84b+34.48c+18.40ab-69.28ac-191.48bc-583.38a
2-89.01b
2-73.12c2[0103]
r4=26.67-1.36a+0.19b-0.32c+2.29ab-2.69ac+0.44bc-8.10a
2-2.41b
2-1.02c2[0104]
方差分析(anova)可以用来评估模型中系数的显着性,f值来确定不同变量的影响。p值表明因素对结果的影响程度且越低越显著。r2代表关联度(预测值与模型),方差分析结果如表4所示。
[0105]
表4响应面方差分析表
[0106][0107]
注:***表示极显著(p《0.001),**表示非常显著(p《0.01),*表示显著(p《0.05)
[0108]
从表4中可知,响应值r1(硒含量),r2(锌含量),r3(铬含量)和r4(生物量)回归模型均为p值小于0.05,失拟项均大于0.05,说明模型非常显著,失拟项不显著,则模型可用。对于响应值r1(硒含量),方程决定系数(r2)的值为99.58%,说明该方程可以解释超过99.58%的响应变化。调整决定系数(r
2adj
)的值为98.83%,与决定系数相差仅为0.65%,这更近一步说明该回归方程和试验数据拟合较好。一次项a、二次项a2和交互项ab的p值小于0.01,表明它们对模型贡献较大。
[0109]
响应值r2(锌含量)的方程决定系数(r2)值为95.76%,说明该分析可用来解释95.76%的实验结果。r
adj2
=88.12%,与r2较近,说明该模型有较好的拟合性。一次项a和二次项a2,交互项ac的p值小于0.01,表明其对模型贡献较大。
[0110]
响应值r3(铬含量)的确定系数r2=98.70%,r
adj2
=96.37%,说明该回归方程和试验数据拟合较好。且a2的p值小于0.001,说明其对模型有着显著的作用。
[0111]
响应值r4(生物量)的相关系数(r2=0.9084)较接近于1,表明预测保拉迪酵母l2生物量的模型是可靠的,所以可用回归方程代替试验真实点对响应值r4进行预测。
[0112]
利用design-expert软件对回归模型进行响应面分析,得到图10中响应值r1(硒含量)的2d等高线图和3d响应面图。从图10可以看出,ab、ac、bc之间有交互作用,各三维曲面图基本上呈拱形,即响应值r1随着各因素的变化出现从升高到降低过程,且具有最大值。
[0113]
培养时间、ph值和接种量对响应值r2(锌含量)影响的等高线图和响应面图如图11所示。
[0114]
通过图11中可知,等高线图均呈椭圆形,且3d图均为有凸起的拱形,这表示当三种物质中的一种浓度固定时,活菌数随着其他两个物质浓度的增加,活菌数有先增加后减小的趋势,并且最大值在中心点附近。
[0115]
对回归模型做响应面分析,进而得到各因素关于响应值r3(铬含量)的等高线图和响应面图,结果如图12所示。
[0116]
图12中的等高线图均近似椭圆形,三个3d响应面图大概呈开口朝下的穹顶状,说明当ph不变时,单位菌体铬含量随着时间和菌的接种量增加先增大后减小;当菌的接种量不变时,单位菌体铬含量随着ph值和培养时间的增加先增大后减小;当培养时间不变时,单位菌体铬含量随着菌的接种量和ph值的增加先增大后减小。且在中心点附近均出现极大
值。
[0117]
响应值r4(生物量)的试验残差及试验真实值与预测值对照如图13所示。由图13可知各因素之间存在交互作用,模型可用。
[0118]
使用design-expert 8.0.6软件对回归方程分析后,得到了制备富硒锌铬保拉迪酵母l2的最佳工艺参数的预测值。预测的到的最佳工艺条件培养时间48h,ph值5.29,接种量8.6%,且在该条件下,单位菌体内的硒含量1416.39μg/g,锌含量4402.558μg/g,铬含量1435.859μg/g,菌体生物量18.527g/l。经三组平行试验验证,菌体生物量为17.86g/l,单位菌体内的硒含量1405.01μg/g,锌含量4202.558μg/g,铬含量1398.77μg/g,较对照组(硒含量588.76μg/g,锌1061.54μg/g,930.57μg/g)分别提高了1.38,2.95和0.5倍。有机锌和有机铬的转化率分别达到89.44%,94.28%和87.15%。试验真实值与模型预测值十分接近,表明采用box-behnken响应面设计对制备富硒锌铬保拉迪酵母l2工艺的优化是可行的。
[0119]
7.富硒锌铬保拉迪酵母l2的微观形态观察及能谱分析
[0120]
将通过响应面优化得到的富硒锌铬保拉迪酵母l2,进行扫描电镜观察和x射线能谱分析,结果如图14和图15所示。图14中,a为5kx,b为10kx。
[0121]
与图1对照组相比,富集多种营养素的菌体表面出现内陷皱缩,菌体表面出现圆形颗粒物。与图3,图5和图7相比,菌体由单富集一种元素变为同时富集三种元素,细胞形态变化更加明显且菌体表面的颗粒物也明显增多。对这些颗粒物进行edx能谱分析,得到图15能谱分析图。从图中可以发现在1.204kev处有硒的特征峰,2.123kev处有锌的特征峰,0.573kev处有铬的特征峰。说明保拉迪酵母l2将亚硒酸钠,硫酸锌和三氯化铬经生物转化得到了有机的硒,锌和铬元素,且分布在菌体表面和菌体外。
[0122]
实施例2富硒锌铬保拉迪酵母l2冻干菌粉制备
[0123]
将活化至3代的种子发酵液按5%接种量接入ypd中,同时添加亚硒酸钠、硫酸锌和三氯化铬,37℃培养24h,离心收集菌泥(4℃,8000r/min,20min)。按照菌泥与冻干保护剂比为1:1添加冻干保护剂,利用真空冷冻干燥机进行冷冻干燥,在实验室前期研究的基础上,进行冻干保护剂的筛选,见表5。
[0124]
保护剂溶液的配制:将糖类、大分子保护剂、聚合物类中的一种或几种保护剂按一定的浓度用蒸馏水溶解,搅拌均匀,于121℃下灭菌15min,置于4℃冰箱中保存备用;脱脂乳于95℃灭菌30min,氨基酸经过0.22μm的滤膜过滤除菌。
[0125]
表5冻干保护剂种类
[0126]
[0127]
图16为不同冻干保护剂对保拉迪酵母l2菌粉产量(图a)、冻干存活率和单位菌粉活菌数(图b)的影响。(c为对照,c1,c2,c3,c4,c5分别为5种冻干保护剂)(*p《0.05,**p《0.01,***p《0.001)。图16(a)可以看出,是否添加冻干保护剂对保拉迪酵母l2冻干菌粉的量产生较大差异。以对照组c为参照,其他4组菌粉的产量差异性均极显著(p《0.001),表明添加冻干保护剂对冻干后保拉迪酵母l2的菌粉产量存在显著的影响。由于对照组未加抗冻因子和冻干保护剂,所以对照组冻干菌粉产量最少。c1号菌粉只添加了30%的脱脂乳,不与其它液体发生交联作用,在真空的作用下,一部分固形物将洒落在干燥机的空腔里,菌粉产量相对较低。添加保护剂配方的c2、c3、c4、c5号菌粉,c4号菌粉的量最高(10.29g/l),有利于菌粉产量的提升。
[0128]
图16(b)可以看出,以对照组c为参照,其他4组菌粉的冻干存活率均存在极显著(p《0.001)的影响。c4号菌粉的冻干存活最高,达到了83.65%,单位菌粉活菌数可达10.64logcfu/g,即活菌数为4.37
×
10
10
cfu/g,表明制备c4号菌粉确定的冻干保护剂配方效果明显,是保拉迪酵母l2冻干菌粉制备的理想抗冻保护剂。
[0129]
实施例3富硒锌铬保拉迪酵母l2菌粉贮藏稳定性考察
[0130]
(1)将制备的冻干菌粉样品分装在小铝箔袋中,将冻干菌粉封装于锡箔袋中,分别置于45℃、50℃和55℃下水浴。以活菌数为评价指标,每间隔2h取样测定一次活菌数,直至12h。
[0131]
(2)将保拉迪酵母l2菌粉按质量比1%的添加量加入羊奶粉中,用三维混料机混匀后,分装在铝箔袋中,通过测定在不同加速温度下的活菌数,来评价保拉迪酵母l2在羊奶粉的贮存稳定性。在45℃、50℃和55℃下,每间隔2h取样测定一次羊奶粉的活菌数,直至12h。
[0132]
富硒锌铬保拉迪酵母l2菌粉及其羊奶粉在不同温度下的失活速率常数k由式2计算得到,进而按式3推算菌粉及其羊奶粉在不同稳定性的失活速率常数k,预测其稳定性。
[0133]
lgn
t-lgn0=kt
ꢀꢀꢀ
(2)
[0134][0135]
式中n0为样品初始活菌数,n
t
为样品t时刻活菌数,单位均为cfu/ml;k和k0是速率常数,单位为h-1
;ea是活化能,单位为j/mol;r为理想气体常数,单位为j/mol
·
k;t为绝对温度,单位为k。
[0136]
a.富硒锌铬保拉迪酵母l2菌粉贮藏稳定性考察
[0137]
利用得到的富硒锌铬保拉迪酵母l2最佳保护剂配方制备冻干菌粉。根据上述实验方法,推测保拉迪酵母冻干菌粉在4℃(冷藏温度)和-18℃(冻藏温度)保藏1年活菌数。结果如图17所示。
[0138]
由图17(a)可以看出,lg(nt/n0)随着时间的增加不断减小,即保拉迪酵母l2的存活率不断下降。由图可以确定保拉迪酵母l2冻干菌粉在不同温度下的失活速率常数分别为:k
45
=0.1048(r2=0.9901)、k
50
=0.1922(r2=0.9960)、k
55
=0.3597(r2=0.9898)。三个温度下的失活速率常数反映出失活速率常数随温度的不断升高而增大,温度越高对菌体的损伤越大。为了达到较好的保藏效果,可将保拉迪酵母l2冻干菌粉保存在失活速率较低的低温环境中。
[0139]
根据公式3,将上述冻干菌粉失活速率常数的对数(lgk)对其绝对温度(1/t)作图,
得到结果如图17(b)所示。由趋势线方程lgk=-5585.4/t+16.582可推测出保拉迪酵母l2冻干菌粉在4℃(冷藏温度)和-18℃(冻藏温度)条件下的失活速率常数分别为k4=2.62
×
10-5
,k-18
=4.77
×
10-6
。通过公式3可反推出保拉迪酵母冻干菌粉在4℃(冷藏温度)保藏1年活菌数为2.69
×
109cfu/g,在-18℃(冻藏温度)保藏1年活菌数为1.74
×
109cfu/g。
[0140]
b.富硒锌铬保拉迪酵母羊奶粉稳定性考察
[0141]
将保拉迪酵母冻干菌粉与羊奶粉按照比例混匀,根据上述试验方法,推测保拉迪酵母羊奶粉在冷藏温度(4℃)和常温下(25℃)的保质期。结果如图18所示,其中,(a)不同温度下活菌数随时间的变化;(b)arrhenius图。
[0142]
由图18(a)可以看出,冻干菌粉与羊奶粉按照比例混匀后,在三个试验温度下的菌粉失活速率常数分别为:k
45
=0.0969(r2=0.9823)、k
50
=0.2052(r2=0.9806)、k
55
=0.3472(r2=0.9904)。根据图18(b)中确定的趋势线方程:lgk=-5785.9/t+17.196,可推测出保拉迪酵母羊奶粉在4℃(冷藏温度)和25℃(室温)条件下的失活速率常数分别为:k4=2.02
×
10-4
、k
25
=4.03
×
10-3
。以指标要求的最低活菌数106cfu/g为最终值,通过一级动力学反应方程(2)来预测保拉迪酵母羊奶粉的保质期,其在4℃、25℃下保存473天和80天后活菌数仍可达106cfu/g。
[0143]
实施例4菌粉及其羊奶粉中保拉迪酵母l2对模拟胃肠液的耐受性测定
[0144]
将10g羊奶粉完全溶解在90ml无菌生理盐水中,用无菌注射器吸取5ml加入至45ml的模拟胃液(nacl 9g/l,蛋白酶3g/l,ph=1.8)中,每间隔0.5h取样一次进行活菌计数,反应2h后转移5ml至45ml模拟肠液(nacl 9g/l,胰蛋白酶20g/l,胆盐3g/l,ph=6.5)中,每间隔1h取样一次进行活菌计数。
[0145]
富硒锌铬保拉迪酵母l2羊奶粉在模拟胃肠液中的活菌数变化见图19,其中,(a)为胃液,(b)为肠液。
[0146]
由图19可以看出,以相同添加量的菌粉为参照,以添加羊奶粉为试验组,结果表明当富硒锌铬保拉迪酵母l2羊奶粉在模拟胃液中处理2h后,添加羊奶粉的活菌数与对照组相比,说明益生菌菌粉经羊奶粉的包埋,在模拟胃液中有较好的存活能力。对照组菌粉在模拟胃液中的活菌数下降明显,表明无保护剂包裹的菌粉对模拟胃液的抵抗力差。在菌粉中添加了羊奶粉的实验组,在模拟胃液中处理2h后,其活菌数下降缓慢,说明羊乳粉对其在模拟胃液中有保护作用。
[0147]
将经胃液中处理2h后的样品转置于模拟肠液中,每隔1h测定一次肠液中的活菌数。随着消化时间的增加,两种样品活菌数的变化趋势均表现为先增加而后降低,当在模拟肠液中消化1h时,两种样品的活菌数均达到最大,这种增殖现象出现的原因可能是一些在低ph下活性受到抑制的益生菌开始逐渐恢复活性。jin等人报道当游离的益生菌经过胃液环境,然后转移到模拟肠液中会发生增殖,主要是当游离的益生菌处于强酸环境时,益生菌的细胞壁加强导致细胞膜的通透性发生改变,从而将h
+
隔离在细胞外面,进而保护细胞。保拉迪酵母l2羊奶粉在模拟胃肠液中的活菌数显著高于菌粉,说明羊奶粉的蛋白质、乳糖及低聚糖等成分对菌体在模拟胃肠液中有很好的保护作用,从而表现出良好的耐受性。
[0148]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1