一种细胞膜修复能力的评价方法与流程
1.本发明涉及细胞生物技术领域,尤其涉及一种细胞膜修复能力的评价方法。
背景技术:
2.细胞膜是包围在细胞表面的一层极薄的膜,也是其生存和发展的“保护伞”。细胞膜在划定细胞边界和将其与细胞外环境分离方面起着重要作用,是启动和执行关键信号转导过程的平台。在不同的细胞环境中,细胞膜的结构和组成各不相同,以提供对损伤的抵抗力。尽管有这种保护,存在于细胞外和细胞内环境的各种因素可以诱导细胞膜的化学破坏或物理破坏。维持细胞膜的完整性是细胞生存和内稳态的基础。细胞死亡是生物体中常见的现象。它是细胞衰老的必然结果,可能是由于激活细胞内部死亡程序或破坏性的环境力量对膜完整性的被动破坏造成的。细胞在“疾病和健康”中都会受到损伤,细胞膜完整性破坏会导致细胞死亡,但这并非是一个不可逆的过程。细胞可以容忍一定程度的细胞膜破损,破损的细胞膜可被细胞膜修复机制所修复,但是这种修复是有一定限度的。
3.机械、化学、微生物、免疫和细胞内应激源等方式都难免会对不同细胞膜造成不同程度的损伤。发生损伤后,一些分子通过胞吐、内吞等作用来抵抗这种“压力”,进而起到修复作用,以防止疾病的发生或恶化,对于维持机体的健康非常重要。但现在只存在一些细胞膜修复的检测装置,还未有一种在分子水平来评价细胞膜修复能力的方法。通过评价细胞膜是否具有修复能力,对控制各种病理生理条件下的炎症和组织损伤具有重要意义。
技术实现要素:
4.本发明针对现有技术中存在的空缺,提供了一种细胞膜修复能力的评价方法,以常规检测方法为基础,可以根据量化的实验结果,准确评价细胞膜修复能力,重复性好。
5.本发明所采用的技术方案是:
6.一种细胞膜修复能力的评价方法,包括采用感染信号感染单核-巨噬细胞,在mrna水平和蛋白水平检测膜蛋白atg9a和anxa7的表达情况以量化细胞膜破坏后的修复能力的步骤。
7.进一步地,将感染信号感染单核-巨噬细胞0h的膜蛋白atg9a和anxa7的相对表达量均设为1,分别计算感染一定时间后的膜蛋白atg9a和anxa7的相对表达量,大于1,表明分子表达量升高,细胞膜具有修复能力进行了修复;小于1,表明分子表达量较低或没有表达该分子,细胞膜未参与修复。
8.进一步地,所述感染信号为幽门螺杆菌感染;所述单核-巨噬细胞为人急性单核细胞白血病细胞系(human acute monocytic leukemia cell lines,thp-1)或人外周血分离的单核细胞。
9.进一步地,该细胞膜修复能力的评价方法实验选用人急性单核细胞白血病细胞系(human acute monocytic leukemia cell lines,thp-1)和人外周血分离的单核细胞为研究对象,感染信号为幽门螺旋杆菌,同时设置阳性对照菌大肠埃希菌,进行细胞膜修复能力
评价方法的验证。
10.进一步地,单核-巨噬细胞和幽门螺杆菌以1:1或1:10的比例建立共培养体系,感染时间选择1h和2h。
11.进一步地,上述一种细胞膜修复能力的评价方法,包括如下操作步骤:
12.(1)建立感染体系
13.采用体外共培养方法,先将thp-1细胞和幽门螺旋杆菌进行共培养,即得thp-1细胞被感染信号感染的体外共培养体系;同时,设置对照组,得到thp-1细胞培养对照组;
14.(2)步骤(1)的感染体系培养一定时间后,加入trizol,用于后续rna的提取、逆转录、实时荧光定量pcr实验;计算细胞内atg9a、anxa7的相对转录水平(以β-actin为内参);
15.(3)根据atg9a、anxa7的相对表达量数值,获得细胞修复能力的评价结果。
16.进一步地,步骤(1)体外共培养方法具体操作为:将幽门螺杆菌接种于thp-1细胞的六孔板内;幽门螺杆菌浓度为2.0
×
10e6—4.0
×
10e7cfu/ml,thp-1细胞浓度为2.0
×
10e6—4.0
×
10e6个/ml;对照组不接种幽门螺杆菌,仅接种thp-1细胞,thp-1细胞浓度为2.0
×
10e6—4.0
×
10e6个/ml。
17.进一步地,thp-1细胞和幽门螺杆菌以1:10浓度比建立共培养组。
18.进一步地,步骤(1)体外共培养条件:37℃,5%co2。
19.进一步地,步骤(2)具体包括:
20.s1在共培养1h后,加入trizol,反复吹吸;
21.s2提取rna,以提取的rna为模板逆转录合成cdna,利用生物信息学,设计atg9a、anxa7信号分子引物,进行实时荧光定量pcr反应,根据所得ct值,计算2
‑△△
ct
,得到目的基因相对表达量。
22.进一步地,步骤(2)共培养体系培养1h、2h后,加入trizol,反复吹吸,用于后续实验,具体步骤为:
23.弃去培养基上清,无菌pbs清洗一遍,加入1ml的rnaiso plus,吹打混匀,室温静置5min,12000g,4℃,离心5min,取出后放在冰上;离心结束后,上清至新1.5mlep管中,加入氯仿270μl,剧烈振荡混匀后,室温静置5min,12000g,4℃,离心5min,取出放冰上;上清(400-450μl)至新1.5mlep管中,加入同体积的异丙醇,振荡混匀后,室温静置10min,12000g,4℃,离心10min,取出放冰上;离心结束后,将上清弃去,加入75%乙醇1ml,涡旋振荡混匀,12000g,4℃,离心5min;离心结束后,将上清弃去,保留沉淀,干燥后,加入13μl(根据用量调整)的depc水,轻轻吹匀;在超微量分光光度计下测定rna浓度,根据所测浓度,以提取的rna为模板逆转录合成cdna,利用生物信息学,设计atg9a、anxa7信号分子引物,进行实时荧光定量pcr反应,根据所得ct值,计算2
‑△△
ct
,得到目的基因相对转录量。
24.进一步地,步骤(2)计算2
‑△△
ct
后,釆用graphpad prism 6.0软件进行统计学分析,每组实验至少重复3次,计量资料数据两组间均值比较正态分布采用t检验,以p《0.05为差异有统计学意义。
25.通过对细胞膜进行特异性荧光染料(dio,全称为3,3
′
[0026]-dioctadecyloxacarbocyanine perchlorate,)染色,在显微镜下观测细胞膜结构,辅助证明幽门螺杆菌感染的细胞膜的完整性。
[0027]
本发明的有益效果:
[0028]
(1)本发明的细胞膜修复能力的评价方法,是先采用thp-1细胞与感染信号幽门螺旋杆菌建立体外共培养模式,在共培养1h后分别在mrna水平检测atg9a、anxa7的表达情况,计算相对表达量,将培养0h设为1,实验组的相对表达量与0h相比,大于1,说明该分子表达量升高,提示参与了细胞膜修复;小于1,说明该分子表达量较低或没有表达该分子,提示并没有参与细胞膜的修复。
[0029]
(2)本发明后采用人外周血中的单核细胞与感染信号幽门螺旋杆菌建立体外共培养模式,同时用病原菌大肠埃希菌为阳性对照,在共培养后,分别在mrna水平检测atg9a、anxa7的表达情况,计算相对表达量,进一步验证了本发明的评价方法的可靠性,发现该方法重复性好。
附图说明
[0030]
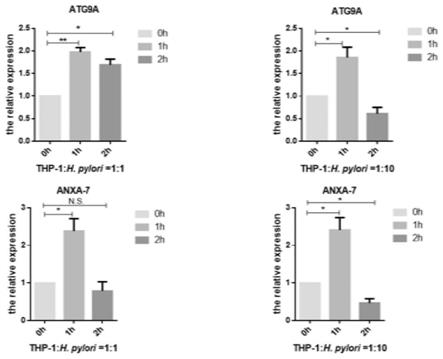
图1是本发明实施例中thp-1细胞的数据结果统计表(多组平行实验组试验数据统计平均值);
[0031]
图2是本发明实施例中人外周血单核细胞的数据结果统计表(多组平行实验组试验数据统计平均值);
[0032]
图3是本发明实施例中以病原菌大肠埃希菌为阳性对照,thp-1细胞和人外周血单核细胞数据比较结果统计表(多组平行实验组试验数据统计平均值)。
[0033]
图4是本发明实施例中显微镜下检测幽门螺杆菌感染的人外周血单核细胞膜结构的实验结果图(多组平行实验组试验数据统计平均值)。
具体实施方式
[0034]
为能清楚说明本方案的技术特点,下面通过具体实施方式,对本发明进行详细阐述。本发明中所使用的方法如无特殊规定,均为常规的方法;所使用的原料和装置,如无特殊规定,均为常规的市售产品。
[0035]
本发明提供的细胞膜修复能力的评价方法,细胞经lps+atp刺激后,细胞膜破裂严重,释放大量的ldh;而细胞经感染信号幽门螺旋杆菌刺激后,细胞膜保持基本完整。通过qrt-pcr实验,在mrna水平检测atg9a、anxa7的表达情况。
[0036]
具体步骤包括:
[0037]
步骤(1):选用thp-1细胞对这种细胞膜修复能力的方法进行验证。
[0038]
提前一天铺六孔板,孵箱(37℃,5%co2)中培养,至汇合度到80%(约2.0
×
10e6个/ml)。采用体外共培养方法,将thp-1细胞经幽门螺旋杆菌刺激,采用体外共培养技术将幽门螺杆菌和thp-1细胞共培养。
[0039]
实验组为:将幽门螺杆菌接种于有thp-1细胞的六孔板内后,共培养1h、2h;幽门螺杆菌为2.0
×
10e7cfu/ml,thp-1细胞为2.0
×
10e6个/ml,100μl/孔。
[0040]
设置对照组为:单核细胞的六孔板中不接种幽门螺杆菌,即仅接种thp-1细胞,thp-1细胞为2.0
×
10e6个/ml。
[0041]
步骤(2):分别在共培养1h、2h后,加入trizol,用于rna的提取;弃去培养基上清,无菌pbs清洗一遍,加入1ml的rnaiso plus,吹打混匀,室温静置5min,12000g,4℃,离心5min,取出后放在冰上;离心结束后,上清至新1.5mlep管中,加入氯仿270μl,剧烈振荡混匀
后,室温静置5min,12000g,4℃,离心5min,取出放冰上;上清(400-450μl)至新1.5mlep管中,加入同体积的异丙醇,振荡混匀后,室温静置10min,12000g,4℃,离心10min,取出放冰上;离心结束后,将上清弃去,加入75%乙醇1ml,涡旋振荡混匀,12000g,4℃,离心5min;离心结束后,将上清弃去,保留沉淀,干燥后,加入13μl(根据用量调整)的depc水,轻轻吹匀;
[0042]
在超微量分光光度计下测定rna浓度,根据所测浓度,以提取的rna为模板逆转录合成cdna,利用生物信息学,设计atg9a、anxa7信号分子引物,进行实时荧光定量pcr反应,根据所得ct值,计算2
‑△△
ct
,得到目的基因相对表达量。
[0043]
步骤(3):取人体外周血,采用密度梯度离心法分别分离出其中的单核细胞;
[0044]
步骤(4):将步骤(3)中分离出来的单核细胞按2.0
×
10e6/孔的密度接种于六孔板,在孵箱(37℃,5%co2)中静置1h;收集细胞,以此时的细胞为0小时。
[0045]
步骤(5):采用体外共培养方法,将单核细胞经感染信号幽门螺旋杆菌刺激。
[0046]
实验组为:将幽门螺杆菌接种于有单核细胞的六孔板内后,共培养1h、2h;幽门螺杆菌为2.0
×
10e7cfu/ml,人外周血分离的单核细胞为2.0
×
10e6个/ml,100μl/孔;
[0047]
设置对照组为:单核细胞的六孔板中不接种幽门螺杆菌,即仅接种人外周血分离的单核细胞,单核细胞为2.0
×
10e6个/ml。
[0048]
步骤(7)同步骤(2)。
[0049]
分别计算单核细胞和thp-1细胞1h、2h的2
‑△△
ct
,将0h数值设为1,实验组1h、2h与0h相比,大于1,说明该分子表达量升高,提示我们参与了细胞膜修复;小于1,说明该分子表达量较低或没有表达该分子,提示并没有参与细胞膜的修复。釆用graphpad prism 6.0软件进行统计学分析,每组实验至少重复3次,计量资料数据两组间均值比较正态分布采用t检验,以p《0.05为差异有统计学意义。
[0050]
下面结合附图及具体实施例对本发明的应用原理作详细描述。
[0051]
1材料与方法
[0052]
1.1实验主要试剂及厂家
[0053][0054]
1.2人外周血单核细胞采集自健康志愿者,细胞培养均釆用含10%胎牛血清的rpmi 1640,在37℃培养箱中培养;细胞取生长良好,细胞存活率(台盼蓝拒染法)>95%的
细胞进行实验。
[0055]
细胞系thp-1由本院中心实验室保存和提供。
[0056]
1.3方法
[0057]
1.3.1rna的提取及浓度测定
[0058]
弃去培养基上清,无菌pbs清洗一遍,加入1ml的rnaiso plus,吹打混匀,室温静置5min,12000g,4℃,离心5min,取出后放在冰上;离心结束后,上清至新1.5mlep管中,加入氯仿270μl,剧烈振荡混匀后,室温静置5min,12000g,4℃,离心5min,取出放冰上;上清(400-450μl)至新1.5mlep管中,加入同体积的异丙醇,振荡混匀后,室温静置10min,12000g,4℃,离心10min,取出放冰上;离心结束后,将上清弃去,加入75%乙醇1ml,涡旋振荡混匀,12000g,4℃,离心5min;离心结束后,将上清弃去,保留沉淀,干燥后,加入13μl(根据用量调整)的depc水,轻轻吹匀;
[0059]
在超微量分光光度计下测定rna浓度,根据所测rna浓度,以提取的rna为模板逆转录合成cdna。
[0060]
1.3.2逆转录
[0061]
(1)按照以下体系,按照每个样本1.5μg rna的上样量计算出样本和rnase-free water所需要的体积,使得总体系为20μl。
[0062]
逆转录反应体系
[0063][0064]
(2)加样完成后,瞬时离心,放在pcr仪中,按照25℃30min、42℃30min、85℃5min的程序进行反应,反应结束后得到cdna样本,可直接用于实时荧光定量pcr,若暂时不用于实验,可放于-20℃保存。
[0065]
1.3.3实时荧光定量pcr
[0066]
(1)引物合成:在ncbi数据库(https://www.ncbi.nlm.nih.gov/)中查询目的geneid,根据geneid在primerbank(https://pga.mgh.harvard.edu/primerbank/)数据库中查找atg9a、anxa7的引物。
[0067]
atg9a、anxa7引物序列
[0068][0069]
(2)按照以下反应体系,在八连管中加入以下各种成分,总体系为20μl;加样完成后,瞬时离心,后放于荧光定量pcr仪进行反应。
[0070]
qrt-pcr反应体系
[0071][0072]
1.3.4计算
△
ct目的基因=ct(目的基因)-ct(同一样本的目的基因);
△△
ct=实验组
△
ct目的基因-对照组
△
ct目的基因;2
‑△△
ct
=相对表达量(实验组/对照组),釆用graphpad prism 6.0软件进行统计学分析,每组实验至少重复3次,计量资料数据两组间均值比较正态分布采用t检验,以p《0.05为差异有统计学意义。
[0073]
1.3.5细胞膜染色将细胞种于细胞培养皿、多孔细胞培养板或者细胞爬片上,感染幽门螺杆菌2小时后,吸除细胞培养液,用pbs洗涤细胞两遍;加入适当体积的细胞膜染色工作液(含dio和dapi),37℃避光孵育细胞15分钟;吸除染色工作液,用pbs洗涤两次,然后加入适量室温细胞培养液即可在荧光显微镜下观察。dio的最大激发光波长为484nm,最大发射光波长为501nm。
[0074]
2结果
[0075]
2.1thp-1细胞和幽门螺旋杆菌(h.pylori)共培养体系按1:1、1:10共培养1h、2h后,通过qrt-pcr实验,在mrna水平上检测atg9a、anxa-7的转录水平情况,结果显示(如图1所示)。
[0076]
2.2选用人外周血提取的单核细胞进一步验证,细胞和幽门螺旋杆菌共培养体系按1:1、1:10共培养1h、2h后,通过qrt-pcr实验,在mrna水平上检测atg9a、anxa-7的转录含量,结果显示(如图2所示)。
[0077]
2.3以病原菌大肠埃希菌(e.coli)为感染源,thp-1细胞、人外周血单核细胞和病原菌大肠埃希菌共培养体系按1:10感染1h、2h后,细胞快速死亡,细胞膜失去完整性,修复能力减低,此时,通过qrt-pcr实验,在mrna水平上检测atg9a、anxa-7的转录水平,结果显示其转录显著性减低(如图3所示)。
[0078]
thp-1细胞和幽门螺旋杆菌共培养体系按1:1、1:10,共培养1h、2h后,收集细胞,检测atg9a、anxa-7的mrna表达水平,将0h设为1,在共培养体系1:1中,共培养1h、2h与0h相比,atg9a(1.98
±
0.08,p=0.0033)、atg9a(1.69
±
0.1,p=0.0113);anxa-7(2.38
±
0.27,p=0.0188)、anxa-7(0.79
±
0.2,p=0.2729)。在共培养体系1:10中,共培养1h、2h与0h相比,atg9a(1.85
±
0.19,p=0.0234)、atg9a(0.61
±
0.11,p=0.0398);anxa-7(2.41
±
0.21,p=0.0181)、anxa-7(0.47
±
0.094,p=0.0150),p值《0.05具有统计学意义。
[0079]
我们发现,当thp-1细胞和幽门螺旋杆菌共培养体系按1:1,共培养1h后,atg9a表达量增加,而共培养2h后,表达量又显著降低;anxa-7分子的表达水平也是在共培养1h时增加,在共培养2h的时候,表达水平降低。之后我们又将thp-1细胞和幽门螺旋杆菌共培养体系按1:10,重复实验操作,发现atg9a分子和anxa-7分子的变化趋势与thp-1细胞和幽门螺旋杆菌共培养体系1:1时相同,都是先升高后降低的趋势。
[0080]
选用人外周单核细胞对atg9a和anxa-7两种分子进一步验证。同样,单核细胞和幽门螺旋杆菌共培养体系按1:1、1:10,共培养1h、2h后,收集细胞,检测atg9a、anxa-7的mrna表达水平,将0h设为1,在共培养体系1:1中,共培养1h、2h与0h相比,atg9a(2.83
±
0.18,p=0.0032)、atg9a(0.38
±
0.09,p=0.0098);anxa-7(2.92
±
0.24,p=0.0075)、anxa-7(1.03
±
0.05,p=0.4582)。在共培养体系1:10中,共培养1h、2h与0h相比,atg9a(2.74
±
0.44,p=0.0302)、atg9a(0.46
±
0.17,p=0.0462);anxa-7(0.97
±
0.07,p=0.5622)、anxa-7(0.37
±
0.04,p=0.0019),p值《0.05具有统计学意义。
[0081]
我们发现,在单核细胞系中,atg9a和anxa-7变化趋势和在thp-1细胞中相同。单核细胞和幽门螺旋杆菌共培养体系按1:1,共培养1h后,发现atg9a表达量增加,而共培养2h后,表达量又显著降低;anxa-7分子的表达水平也是在共培养1h时增加,在共培养2h的时候,表达水平降低。之后我们又将单核细胞和幽门螺旋杆菌共培养体系按1:10,重复实验操作,发现atg9a分子和anxa-7分子的变化趋势与单核细胞和幽门螺旋杆菌共培养体系1:1时相同,都是先升高后降低的趋势。
[0082]
以病原菌大肠埃希菌为感染源,thp-1细胞、人外周血单核细胞分别与病原菌大肠埃希菌按共培养体系1:10,感染1h、2h后,收集细胞,检测atg9a、anxa-7的mrna表达水平,将0h设为1。在大肠埃希菌感染thp-1细胞的体系中,感染后1h,atg9a(0.77
±
0.07,p=0.0478)、anxa-7(0.75
±
0.07,p=0.0499),2h,atg9a(0.39
±
0.07,p=0.0071)、anxa-7(0.50
±
0.11,p=0.0235),在大肠埃希菌感染人外周血单核细胞的体系中,与0h相比,感染后1h,atg9a(0.11
±
0.03,p=0.0005)、anxa-7(0.08
±
0.04,p=0.0008),感染后2h,atg9a(0.05
±
0.004,p《0.0001);anxa-7(0.05
±
0.01,p《0.0001);p值《0.05具有统计学意义。
[0083]
与幽门螺杆菌感染相比,大肠埃希菌感染致细胞快速死亡,细胞膜破裂失去完整性和修复能力(如图4所示)。我们实验结果显示,在大肠埃希菌感染条件下,thp-1细胞和人外周血的单核细胞的atg9a和anxa-7两种分子转录水平均显著性降低,提示细胞膜修复能力减低,与细胞膜裂解并细胞死亡表现相一致。
[0084]
3.讨论
[0085]
细胞膜完整性对于机体起着至关重要的作用。当单核细胞受到外界刺激,如大肠埃希菌等病原微生物,会激活炎性小体,由于炎症小体的持续激活,细胞发生焦亡。经典的细胞焦亡通路是,在病原体、细菌等信号的刺激下,细胞内的nlr识别这些信号,激活caspase-1,活化的caspase-1可以识别和裂解成孔蛋白gsdmd,促使pro-il-1β和pro-il-18成熟后释放;一旦发生细胞焦亡,gsdmd蛋白的n-端高聚化并与脂类分子结合,在细胞膜上形成孔洞,细胞逐渐膨胀至细胞破裂,最终大量细胞内含物如il-1β释放,引发强烈的炎症反应。
[0086]
一些研究发现,在某些情况下,单核细胞能够在炎性小体激活的gsdmd裂解中存活,而不发生膜破裂。因此,存在一种负反馈机制在细胞膜修复发挥作用,而这种细胞膜修复对于人体健康起着重要的作用。
[0087]
atg9a传统上被视为重要的自噬因子,同时是一种跨膜蛋白,在最近的研究中被发现,在对抗与细胞焦亡和坏死性程序性细胞死亡途径相关的生理细胞膜破坏中发挥着重要的作用。
[0088]
膜联蛋白具有融合膜和聚集囊泡的能力,并且该功能在质膜修复以重新封闭膜损伤期间很重要。anxa7一直被认为与肿瘤进展有关。但在最近的研究中,anxa7鉴定为一种新型的质膜修复调节剂,在通过募集escrt iii机制介导质膜修复中的作用可能具有广泛的相关性。
[0089]
综上所述,本发明提供一种对于细胞膜修复能力的评价方法,借助atg9a和anxa7与细胞膜修复有关的分子,选用单核细胞,与幽门螺旋杆菌按不同比例建立共培养体系,通过qrt-pcr实验,检测共培养1h、2h后两种分子的表达情况。我们认为,atg9a和anxa7表达上调,提示我们发生了细胞膜修复;若表达下调,可能没有发生细胞膜修复或超过了细胞膜修复的限度。这提示我们,我们发明的这种细胞膜修复能力的评价方法,适用性且重复性好,这可能对控制各种病理生理条件下的炎症和组织损伤具有重要意义。
[0090]
上述具体实施方式不能作为对本发明保护范围的限制,对于本技术领域的技术人员来说,对本发明实施方式所做出的任何替代改进或变换均落在本发明的保护范围内。
[0091]
本发明未详述之处,均为本技术领域技术人员的公知技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1