5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物及制备方法
1.本发明属于有机合成技术领域,具体涉及一种5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物及其制备方法。
背景技术:
2.5,10,15,20-四芳基卟啉在化学催化、分子开关、阴离子传感器、生物相关的金属化学、光动力疗法、超分子自组装化学以及配位化学领域有着十分广阔的应用前景。而对5,10,15,20-四芳基卟啉进行衍生化研究,使其转化成5,10,15,20-四芳基叶绿素,为科学研究提供功能化的分子,则成为国内外研究的研究热点问题之一。
3.目前,关于5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物的合成方法还未见文献报道。经过本技术人的研究和多次尝试,独辟蹊径,经过大量实验探索,得到了一条简单的合成路线,只需通过一步法便合成得到了5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物,为5,10,15,20-四芳基叶绿素的合成提供一种全新的合成途径。
技术实现要素:
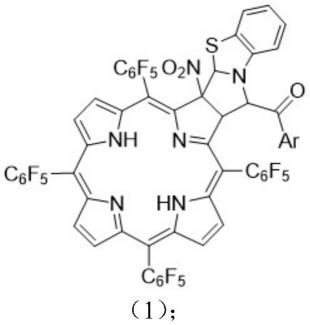
4.本发明的目的之一在于提供上述经过一步法合成的一种新的化合物5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物,其结构式如式(1)所示:
[0005][0006]
式(1)中,ar为式(2)至式(8)所示结构式中的一种:
[0007][0008]
本发明的目的之二在于提供上述5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物的制备方法,它包括如下顺序的步骤:
[0009]
(1)称取一定量的2-硝基-5,10,15,20-四(五氟苯基)卟啉、2-芳甲酰基苯并噻唑
溴化物和三乙胺置于反应器中;其中,2-芳甲酰基苯并噻唑溴化物的结构式如式(9)所示:
[0010][0011]
式(9)中,ar为式(2)至式(8)所示结构式中的一种:
[0012][0013]
(2)再向步骤(1)的反应器中加入二氯甲烷溶剂,在室温下搅拌1-3小时,用色谱方法跟踪反应;
[0014]
(3)待反应完全后,冷却至室温,直接用层析柱加以分离,洗脱剂为二氯甲烷和正己烷,收集第一红色带即为粗产品,粗产品经浓缩、干燥后即得目标化合物。
[0015]
优选的,步骤(1)中,所述2-硝基-5,10,15,20-四(五氟苯基)卟啉、2-芳甲酰基苯并噻唑溴化物和三乙胺三种反应物的物质的量之比为1:2:3。
[0016]
具体的,步骤(2)中,所述跟踪反应的色谱方法是薄层色谱法、气相色谱法和高效液相色谱法中的任意一种。
[0017]
优选的,步骤(3)中,所述洗脱剂是体积比为1:3的二氯甲烷与正己烷的混合溶剂。
[0018]
与现有技术相比,本发明具有如下特点和有益效果:
[0019]
(1)5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物的合成方法目前未见文献报道,具有反应条件温和、操作简单安全等特点,是一项全新的技术。
[0020]
(2)本发明方法可通过改变苯环上不同取代基,可制备得到不同取代基的5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物。
[0021]
(3)用本发明方法制备的5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物在光动力治疗癌症上的研究与应用上具有潜在重要意义。
附图说明
[0022]
图1、图2分别是本发明实施例1的目标产物5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素的高分辨质谱计算值和高分辨质谱图。
具体实施方式
[0023]
下面结合附图和具体实验实例对本发明做进一步详细的描述,具体实施例并不对本发明做任何限定。
[0024]
实施例1:
[0025]
称取2-硝基-5,10,15,20-四(五氟苯基)卟啉(0.05mmol)、2-苯甲酰基苯并噻唑溴
化物(0.10mmol)和三乙胺(0.15mmol)于25ml圆底烧瓶中,向上述反应器中加入二氯甲烷(4ml),室温搅拌反应1小时,用薄层色谱(tlc)跟踪反应,待反应完全后,用200-300目硅胶进行柱层析,用体积比为1:3的二氯甲烷和正己烷的混合溶剂作为洗脱剂,收集第一个洗脱带的溶液,收集到的溶液经浓缩、干燥后得到深棕色产物,即得产品5,10,15,20-四(五氟苯基)-2,3-苯并噻唑稠合叶绿素化合物,产率为57%。
[0026]
产物波谱表征数据如下:1h nmr(400mhz,cdcl3,298k)δ:-2.19(br,1h),-2.17(br,1h),5.12-5.14(m,1h),6.27-6.31(m,1h),6.53-6.55(m,1h),6.68-6.70(m,1h),6.77-6.82(m,1h),6.98-7.00(m,1h),7.04(s,1h),7.37-7.40(m,2h),7.48-7.52(m,2h),7.62-7.66(m,1h),8.34-8.41(m,2h),8.54-8.59(m,2h),8.73-8.80(m,2h).uv-vis(ch2cl2)λ
max
/nm(logε):407(4.96),503(3.91),531(3.52),594(3.38),647(4.26).api-hrms calc.for c
59h21f20
n6o3s
+
[m+h]
+
:1273.1071,found:1273.1071。
[0027]
光谱数据表明上述制备方法得到了5,10,15,20-四(五氟苯基)-2,3-(苯甲酰基)苯并噻唑稠合叶绿素。
[0028]
实施例2:
[0029]
本实施例采用与实施例1基本相同的合成工艺,不同之处是,原料改为2-(4-溴)苯甲酰基苯并噻唑溴化物,得深棕色产物,即得产品5,10,15,20-四(五氟苯基)-2,3-(4-溴苯甲酰基)苯并噻唑稠合叶绿素,产率为61%。
[0030]
产物波谱表征数据如下:1h nmr(400mhz,cdcl3,298k)δ:-2.18(br,1h),-2.16(br,1h),5.06-5.07(m,1h),6.31-6.33(m,1h),6.58-6.62(m,1h),6.70-6.72(m,1h),6.82-6.85(m,1h),6.95-6.96(m,1h),7.04(s,1h),7.34-7.36(m,2h),7.53-7.55(m,2h),8.37-8.42(m,2h),8.56-8.60(m,2h),8.76-8.82(m,2h).uv-vis(ch2cl2)λ
max
/nm(logε):uv-vis(ch2cl2)λ
max
/nm(logε):407(5.07),503(4.04),531(3.65),594(3.52),647(4.39).api-hrms calc.for c
59h20
brf
20
n6o3s
+
[m+h]
+
:1351.0176,found:1351.0176。
[0031]
光谱数据表明上述制备方法得到了5,10,15,20-四(五氟苯基)-2,3-(4-溴苯甲酰基)苯并噻唑稠合叶绿素化合物。
[0032]
实施例3:
[0033]
本实施例采用与实施例1基本相同的合成工艺,不同之处是,原料改为2-(4-氯)苯甲酰基苯并噻唑溴化物,得深棕色产物,即得产品5,10,15,20-四(五氟苯基)-2,3-(4-氯苯甲酰基)苯并噻唑稠合叶绿素,产率为63%。
[0034]
产物波谱表征数据如下:1h nmr(400mhz,cdcl3,298k)δ:-2.18(br,1h),-2.15(br,1h),5.06-5.08(m,1h),6.31-6.33(m,1h),6.57-6.61(m,1h),6.70-6.72(m,1h),6.81-6.85(m,1h),6.95-6.97(m,1h),7.05(s,1h),7.35-7.38(m,2h),7.42-7.44(m,2h),8.37-8.42(m,2h),8.57-8.59(m,2h),8.76-8.82(m,2h).uv-vis(ch2cl2)λ
max
/nm(logε):407(5.01),503(3.98),531(3.58),594(3.44),647(4.32).api-hrms calc.for c
59h20
clf
20
n6o3s
+
[m+h]
+
:1307.0681,found:1307.0688。
[0035]
光谱数据表明上述制备方法得到了5,10,15,20-四(五氟苯基)-2,3-(4-氯苯甲酰基)苯并噻唑稠合叶绿素化合物。
[0036]
实施例4:
[0037]
本实施例采用与实施例1基本相同的合成工艺,不同之处是,原料改为2-(4-氟)苯
甲酰基苯并噻唑溴化物,得深棕色产物,即得产品5,10,15,20-四(五氟苯基)-2,3-(4-氟苯甲酰基)苯并噻唑稠合叶绿素化合物,产率为79%。
[0038]
产物波谱表征数据如下:1h nmr(400mhz,cdcl3,298k)δ:-2.19(br,1h),-2.17(br,1h),5.07-5.08(m,1h),6.29-6.31(m,1h),6.56-6.59(m,1h),6.70-6.71(m,1h),6.80-6.84(m,1h),6.96-6.97(m,1h),7.04(s,1h),7.06-7.08(m,2h),7.51-7.53(m,2h),8.36-8.41(m,2h),8.56-8.59(m,2h),8.75-8.81(m,2h).uv-vis(ch2cl2)λ
max
/nm(logε):407(5.02),503(3.97),531(3.56),594(3.41),647(4.33).api-hrms calc.for c
59h20f21
n6o3s
+
[m+h]
+
:1291.0977,found:1291.0974。
[0039]
光谱数据表明上述制备方法得到了5,10,15,20-四(五氟苯基)-2,3-(4-氟苯甲酰基)苯并噻唑稠合叶绿素化合物。
[0040]
实施例5:
[0041]
本实施例采用与实施例1基本相同的合成工艺,不同之处是,原料改为2-(3-氯)苯甲酰基苯并噻唑溴化物,得深棕色产物,即得产品5,10,15,20-四(五氟苯基)-2,3-(3-氯苯甲酰基)苯并噻唑稠合叶绿素化合物,产率为66%。
[0042]
产物波谱表征数据如下:1h nmr(400mhz,cdcl3,298k)δ:-2.18(br,1h),-2.16(br,1h),5.07-5.08(m,1h),6.32-6.33(m,1h),6.58-6.59(m,1h),6.72-6.74(m,1h),6.84-6.85(m,1h),6.95-6.96(m,1h),7.05-7.06(m,1h),7.33-7.63(m,4h),8.38-8.43(m,2h),8.58-8.60(m,2h),8.78-8.83(m,2h).uv-vis(ch2cl2)λ
max
/nm(logε):407(5.08),503(4.02),531(3.59),594(3.42),647(4.36).api-hrms calc.for c
59h20
clf
20
n6o3s
+
[m+h]
+
:1307.0681,found:1307.0684。
[0043]
光谱数据表明上述制备方法得到了5,10,15,20-四(五氟苯基)-2,3-(3-氯苯甲酰基)苯并噻唑稠合叶绿素化合物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1