一种原代上皮细胞的制备方法
1.本发明涉及一种生物材料的制备方法,具体地说,涉及一种原代上 皮细胞的制备方法。
背景技术:
2.上皮组织在体内扮演着重要的屏障保护作用,同时对组织再生起到 关键作用,因此成为生物医学研究的热点。体外培养的上皮细胞和上皮 类器官在药物毒性研究、个性化疗法、组织工程中有着广泛的应用 (driehuis,e.kretzschmar,k.clevers,h.establishment ofpatient-derived cancer organoids for drug-screening applications. nat protoc 2020;15(10):3380-3409)。原代上皮细胞的获取是构建 上皮体外培养模型的第一步,也是关键一环。现阶段对于牙龈上皮细胞 的提取主要分为两种技术路线,其一是组织块法,其二是酶消化法 (ska,a.nogowska,a.sikorska,m,et al,isolation andculture of human primary keratinocytes-a methods review.expdermatol 2019;28(2):107-112)。组织块法对细胞造成的附带伤害小, 但获取细胞的效率偏低(需要较长的时间才能获得足量的细胞)且容易 引入成纤维细胞污染;此外组织块法无法分离获得单个原代上皮细胞, 因此无法用于类器官模型的构建。近年来酶消化法已成为主流的上皮细 胞获取方法。酶消化法的核心是破坏上皮细胞间连接,进而将单个上皮 细胞从上皮组织中分离。目前研究中酶消化法多采用胰蛋白酶对组织进 行解离,但相较于其他组织,上皮组织的细胞间连接更难以破坏,因此 分离获得足量上皮细胞所需的时间相较其他组织细胞更长(hybbinette, s.m.lindberg.enzymatic dissociation of keratinocytesfrom human skin biopsies for in vitro cell propagation.expdermatol 1999;8(1):30-8)。另一方面,鉴于胰蛋白酶具有很强的消 化特性,长时间的消化会对细胞活性、形态、干性和其他生物学特性造 成影响,进而影响后续的培养体系建立(chen,r.h.zhu,j.zhang,etal.,the tolerance of human epidermal cells to trypsinization invitro.cell tissue bank 2020;21(2):257-264)。目前文献报道的 上皮细胞二维培养体系构建大多仍采用胰蛋白酶消化法,而类器官培养 体系的构建部分采用了胶原酶(driehuis,e.kretzschmar,k.clevers, h.establishment of patient-derived cancer organoids fordrug-screening applications.nat protoc 2020;15(10):3380-3409)。 后者的消化强度相较胰蛋白酶弱,因此可以减小消化过程中对细胞造成 的损伤;但同时由于消化效率偏低,无法在短时间内获取大量细胞,仅 适用于分离少量细胞的实验。总而言之,目前尚缺乏既可用于获取大量 细胞用于二维培养,又可最大限度减少对细胞干性损伤用于类器官构建 的消化手段。因此,改进原代细胞的获取方法对于构建体外培养的上皮 细胞体系尤为重要。
3.公开号为cn 106978391 a的中国发明专利申请公开了一种家禽胫骨 生长板软骨原代细胞分离培养方法。其中采用iv型胶原酶和透明质酸酶 结合消化获得软骨原代细胞,并使用含有胎牛血清、青霉素-链霉素以及 维生素c的高糖dmem/f12培养基生长。
4.上述方法针对上皮细胞获取及培养主要存在以下问题:该方法中采 用的iv型胶原酶特异性针对髓系细胞和骨/软骨组织具有较为特异的消 化作用,对于上皮组织的消化缺乏特异性;iv型胶原酶与透明质酸酶的 浓度均为80-100mg/ml。该浓度对于上皮组织的消化而言明显偏高,不利 于维持上皮细胞的活性、干性以及其他生物学特性;采用含有血清的dmem 培养基培养,该培养基在上皮细胞培养中容易引起成纤维细胞污染。
5.公开号为cn 110643572 a的中国发明专利申请公开了一种脐带间充 质干细胞的分离培养方法。其中采用中性蛋白酶、透明质酸酶、胶原酶 ii和dna酶混合消化液分离获取脐带间充质干细胞,并采用含有 fgf-basic和hgf生长因子的无血清间充质干细胞培养基生长。
6.上述方法针对上皮细胞获取及培养主要存在以下问题:采用的中性 蛋白酶对于间充质细胞具有较为特异的消化作用,但对于上皮组织的消 化特异性较差;采用的dna酶对于上皮组织的消化缺乏特异性,对于提 高消化效率没有显著意义;而且会加剧对于原代细胞活性及干性的破坏; 采用的ii型胶原酶特异性针对间充质来源细胞具有较为特异的消化作 用,对于上皮组织的消化缺乏特异性;采用的间充质干细胞培养基以及 fgf-basic生长因子对于上皮细胞的培养缺乏特异性,并且容易引起成纤 维细胞污染。
7.公开号为cn 113249317 a的中国发明专利申请公开了一种脐带间充 质干细胞的分离培养扩增方法。其中采用iv型胶原酶、透明质酸酶、dna 酶和2%血清替代物的平衡盐溶液作为消化液分离获得脐带间充质干细 胞,并采用间充质干细胞无血清培养基生长。
8.上述方法针对上皮细胞获取及培养主要存在以下问题:采用的dna 酶对于上皮组织的消化缺乏特异性,对于提高消化效率没有显著意义, 而且会加剧对于原代细胞活性及干性的破坏;采用的iv型胶原酶特异性 针对间充质来源细胞具有较为特异的消化作用,对于上皮组织的消化缺 乏特异性;采用的间充质干细胞培养基对于上皮细胞的培养缺乏特异性。
技术实现要素:
9.本发明就是为了解决现有技术中无法兼顾获取效率与细胞活性、干 性维持的技术问题,提供一种原代上皮细胞的制备方法,其可保证消化 效率的同时、更大限度地保留细胞的干性和增殖性,可以兼顾细胞获取 效率与细胞生物学特性的维持。
10.为此,本发明提供一种原代上皮细胞分离培养方法,包括如下步骤: 包括如下步骤:(1)上皮层组织的制备:将上皮组织用含有双抗的d-hanks 液冲洗,放入中性蛋白酶ii中消化;取出上皮组织,剥离粘膜下层,获 得上皮层组织;(2)上皮层组织的消化:将所述步骤(1)获得的上皮层 组织,用含有双抗的d-hanks液冲洗3遍,切分为大小1mm2的组织块, 而后放入胶原酶i型和透明质酸酶的混合消化液中消化;(3)细胞培养 体系的构建:向所述步骤(2)中的混合消化液中加入含有胎牛血清的dmem 培养基,经过滤后,离心,弃去上清液,d-pbs重悬沉淀后再次离心,得 到沉淀物;将沉淀物使用角化细胞培养基重悬,培养,获得原代上皮细 胞。
11.所述步骤(1)中,含有双抗的d-hanks液是指:能够清除可能残留 在上皮组织块表面的少量细菌等污染物。所述中性蛋白酶ii的作用在于 特异性破坏上皮层组织与上皮下层之间的桥粒蛋白连接体,有效分离获 得上皮层组织,避免因上皮下层分离不彻底导致培
养过程中引入成纤维 细胞污染。
12.步骤(2)中含有双抗的d-hanks液是指:通过冲洗去除上皮组织表 面残留的微量中性蛋白酶消化液,同时再次起到清除组织表面可能残留 的微量污染物的作用。所述步骤(2)中,采用了i型胶原酶与透明质酸 酶混合的消化液对上皮组织进行消化,消化时长4小时。采用i型胶原 酶是由于相比其他类型的胶原酶,i型胶原酶对于消化上皮组织具有较强 的特异性。以往研究中使用i型胶原酶的情形大多为需要获取少量细胞 的实验,单独使用胶原酶消化的效率偏低,因而将透明质酸酶与胶原酶 混合使用可以提高消化的效率。
13.所述步骤(3)中,先使用含有胎牛血清的dmem培养基抑制消化酶 的作用,并同时起到稀释消化液的效果;离心后再次使用d-pbs重悬是 考虑到胎牛血清对于胶原酶和透明质酸酶的抑制作用不显著,第一次离 心后可能残余少量消化酶,会对后续培养的细胞造成损伤;再次重悬后 d-pbs起到了进一步稀释残留消化酶的作用,离心再次重悬后剩余微量的 消化酶对于细胞的损伤可以忽略。
14.优选的,所述步骤(1)中,将上皮组织用含有双抗的d-hanks液冲 洗3遍,放入2.5mg/ml的中性蛋白酶ii溶液中,4℃消化8小时;取出 上皮组织,使用眼科镊剥离粘膜下层,保留上皮层组织;
15.优选的,所述步骤(2)中,用含有双抗的d-hanks液冲洗上皮层组 织3次,使用手术刀将上皮层组织分割为1x1mm2的组织块,而后放入 2mg/ml胶原酶i型与1mg/ml透明质酸酶的混合消化液中,37℃消化0.5~ 4小时,期间每半小时使用移液枪吹打1次。
16.优选的,所述步骤(3)中,向消化液中加入含有胎牛血清的dmem 培养基,移液枪充分吹打,经100μm细胞滤网过滤后离心5分钟,弃去 上清液,d-pbs重悬沉淀后再次离心5分钟,沉淀使用角化细胞培养基重 悬,接种于孔板上进行细胞培养。
17.优选的,所述步骤(3)中,所述角化细胞培养基使用如下成份制成: dmem/f12培养基、表皮生长因子egf添加剂、胰岛素、转铁蛋白、hepes 缓冲液、glutamax溶液、青霉素-链霉素溶液。
18.优选的,所述步骤(3)中,所述角化细胞培养基使用如下浓度的成 份制成:dmem/f12培养基、50ng/ml表皮生长因子egf添加剂、5μg/ml 胰岛素、5μg/ml转铁蛋白、10mmolml hepes缓冲液、1x glutamax溶 液、15mg/ml青霉素-链霉素溶液。
19.本发明具有以下有益效果:
20.(1)本发明通过将胶原酶i型与透明质酸酶结合,显著提高了消化 效率,获取的原代上皮细胞总数相较胰蛋白酶消化法高出68.42
±
3.54%, 活细胞数量相较胰蛋白酶消化法高出98.22
±
9.92%,活细胞占比相较胰 蛋白酶消化法高出17.59
±
4.04%;
21.(2)通过本发明中的消化方法获取的大鼠牙龈上皮细胞总细胞数以 及活细胞数相较传统的胰蛋白酶消化法分别高出113.67
±
21.36%, 303.47
±
28.75%;活细胞占比高出18.99
±
2.76%;
22.(3)通过本发明中的消化方法获取的大鼠食管上皮细胞总细胞数以 及活细胞数相较传统的胰蛋白酶消化法分别高出120.14
±
2.07%, 186.54
±
3.29%;活细胞占比高出30.45
±
0.79%;
23.(4)通过本发明中的消化方法获取的大鼠舌上皮细胞总细胞数以及 活细胞数相较传统的胰蛋白酶消化法分别高出52.44
±
14.21%, 134.61
±
20.45%;活细胞占比高出
53.85
±
10.84%;
24.(5)通过本发明中的消化方法获取的大鼠泌尿道上皮细胞总细胞数 以及活细胞数相较传统的胰蛋白酶消化法分别高出226.73
±
16.86%, 303.47
±
28.75%;活细胞占比高出23.16
±
2.76%;
25.(6)通过本发明中的消化方法获取的大鼠鼠尾上皮细胞总细胞数无 显著性差异,活细胞数及活细胞占比相较传统的胰蛋白酶消化法分别高 出27.76
±
15.08%,30.77
±
5.71%;
26.(7)本发明通过采用相对温和的消化方法,降低了消化酶对伪足等 细胞表面结构的破坏,获取的原代上皮细胞贴壁培养后细胞铺展范围相 较胰蛋白酶消化法更大,伪足伸展更加明显;
27.(8)本发明通过采用相对温和和的消化方法,降低了消化过程中对 细胞干性造成的损伤,获取的牙龈原代上皮细胞在消化后即刻ck-19阳 性和ki-67阳性的干细胞占比相较胰蛋白酶消化法分别高出 81.53
±
10.51%,40.31
±
0.72%;获取的鼠尾上皮细胞在消化后即刻pcna 阳性和ki-67阳性的干细胞占比相较胰蛋白酶消化法分别高出 25.99
±
3.70%,24.70
±
3.60%;
28.(9)本发明通过采用相对温和和的消化方法,降低了消化过程中对 细胞干性造成的损伤,获取的原代上皮细胞相比胰蛋白酶获取的细胞在 贴壁培养第3天ck-19阳性细胞荧光强度相较胰蛋白酶消化组高出 127.44
±
38.63%,ki-67阳性细胞荧光强度相较胰蛋白酶消化组高出 84.50
±
16.71%;贴壁培养第9天ck-19阳性细胞荧光强度相较胰蛋白酶 消化组高出102.51
±
22.13%,ki-67阳性细胞荧光强度相较胰蛋白酶消 化组高出119.12
±
33.97%;
29.(10)通过采用相对温和和的消化方法,获取的原代上皮细胞可以 在体外培养稳定传代至第三代。
附图说明
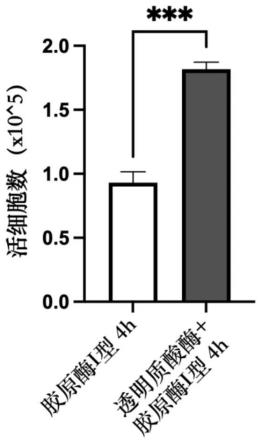
30.图1a和图1b是本研究中对比2mg/ml胶原酶i型单独消化与2mg/ml 胶原酶i型和1mg/ml透明质酸酶混合消化在相同时间(4小时)内消化 人牙龈上皮组织获得的原代细胞中活细胞数量(图1a)以及活细胞占比 (图1b);
31.图2a、图2b和图2c是本研究中对比0.25%胰蛋白酶-edta消化液(作 用0.5小时和4小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合 消化液(作用0.5小时和4小时)消化人的牙龈上皮组织获得的原代细 胞中总细胞数(图2a)、活细胞数(图2b)以及活细胞占比(图2c);
32.图3a、图3b和图3c是本研究中对比0.25%胰蛋白酶-edta消化液(作 用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化液(作 用2小时)消化人的牙龈上皮组织获得的原代细胞中总细胞数(图3a)、 活细胞数(图3b)以及活细胞占比(图3c);
33.图4a、图4b和图4c是本研究中对比0.25%胰蛋白酶-edta消化液(作 用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化液(作 用4小时)消化大鼠的舌上皮获得的原代细胞中总细胞数(图4a)、活细 胞数(图4b)以及活细胞占比(图4c);
34.图5a、图5b和图5c是本研究中对比0.25%胰蛋白酶-edta消化液 (作用0.5小时)
与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化 液(作用4小时)消化大鼠的食管上皮组织获得的原代细胞中总细胞数 (图5a)、活细胞数(图5b)以及活细胞占比(图5c);
35.图6a、图6b和图6c是本研究中对比0.25%胰蛋白酶-edta消化液 (作用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化 液(作用4小时)消化大鼠的牙龈上皮组织获得的原代细胞中总细胞数 (图6a)、活细胞数(图6b)以及活细胞占比(图6c);
36.图7a、图7b和图7c是本研究中对比0.25%胰蛋白酶-edta消化液 (作用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化 液(作用4小时)消化大鼠的泌尿道上皮组织获得的原代细胞中总细胞 数(图7a)、活细胞数(图7b)以及活细胞占比(图7c);
37.图8a、图8b和图8c是本研究中对比0.25%胰蛋白酶-edta消化液 (作用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化 液(作用4小时)消化大鼠的鼠尾上皮组织获得的原代细胞中总细胞数 (图8a)、活细胞数(图8b)以及活细胞占比(图8c);
38.图9a、图9b和图9c是本研究中对比0.25%胰蛋白酶-edta消化液 (作用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化 液(作用4小时)消化人的牙龈上皮组织获得的原代细胞贴壁培养后第3 天(图9a)和第9天(图9b)光学显微镜下形态差异以及贴壁第6天扫 描电镜下形态差异(图9c);
39.图10a、图10b、图10c和图10d是本研究中对比0.25%胰蛋白酶
ꢀ‑
edta消化液(作用0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸 酶混合消化液(作用4小时)消化人的牙龈上皮组织获得的原代细胞流 式细胞分析ki-67阳性细胞占比差异(图10a、图10b)与ck-19阳性细 胞占比差异(图10c、图10d);
40.图11a、图11b是本研究中对比0.25%胰蛋白酶-edta消化液作用0.5 小时(图11a)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化液作 用4小时(图11b)消化大鼠的鼠尾上皮组织获得的原代细胞中ki-17阳 性以及pcna阳性细胞占比流式分析;图11c以柱状图形式对比了两种消 化方法获得的原代细胞中ki-67阳性细胞占比;图11d以柱状图形式对 比了两种消化方法获得的原代细胞中pcna阳性细胞占比;
41.图12a、图12b是本研究中对比0.25%胰蛋白酶-edta消化液(作用 0.5小时)与2mg/ml胶原酶i型和1mg/ml透明质酸酶混合消化液(作用 4小时)消化人的牙龈上皮组织获得的原代细胞贴壁培养第3天(图12a) 和9天(图12b)固定后经免疫荧光染色观察,ki-67阳性以及ck-19阳 性细胞荧光强度差异;
42.图13a、图13b是本研究中经2mg/ml胶原酶i型和1mg/ml透明质 酸酶混合消化液消化4小时获得的原代细胞经3次传代后p1代与p3代 细胞光学显微镜(图13a)以及扫描电子显微镜下(图13b)形态。
具体实施方式
43.下面结合实施例对本发明做进一步描述。
44.本发明中,步骤(1)中中性蛋白酶的制备方法为将冻干粉状态的中 性蛋白酶ii溶解于含有10mm naac(ph 7.5)和5mm caac的缓冲液中, 制备成10mg/ml的储存液,-80℃保存;使用时4℃溶解储存液,使用含 有10mm naac(ph 7.5)和5mm caac的缓冲液稀释到2.5mg/ml。
45.步骤(2)中消化液制备方法为将4mg/ml一型胶原酶与等体积的2mg/l 透明质酸酶
的混合,4℃保存,全程避光操作,消化液避光保存。
46.实施例1
47.(1)上皮组织的获取与保存:本发明中的大鼠上皮组织可取自死后 1小时内的spf级sd大鼠的食管、表皮、舌、泌尿道上皮组织。例如北 京大学口腔医学院spf级动物实验室;人的牙龈上皮组织可取自临床牙 周手术废弃的牙龈上皮组织。
48.将获得的上皮组织使用生理盐水冲去表面血迹后,4℃保存于含有 10μmol/l y-27632,5%青霉素-链霉素双抗的dmem/f12培养基中;上皮 组织确保在2小时内开始下一步的分离。
49.(2)上皮细胞的消化:通过中性蛋白酶ii型4℃消化8小时分离上 皮层与上皮下层组织;将分离获得的上皮层组织使用手术刀切分成1x1mm2大小的组织块,平均分成2组分别放入0.25%胰蛋白酶消化液或等体积的 2mg/ml胶原酶i型+1mg/ml透明质酸酶混合消化液中;胰蛋白酶消化30 分钟,胶原酶i型+透明质酸酶混合消化液消化4小时;达到各自消化时 间后胰蛋白酶组加入2倍体积的含有10%胎牛血清dmem培养基终止消化, 100μm细胞滤网过滤后离心5分钟;胶原酶i型+透明质酸酶混合消化液 组经100μm细胞滤网过滤后离心5分钟,弃去上清液,d-pbs重悬沉淀 后再次离心5分钟;
50.(3)上皮细胞的接种培养:弃去离心后的上清液,细胞沉淀使用培 养基重悬,接种于细胞培养板中;细胞培养孔板置于,置于温度37℃、 饱和湿度、体积分数为5%的co2培养箱中进行培养。
51.实施例2
52.选取步骤(2)中获得的人牙龈上皮细胞沉淀,使用角化细胞培养基 重悬,吸取20μl与等体积台盼蓝染液混合,加入载玻片中放入自动细 胞计数仪统计总细胞数、活细胞数和活细胞比率;
53.通过新方法获取的人牙龈原代上皮细胞总细胞数量、活细胞数量以 及或细胞占比均显著高于胰蛋白酶消化法获得的细胞。
54.实施例3
55.选取步骤(2)中获得的大鼠硬腭牙龈上皮细胞沉淀,使用角化细胞 培养基重悬,吸取20μl与等体积台盼蓝染液混合,加入载玻片中放入 自动细胞计数仪统计总细胞数、活细胞数和活细胞比率;
56.通过新方法获取的大鼠硬腭牙龈原代上皮细胞总细胞数量、活细胞 数量以及或细胞占比均显著高于胰蛋白酶消化法获得的细胞。
57.实施例4
58.选取步骤(2)中获得的大鼠舌上皮细胞沉淀,使用角化细胞培养基 重悬,吸取20μl与等体积台盼蓝染液混合,加入载玻片中放入自动细 胞计数仪统计总细胞数、活细胞数和活细胞比率;
59.通过新方法获取的大鼠舌原代上皮细胞总细胞数量、活细胞数量以 及或细胞占比均显著高于胰蛋白酶消化法获得的细胞。
60.实施例5
61.选取步骤(2)中获得的大鼠食管上皮细胞沉淀,使用角化细胞培养 基重悬,吸取20μl与等体积台盼蓝染液混合,加入载玻片中放入自动 细胞计数仪统计总细胞数、活细胞
数和活细胞比率;
62.通过新方法获取的大鼠食管原代上皮细胞总细胞数量、活细胞数量 以及或细胞占比均显著高于胰蛋白酶消化法获得的细胞。
63.实施例6
64.选取步骤(2)中获得的大鼠泌尿道上皮细胞沉淀,使用角化细胞培 养基重悬,吸取20μl与等体积台盼蓝染液混合,加入载玻片中放入自 动细胞计数仪统计总细胞数、活细胞数和活细胞比率;
65.通过新方法获取的泌尿道原代上皮细胞总细胞数量、活细胞数量以 及或细胞占比均显著高于胰蛋白酶消化法获得的细胞。
66.实施例7
67.选取步骤(2)中获得的大鼠尾部表皮细胞沉淀,使用角化细胞培养 基重悬,吸取20μl与等体积台盼蓝染液混合,加入载玻片中放入自动 细胞计数仪统计总细胞数、活细胞数和活细胞比率;
68.通过新方法获取的大鼠鼠尾原代上皮活细胞数量以及或细胞占比均 显著高于胰蛋白酶消化法获得的细胞。
69.实施例8
70.选取步骤(2)中获得的大鼠尾部表皮细胞沉淀,使用角化细胞培养 基重悬,经多聚甲醛固定、triton打孔、bsa封闭、一抗及二抗染色后 流式细胞仪分析ki-67及pcna阳性细胞占比。
71.实施例9
72.选取步骤(2)中获得的牙龈上皮细胞悬液,经多聚甲醛固定,triton 打孔,bsa封闭,一抗染色及二抗染色后将细胞经流式细胞仪分析ck-19 和ki-67阳性的细胞占比。
73.实施例10
74.选取步骤(3)中接种于孔板的牙龈上皮细胞,于培养的第3天和第 9天使用多聚甲醛固定,triton打孔,bsa封闭,一抗染色及二抗染色后 经免疫荧光检测ck-19阳性和ki-67阳性细胞中荧光强度的差异。
75.实施例11
76.选取步骤(3)中接种于孔板的牙龈上皮细胞,于培养的第6天固定, 扫描电子显微镜检测细胞伪足伸展等细微结构;于培养的第3天和第9 天光学显微镜观察细胞形态。
77.实施例12
78.选取步骤(3)中接种于孔板的牙龈上皮细胞,5天后第一次换液, 而后每2天换液直至原代上皮细胞达到80%的细胞汇合率;
79.使用0.125%胰蛋白酶-edta消化并按照1:3的比例传代培养,连续 培养3代;
80.选取培养第1代和第3代细胞汇合率达到80%的细胞光学显微镜及扫 描电子显微镜观察形体结构;
81.通过新方法获取的表皮原代上皮细胞总细胞数量、活细胞数量以及 或细胞占比均显著高于胰蛋白酶消化法获得的细胞。
82.惟以上所述者,仅为本发明的具体实施例而已,当不能以此限定本 发明实施的范围,故其等同组件的置换,或依本发明专利保护范围所作 的等同变化与修改,皆应仍属本
发明权利要求书涵盖之范畴。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1