一种基于固体发酵的产黄支顶孢霉高通量筛选方法与流程
1.本发明属于高通量筛选和工业微生物菌种选育技术领域,具体涉及一种基于固体发酵的产黄支顶孢霉高通量筛选方法。
背景技术:
2.头孢菌素c(cephalosporin c,英文简写cpc)是产黄支顶孢霉(acremonium chrysogenum)合成代谢的一种重要的β-内酰胺抗生素,是生产头孢类抗生素母核7-氨基头孢烷酸(7-aminocephalosporanic acid,英文简写7-aca)的关键前体物质。因此筛选cpc高产菌株一直是头孢类抗生素工业的重点研究方向。
3.cpc高产菌株的传统育种方法是使用摇瓶液体发酵培养,测定发酵液中的cpc含量,以筛选产黄支顶孢霉突变菌株,但该方法需要使用大量的摇瓶和摇床设备,菌种无菌制备和培养基配制工艺十分复杂,导致培养和筛选通量均十分有限。而高通量的微孔板培养方法在很长一段时间被证明在实际应用过程中非常困难,因为产黄支顶孢霉不仅形态多变,而且培养条件要求十分苛刻;产黄支顶孢霉菌丝在培养液中或是自由分散或是聚集成团生长,菌丝自由分散增加培养液粘度,影响培养体系通气;而成团生长粘度降低,造成营养供应的不均匀。因此,目前关于产黄支顶孢霉研究的瓶颈已经从遗传突变菌株的产生,转移到突变菌株培养和筛选条件参数的优化方面。如何提供一种产黄支顶孢霉高通量筛选是本领域亟待解决的问题。
技术实现要素:
4.本发明公开了一种基于固体发酵的产黄支顶孢霉高通量筛选方法,培养及筛选过程简便、快捷,筛选效率高,适于推广应用。
5.为了实现上述目的,本发明采用如下技术方案:
6.一种基于固体发酵的产黄支顶孢霉高通量筛选方法,包括如下步骤:
7.(1)取待筛选产黄支顶孢霉单菌落,制成单菌落混悬液,并使用亚精胺进行培养前处理;
8.(2)将处理后的单菌落混悬液涂布于添加有ph指示剂的固体发酵培养基上,进行培养;
9.(3)培养后根据固体发酵培养基的颜色变化筛选产黄支顶孢霉;头孢菌素c产量与发酵后ph值呈负相关。
10.经大量实验研究发现,高产头孢菌素c的产黄支顶孢霉在发酵后ph降至5.50
±
0.30,且头孢菌素c产量与发酵后ph值呈负相关,因此,利用这一规律,使用添加有ph指示剂的固体发酵培养基进行产黄支顶孢霉的发酵培养,根据颜色变化筛选产黄支顶孢霉,可保证较高的筛选正确率,并且有效简化筛选工艺。
11.进一步地,步骤(1)中,
12.经诱变育种获得的突变株,经遗传改造策略改造后的基因突变株(如经过基因工
程、基因编辑或系统代谢工程改造的菌株),或由于菌种退化需要进行复壮的分离单菌株均可作为待筛选产黄支顶孢霉。
13.进一步地,步骤(1)中,
14.待筛选产黄支顶孢霉单菌落制成单菌落混悬液后,使用亚精胺-pbs磷酸盐缓冲液进行培养前处理;
15.使用亚精胺-pbs磷酸盐缓冲液对待筛选产黄支顶孢霉单菌落进行混悬处理,制成单菌落混悬液;
16.所述亚精胺-pbs磷酸盐缓冲液中亚精胺的浓度为1.0~10.0mmol/l;
17.所述培养前处理时间为20-30min。
18.进一步地,步骤(2)中,
19.所述固体发酵培养基配方为:
20.果糖,20~30g/l;可溶性淀粉,15~30g/l;金枪鱼膏,15~25g/l;dl-甲硫氨酸,10~15g/l;硫酸铵,15~25g/l;聚蛋白胨,20~30g/l;mgso4·
7h2o,2~3g/l;feso4·
7h2o,1~2g/l;玉米浆,10~15ml/l;α-淀粉酶0.1~0.2g/l;琼脂糖,10~15g/l;ph=7.20
±
0.05;
21.进一步地,步骤(2)中,
22.所述ph指示剂包括溴甲酚蓝、溴甲酚紫、茜素磺酸钠、乙氧基黄叱精、儿茶酚紫、甲基红、溴百里酚蓝或二苯氨基脲等;
23.所述ph指示剂在固体发酵培养基中的添加浓度为0.1~10mmol/l。
24.进一步地,步骤(2)中,
25.所述固体发酵培养基置于孔板中;
26.培养条件为25-30℃培养7d。
27.进一步地,步骤(3)中,
28.对于头孢菌素c产量发生正突变的潜力高产产黄支顶孢霉而言,发酵后ph降至5.50
±
0.30。
29.进一步地,步骤(3)中,
30.对于头孢菌素c产量发生正突变的潜力高产产黄支顶孢霉而言,固体发酵培养基颜色发酵前后的变化分别为:
31.添加溴甲酚蓝,从深蓝紫色变为浅土黄色;
32.添加溴甲酚紫,从深紫色变为浅黄色;
33.添加茜素磺酸钠,从土橙红色变为土红色;
34.添加乙氧基黄叱精,从黄色变为土红色;
35.添加儿茶酚紫,从青紫色变为黄色;
36.添加甲基红,从土红色变为土黄色;
37.添加溴百里酚蓝,从深蓝色变为黄绿色;
38.添加二苯氨基脲,从深紫色变为土黄色。
39.进一步地,固体发酵培养基中的固化用成分为琼脂糖或琼脂;经前期研究工作发现,头孢菌素c在琼脂糖或琼脂形成的固体培养基中具有良好的扩散性,因此,可以通过检测发酵终点时固体发酵培养基中的头孢菌素c含量,作为高产菌株的筛选依据;
40.上述高通量筛选方法还包括头孢菌素c含量的测定:
41.将培养后带有菌体的固体发酵培养基加入无菌缓冲体系打碎,使用琼脂糖酶进行酶解,离心过滤后进行hplc检测,筛选高产头孢菌素c的菌株。
42.进一步地,所述无菌缓冲体系包括水或缓冲液;
43.酶解温度为37-42℃,酶解时间为20-30min。
44.综上所述,本发明公开了一种基于固体发酵的产黄支顶孢霉高通量筛选方法,相较于传统的药瓶液体发酵培养筛选方法简化了培养基筛选工艺,并且筛选正确率达80%以上,适于诱变育种、适应性进化或基因工程育种等处理后的高产突变株筛选以及退化的菌种复壮。
附图说明
45.图1所示为500株产黄支顶孢霉突变菌株摇瓶液体发酵结束后cpc含量及ph比较;
46.图2所示为500株产黄支顶孢霉突变菌株摇瓶液体发酵和孔板固体发酵结束后cpc含量比较;
47.图3所示为500株产黄支顶孢霉突变菌株孔板固体发酵结束后cpc含量及ph比较;
48.图4所示为产黄支顶孢霉原生质体;
49.图5所示为产黄支顶孢霉artp诱变致死曲线;
50.图6所示为cpc高产产黄支顶孢霉不同artp诱变菌株摇瓶液体发酵和孔板固体发酵cpc产量;
51.图7所示为cpc高产产黄支顶孢霉不同artp诱变菌株摇瓶液体发酵和孔板固体发酵cpc产量变化率;
52.图8所示为cpc高产产黄支顶孢霉不同artp诱变菌株摇瓶液体发酵和孔板固体发酵结束后培养基ph;
53.图9所示为孔板固体筛选和摇瓶液体筛选基本流程比较。
具体实施方式
54.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
55.实施例中所用菌株:
56.cpc低产产黄支顶孢霉菌株cgmcc 3.3795购自中国普通微生物菌种保藏管理中心。
57.cpc高产产黄支顶孢霉菌株acj001由焦作健康元生物制品有限公司(中国,焦作)提供。
58.实施例中所用培养基:
59.1、gym液体培养基:葡萄糖,5g/l;酵母提取物,5g/l;麦芽提取物,10g/l;ph=7.20
±
0.05。分装30ml于500ml带挡板三角瓶中,121℃
×
15min灭菌后冷却备用。
60.2、yps培养基:蔗糖,20g/l;胰蛋白胨10g/l;酵母提取物,5g/l;k2hpo4,2g/l;mgso4·
7h2o,1g/l;ph=7.20
±
0.05。分装量30ml于500ml带挡板三角瓶中,121℃
×
15min灭
菌后冷却备用。
61.3、单菌落分离固体培养基:可溶性淀粉,20g/l;甘氨酸,1g/l;聚蛋白胨,4g/l;酵母提取物,1g/l;硫酸铵,10g/l;kh2po4,1.6g/l;氯化钙,1g/l;mgso4·
7h2o,1g/l;琼脂粉,15g/l;ph=8.50
±
0.05。分装200ml于500ml普通三角瓶中,121℃
×
15min灭菌后冷却备用。
62.4、试管斜面固体一级种子培养基:麦芽浸出物肉汤,20g/l;麦芽糖,10g/l;酵母提取物5g/l;无水乙酸钠,1g/l;琼脂粉,20g/l;ph=7.00
±
0.05。分装量20ml于50ml玻璃大试管中,121℃
×
15min灭菌后摆斜面,冷却凝固后备用。
63.5、摇瓶液体二级种子培养基:葡萄糖,5g/l;蔗糖,35g/l;玉米浆10ml/l;硫酸铵,8g/l;dl-甲硫氨酸,0.5g/l;碳酸钙,5g/l;豆油,5ml/l;ph=7.20
±
0.05。分装量30ml于500ml带挡板三角瓶中,121℃
×
15min灭菌后冷却备用。
64.6、摇瓶液体三级种子培养基:葡萄糖,5g/l;蔗糖,35g/l;玉米浆10ml/l;硫酸铵,8g/l;dl-甲硫氨酸,0.5g/l;碳酸钙,5g/l;豆油,5ml/l;ph=7.20
±
0.05。分装量30ml于500ml带挡板三角瓶中,121℃
×
15min灭菌后冷却备用。
65.7、摇瓶液体发酵培养基:玉米淀粉,30g/l,麦芽糊精,60g/l;α-淀粉酶,0.2g/l;玉米浆,10ml/l;dl-甲硫氨酸,6g/l;尿素,2g/l;硫酸铵,11g/l;mgso4·
7h2o,3g/l;k2hpo4,9g/l;碳酸钙,5g/l;豆油,10ml/l;ph=7.20
±
0.05。分装量30ml于500ml带挡板三角瓶中,121℃
×
15min灭菌后冷却备用。
66.8、固体发酵培养基:果糖,20g/l;可溶性淀粉,20g/l;金枪鱼膏,16g/l;dl-甲硫氨酸,15g/l;硫酸铵,20g/l;聚蛋白胨,20g/l;mgso4·
7h2o,2g/l;feso4·
7h2o,1g/l;玉米浆,15ml/l;α-淀粉酶0.2g/l;琼脂糖,12g/l;ph=7.20。分装200ml于500ml普通三角瓶中,121℃
×
15min灭菌后冷却备用。
67.实施例所用试剂:
68.1、1mol/l山梨醇溶液:称取山梨醇182.18g至纯水定容至1l,过滤灭菌备用。
69.2、pbs缓冲溶液:nacl,8g/l;kcl,0.2g/l;na2hpo4,1.44g/l;kh2po4,0.24g/l;超纯水溶解上述组份,充分溶解后用0.1mol/l盐酸溶液调节ph=7.20
±
0.05;121℃
×
15min灭菌后冷却备用。
70.3、亚精胺-pbs缓冲溶液:准确称取分析纯亚精胺(购自上海晶纯生化科技股份有限公司,货号为s107071-25g)溶解于上述1l的pbs缓冲溶液中,配制成2.0mmol/l的亚精胺溶液溶解备用。
71.4、ph指示剂母液配制及使用方法:
72.(1)溴甲酚蓝:变色范围为ph4.0~5.6,准确称取溴甲酚蓝6.919g,加入100ml的超纯水使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取1ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
73.(2)溴甲酚紫:变色范围为ph3.5~5.5,准确称取溴甲酚紫5.402g,加入100ml的超纯水使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取1ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
74.(3)茜素磺酸钠:变色范围为ph3.7~5.3,准确称取茜素磺酸钠3.603g,加入100ml的超纯水使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取0.7ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
75.(4)乙氧基黄叱精:变色范围为ph3.5~5.5,准确称取乙氧基黄叱精2.972g,加入100ml的75%乙醇使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取1ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
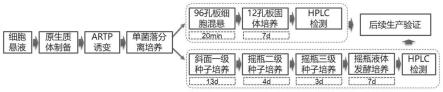
76.(5)儿茶酚紫:变色范围为ph6.0~7.0,准确称取儿茶酚紫3.864g,加入100ml的75%乙醇使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取3ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
77.(6)甲基红:变色范围为ph4.4~6.2,准确称取甲基红2.693g,加入100ml的75%乙醇使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取1ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
78.(7)溴百里酚蓝:变色范围为ph6.0~7.6,准确称取溴麝香草酚蓝6.243g,加入100ml的超纯水使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取2ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
79.(8)二苯氨基脲:变色范围为ph5.8~7.0,准确称取二苯氨基脲2.423g,加入100ml的75%乙醇使之充分溶解溶解后过滤除菌即为母液,冷藏避光保存;使用时吸取1ml加入到约50℃的250ml熔融孔板固体发酵培养基中迅速混合均匀。
80.实施例所用检测方法:
81.1.孔板固体发酵样品ph测定:用德国presens针形探针ph值微型传感器(型号为phnth-hp5)对固体培养后的上清酶解溶液ph进行检测。
82.2.摇瓶液体发酵样品ph测定:摇瓶液体发酵样品ph采用梅特勒托利多科技(中国)有限公司生产的seven compact s210-basic型ph/mv台式仪进行测定。
83.3.hplc色谱检测方法如下:
84.(1)流动相的配制:准确称取色谱级乙酸铵1.54g溶解至1l超纯水中,使用色谱纯乙酸调节ph至5.85,加入乙腈45ml,用0.22μm有机滤膜过滤,用超声波超声20min脱气后备用。
85.(2)色谱条件:色谱柱为phenomenex luna 5μm c18(2)250
×
4.6mm反相色谱柱;柱温为30℃;检测波长为260nm;流动相流速为1ml/min;进样量为5μl;走样时间为10min。
86.(3)以20mg/100ml的cpc标准品(由焦作健康元生物制品有限公司提供,纯度为≥95%)为参照,根据以下公式进行计算:
[0087][0088]
实施例1 cpc摇瓶液体发酵和孔板固体发酵结束后发酵数据相关性分析
[0089]
取500株产黄支顶孢霉头孢菌素c高产菌株acj001的artp诱变突变菌株和遗传改造突变菌株,分别进行摇瓶液体发酵和孔板固体发酵:
[0090]
摇瓶液体发酵:挑取单菌落的一半,均匀涂布试管斜面固体一级种子培养基上,25℃静置培养13d。从培养好的试管斜面固体一级种子培养基上刮取一环培养好的菌苔,转接摇瓶液体二级种子培养基,30℃下180rpm振荡培养4d,控制摇床内湿度在40%~60%。从培养好的摇瓶液体二级种子培养基中移取2ml,转接摇瓶液体三级种子培养基,30℃下180rpm振荡培养3d,控制摇床内湿度在40%~60%。从培养好的摇瓶液体三级种子培养基中移取
3ml,转接摇瓶液体发酵培养基,26℃下250rpm振荡培养7d,控制摇床内湿度在40%~60%。
[0091]
孔板固体发酵:挑取单菌落的一半,事先加有100μl生理盐水的96孔板中,并将菌落全部依次吹吸打散。然后,向每个孔中加入100μl含有2.0mmol/l亚精胺的pbs磷酸盐缓冲溶液,与菌悬液混合均匀,混合均匀后室温静置20min。然后吸取50μl均匀涂布于装有固体发酵培养基的12孔孔板上,每株菌涂布3个孔。涂布好后用纱布包好12孔板静置培养,28℃培养周期共7天整个培养周期内湿度控制40%~60%之间。
[0092]
发酵结束后,使用直径为0.80cm的无菌打孔器在长满菌苔的固体发酵培养基上方打孔。将打孔器挖取下来的圆柱形固体发酵培养基凝胶块完整的转移至2ml无菌离心管内,准确称量凝胶块样品质量并记录,加入直径2.5mm玻璃珠5颗,加入超纯水1.5ml,使用组织研磨仪研磨处理1min以使凝胶块被充分打散。加入0.5μl琼脂糖酶(0.5u/μl,thermofisher scientific生产,货号为eo0461)42℃水浴酶解消化30min,以使琼脂糖完全溶解并释放出目标代谢产物cpc。使用离心机12000rpm离心5min后收集上清酶解溶液,使用0.22μm无菌有机滤膜过滤上清并转移至棕色hplc样品瓶内以备进行高效液相色谱检测。
[0093]
摇瓶液体发酵后cpc产量及ph如图1所示,通过pearson相关性统计分析后发现,产黄支顶孢霉摇瓶发酵结束后主要产物头孢菌素c的单位产量与发酵结束后发酵液的最终ph存在着显著的负相关(pearson系数p=-0.8734)。当摇瓶发酵结束后,发酵液最终ph在5.40
±
0.20时,高产突变菌株(cpc含量》24g/l)的出现概率》85%。因此,考虑通过向筛选体系中添加适宜、适量的ph指示剂,提高丝状真菌产黄支顶孢霉初筛效率。
[0094]
进一步地,对500株产黄支顶孢霉acj001不同突变菌株的摇瓶液体发酵结果和12孔板固体发酵结果进行绘图(如图2)和数据统计分析,结果表明摇瓶液体发酵结果和12孔板固体发酵结果具有显著的正相关性(pearson系数p=0.8902)。上述结果表明以固态发酵作为cpc高产突变株的初筛策略能够替代摇瓶液体发酵。在相同的筛选实验周期内,采用固体培养方式作为产黄支顶孢霉突变株的筛选策略使筛选效率提高10~15倍。
[0095]
进一步地,对500个批次的产黄支顶孢霉头孢菌素c高产菌株acj001的artp诱变突变菌株和遗传改造突变菌株12孔板固体培养发酵初筛数据(如图3所示)进行pearson相关性统计分析后发现,产黄支顶孢霉12孔板固体发酵结束后主要产物头孢菌素c的单位产量与发酵结束后最终ph存在着显著的负相关(pearson系数p=-0.8106)。当固体发酵结束后,发酵酶解上清液最终ph在5.50
±
0.30时,高产突变菌株(cpc含量》6.5g/l)的出现概率》85%。上述结果表明,孔板固体筛选策略同样可以通过添加适宜、适量的ph指示剂,作为提高丝状真菌产黄支顶孢霉初筛效率的新策略。
[0096]
实施例2 ph指示剂的添加验证
[0097]
加入ph指示剂有助于实验人员通过固体发酵培养基颜色的变化发现更有可能是正突变的高产突变菌株。
[0098]
取出处于完全融化状态约50℃的固体发酵培养基,分别加入不同ph指示剂后迅速混合均匀,然后吸取2ml,快速分装加入12孔板中(注意移加过程避免产生气泡)。待孔板内固体发酵培养基完全凝固后备用。
[0099]
取cpc低产菌株cgmcc 3.3795和cpc高产菌株acj001,分别挑取单菌落于事先加有100μl生理盐水的96孔板中,并将菌落全部依次吹吸打散。然后,向每个孔中加入100μl含有2.0mmol/l亚精胺的pbs磷酸盐缓冲溶液并与菌悬液混合均匀,混合均匀后室温静置20min。
[0100]
分别吸取50μl静置处理后的菌悬液,均匀涂布于上述事先准备好的添加有ph指示剂的固体发酵培养基12孔板上,每株菌涂布3个孔,30℃下静置培养7d。培养7d后,每个孔上长满均匀致密的菌苔。用直径为0.80cm的无菌打孔器在长满菌苔的琼脂糖培养基上方打孔。将打孔器挖取下来的圆柱形固体培养基凝胶块完整的转移至2ml无菌离心管内,准确称量凝胶块样品质量并记录,加入直径2.5mm玻璃珠5颗,加入超纯水1.5ml,使用组织研磨仪研磨处理1min以使凝胶块被充分打散。加入0.5μl琼脂糖酶(0.5u/μl,thermofisher scientific生产,货号为eo0461)42℃水浴酶解消化30min,以使琼脂糖完全溶解并释放出目标代谢产物cpc。使用离心机12000rpm离心5min后收集上清酶解溶液,使用0.22μm无菌有机滤膜过滤上清并转移至棕色hplc样品瓶内以备进行高效液相色谱检测。
[0101]
结果如表1所示。
[0102]
表1两株菌固体发酵培养结束后ph、cpc含量及培养基颜色
[0103][0104]
实施例3产黄支顶孢霉artp诱变突变株的筛选
[0105]
1、接种:用无菌接种铲铲取新鲜产黄支顶孢霉acj001斜面菌苔接种至gym培养基中,30℃下160rpm振荡培养48h。
[0106]
2、转接:按每瓶5ml的接种量转接至yps液体培养基中,放置于30℃温控摇床中160rpm继续培养24h,余下gym菌液镜检。
[0107]
3、收菌酶解
[0108]
(1)用50ml离心管收集yps菌液,8000rpm离心15min,离心结束后弃去上清,余下锥形瓶内yps培养菌液镜检、拍照;
[0109]
(2)再用35ml无菌水洗1次,涡旋振荡1~2min,8000rpm离心10min,离心结束弃去上清;
[0110]
(3)再用35ml的1:1渗透压缓冲液(1mol/l山梨醇溶液)清洗1次离心菌体,8000rpm离心10min,离心结束弃去上清并称量菌体湿重,倒入约10粒左右玻璃珠(0.5mm直径),2ml渗透压缓冲液,涡旋1~2min,并转移至新的50ml无菌离心管内;
[0111]
(4)使用35ml的1:1渗透压缓冲液(1mol/l山梨醇溶液)再清洗洗1次离心菌体,8000rpm离心10min,弃去上清;
[0112]
(5)将过滤好的溶壁酶酶解液加入渗透压缓冲液洗过的菌体内,每0.1g/ml菌密度加入10mg/ml过滤除菌且现配现用的溶壁酶(美国sigma,l1412-5g)溶液,轻轻混匀,并开始计时,放置于30℃摇床中160rpm摇床振荡酶解,酶解2~3h(每半小时镜检)。
[0113]
4、原生质体的制备
[0114]
(1)酶解过程中每0.5h镜检一次,直至大部分菌丝体释放出原生质体,加入至少4倍体积的渗透压缓冲溶液终止酶解反应,使用八层擦镜纸过滤菌体酶解液(过滤前先用渗透压缓冲液润湿),3500rpm转速离心15min,离心结束后弃去上清;
[0115]
(2)10ml渗透压缓冲溶液清洗1次,3500rpm转速离心15min,离心结束后弃去上清;
[0116]
(3)用1ml渗透压缓冲溶液吹打混匀,并转移至1.5ml离心管中,3500rpm转速离心4min再沉淀,离心结束后弃去上清;
[0117]
(4)加入250μl渗透压缓冲液并轻轻吹吸菌体,重新混悬原生质体,备用。
[0118]
制备好的原生质体如图4所示。
[0119]
5、产黄支顶孢霉artp诱变
[0120]
常压室温等离子体诱变育种仪(artp购自清华大学无锡应用技术研究院生物育种研究中心,型号为artp-iis)工作前利用75%的乙醇溶液将操作台内部擦干净,打开紫外灯照射杀菌20min,诱变操作前先通入高纯氦气(he)进行机器预热。
[0121]
取制备好的产黄支顶孢霉acj001原生质体菌悬液10μl均匀涂布在灭菌载片表面,然后立即将涂布好菌悬液的载片转移至artp操作室内,用无菌镊子依次将载片放到对应凹槽内,将盛有700μl无菌生理盐水的2.0ml规格ep管固定在仪器下方固定凹槽的相应位置。
[0122]
设置样品处理参数。artp诱变装置采用99.999%的高纯氦气(he)作为离子体产生的出发气体,输入压力为0.15mpa,电源功率为120w,射频功率为13w,工作距离为4mm,等离子体的温度为28℃,气流量10slm。在气流量、福射距离确定的情况下,artp对样品的作用效果取决于照射时间的长短。分别设定了产黄支顶孢霉原生质体诱变的暴露时间分别为20s、40s、60s、80s、100s和120s等6组序列,以照射0s样品作为对照。
[0123]
样品诱变处理结束后,将装有载片的ep管震荡洗脱1min,样品载片洗脱后加入600μl生理盐水,并充分混匀,分别取100μl涂布5块单菌落分离培养基平板。涂布好的平板倒置放置恒温恒湿培养箱中静置培养,培养温度30℃,整个培养周期为13d;培养7d时观察菌落生长情况并进行菌落计数,做记录并初步估算致死率;培养结束后计算不同处理时间下菌株的致死率并绘制致死曲线(如图5所示),选择致死率》90%的时间序列样品进行固体孔板高通量筛选。
[0124]
6、突变株筛选
[0125]
对诱变后得到的原生质体混合细胞进行复苏培养,复苏培养结束后菌落分为两半,一半进行按实施例1中记载的方法摇瓶液体发酵。另一半按实施例2进行孔板固体发酵培养,固体发酵培养基中添加2mmol/l的儿茶酚紫指示剂;发酵结束后,使用直径为0.80cm的无菌打孔器在长满菌苔的固体发酵培养基上方打孔。将打孔器挖取下来的圆柱形固体发酵培养基凝胶块完整的转移至2ml无菌离心管内,准确称量凝胶块样品质量并记录,加入直径2.5mm玻璃珠5颗,加入超纯水1.5ml,使用组织研磨仪研磨处理1min以使凝胶块被充分打散。加入0.5μl琼脂糖酶(0.5u/μl,thermofisher scientific生产,货号为eo0461)42℃水浴酶解消化30min,以使琼脂糖完全溶解并释放出目标代谢产物cpc。使用离心机12000rpm离心5min后收集上清酶解溶液,使用0.22μm无菌有机滤膜过滤上清并转移至棕色hplc样品瓶内以备进行高效液相色谱检测。
[0126]
突变菌株摇瓶液体发酵和孔板固体发酵结束后出发菌株与50株随机挑选的突变株cpc产量如图6所示。
[0127]
采用摇瓶液体发酵培养基进行初筛时,与产黄支顶孢霉acj001相比,cpc产量增加率≥5%的正突变株有25株突变株(如图7所示);采用孔板固体发酵培养基进行初筛时,cpc产量增加率≥5%的正突变株有20株突变株。上述结果表明:采用孔板固体发酵培养基进行初筛与采用传统摇瓶液体发酵培养基进行初筛的方法相比,高产正突变株的筛选正确率达
到80%。
[0128]
采用孔板固体发酵培养时,与产黄支顶孢霉acj001相比,cpc产量增加率≥5%的20株正突变株中,有17株突变株的孔板固体培养基颜色发生了正确的转变(固体培养基颜色由接种前的青紫色变为培养结束后的黄色)。上述结果与ph测定结果基本一致(如图8所示)。上述结果表明:以0.2mmol/l的儿茶酚紫作为指示剂对产cpc产黄支顶孢霉进行高通量初步筛选,筛选正确率达到85%。
[0129]
为了衡量固体发酵培养基筛选与传统摇瓶液体发酵培养基筛选在筛选效率上的差异,本实施例所有实验均分别由1名经验丰富的实验人员从头到尾独自完成,实验时间起点从诱变菌株单菌落分离培养复苏后计算。本发明采用孔板固体培养时,每名实验技术人员能够一个批次对所有50~60株突变菌株同时进行筛选处理,整个操作周期约为8d;采用传统摇瓶液体培养时,每名实验技术人员一个批次仅能够对16~20株突变菌株同时进行筛选处理,整个操作周期约为28d(如图9所示)。因此,可知传统摇瓶液体筛选的试验周期大概是孔板固体筛选试验周期的3.5倍,而前者单人单批次可筛选的突变菌株数量却仅为后者的1/3。因此粗略估算,本发明所采用的孔板固体筛选策略的筛选效率约为摇瓶液体筛选的10.5倍。
[0130]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0131]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对上述实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1