一种基于三亚苯基的有机化合物及有机电致发光材料和器件的制作方法
一种基于三亚苯基的有机化合物及有机电致发光材料和器件
1.本技术为申请号2019111862550,申请日2019年11月28日,发明名称“一种基于三亚苯基的有机化合物及有机电致发光材料和器件”的分案申请。
技术领域
2.本发明涉及有机电致发光技术领域,具体涉及一种基于三亚苯基的有机化合物及有机电致发光材料和器件。
背景技术:
3.有机发光二极管(organic light emitting diode,oled),最初是由美籍华裔教授邓青云在实验室中发现的,从此以后人们展开了对oled的开发与研究。oled有两大应用领域:照明和显示。
4.oled属于一种电流型的有机发光器件,是通过载流子的注入和复合而致发光的现象,发光强度与注入的电流成正比。oled在电场的作用下,阳极产生的空穴和阴极产生的电子就会发生移动,分别向空穴传输层和电子传输层注入,迁移到发光层。当二者在发光层相遇时,产生能量激子,从而激发发光分子最终产生可见光。
5.oled器件一般由阴极、阳极、空穴注入层(hil)、电子注入层(eil)、空穴传输层(htl)、电子传输层(etl)、发光层(eml)等部分构成。每一层有机电致发光材料的选择使用对于oled器件性能起到决定性的作用,目前,oled器件还存在启动电压高、发光效率低、使用寿命短等诸多缺陷,寻找性能更优异的有机电致发光材料成为目前的首要任务,通过有机电致发光材料的合理使用可以极大的提升oled器件的性能,提高应用前景。
技术实现要素:
6.发明目的:针对上述技术问题,本发明提供了一种基于三亚苯基的有机化合物及有机电致发光材料和器件。
7.为了达到上述发明目的,本发明所采用的技术方案如下:
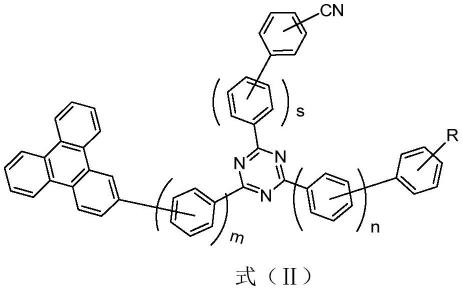
8.一种基于三亚苯基的有机化合物,其结构式如下式(ⅰ)所示:
[0009][0010]
其中,r为氢、氘、卤素原子、氰基、取代或未取代的c1-c5的烷基、取代或未取代的c6-c30的芳香族基团、取代或未取代的c5-c30的杂芳族基团中的任意一种;
[0011]
x、y、z各自独立的为ch或n,且x、y、z中至少一个为n;
[0012]
m、s、n各自独立的为0或1。
[0013]
进一步地,所述有机化合物的结构式为下式(ⅱ)、式(ⅲ)、式(ⅳ)、式(
ⅴ
)中的一种:
[0014][0015]
其中,r为氢、氘、卤素原子、氰基、取代或未取代的c1-c5的烷基、取代或未取代的c6-c30的芳香族基团、取代或未取代的c5-c30的杂芳族基团中的任意一种;
[0016]
m、s、n各自独立的为0或1。
[0017]
进一步地,r为氢、氘、氟原子、氰基、甲基、乙基、异丙基、叔丁基、苯基、萘基、蒽基、菲基、三亚苯基、芴基、氧芴基、9,9-二甲基芴基、9,9'-螺二芴、9,9-二苯基芴基、硫芴基、咔唑基、n-苯基咔唑基;
[0018]
所述甲基、乙基、异丙基、叔丁基、苯基、萘基、蒽基、菲基、三亚苯基、芴基、氧芴基、9,9-二甲基芴基、9,9'-螺二芴、9,9-二苯基芴基、硫芴基、咔唑基、n-苯基咔唑基为未取代的或是其中至少一个氢被氘取代得到的。
[0019]
进一步地,所述有机化合物的结构如下所示:
[0020]
[0021]
[0022]
[0023]
[0024]
[0025]
[0026]
[0027]
[0028]
[0029]
[0030][0031]
一种有机电致发光材料,包含至少一种上述有机化合物。
[0032]
上述有机电致发光材料在制备有机电致发光器件中的应用。
[0033]
一种有机电致发光器件,包括:阳极、空穴注入层、空穴传输层、发光层、电子传输层、电子注入层以及阴极顺次堆积的构造;所述电子传输层中含有上述有机电致发光材料。
[0034]
本发明公开了一种含有上述有机电致发光器件的有机电致发光显示设备。
[0035]
本发明还公开了一种含有上述有机电致发光器件的有机电致发光照明设备。
[0036]
本发明所述室温均为25
±
5℃。
[0037]
本发明的有益效果:
[0038]
该发明设计了一种基于三亚苯基的有机化合物,其具有高的电子迁移率,适合作为oled电子传输材料,三亚苯基团具有非常优异的电子迁移速率和很好的刚性及热稳定性,该基团的加入能够大幅度提高材料的tg值,使材料具有很好的热稳定性、化学稳定性及形貌稳定性,能够防止材料的结晶化。同时,吸电子取代基氰基的引入能够进一步增加其电子传输速率,进而提高器件的效率,降低器件的驱动电压,达到节省能源的效果。
附图说明
[0039]
图1为本发明提供的有机电致发光器件的结构示意图;
[0040]
图中标号分别代表:
[0041]
1-阴极、2-电子注入层、3-电子传输层、4-发光层、5-空穴传输层、6-空穴注入层、7-阳极。
[0042]
图2为本发明有机化合物(1)的tga图谱,由图2可知,本发明有机化合物(1)的td值为384.50℃。
具体实施方式
[0043]
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0044]
实施例1:
[0045][0046]
有机化合物(1)的合成方法如下:
[0047]
s1:
[0048][0049]
将化合物1-a(5g,317.76g/mol,15.89mmol)、化合物1-b(1.1eq,2.57g,146.94g/mol,17.47mmol)和碳酸钠(2eq,3.37g,105.99g/mol,31.77mmol)加入到乙二醇二胺醚(100g,化合物1-a的20倍质量)和水(100g,化合物1-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.24g,304.37g/mol,0.79mmol)和乙酸钯(ii)(1%eq,0.04g,224.51g/mol,0.16mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物1-c(4.96g,收率91.8%),ms(ei):339(m+)。
[0050]
s2:
[0051][0052]
将化合物1-c(4g,339.97g/mol,11.84mmol)、化合物1-d(1.1eq,4.53g,348.20g/mol,13.02mmol)和碳酸钠(2eq,2.51g,105.99g/mol,23.68mmol)加入到乙二醇二胺醚(80g,化合物1-c的20倍质量)和水(80g,化合物1-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.59mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物1-e(4.68g,收率70.2%),ms(ei):563(m+)。
[0053]
s3:
[0054][0055]
将化合物1-e(4g,563.45g/mol,7.12mmol)、化合物1-f(1.1eq,1.15g,121.93g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物1-e的20倍质量)和水(80g,化合物1-e的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再
经过柱层析后得到有机电致发光材料(1)(3.51g,收率88.1%),ms(ei):560(m+)。
[0056]
实施例2:
[0057][0058]
有机化合物(6)的合成方法如下:
[0059][0060]
将化合物2-a(4g,563.45g/mol,7.12mmol)、化合物2-b(1.1eq,1.39g,178.04g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物2-a的20倍质量)和水(80g,化合物2-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机电致发光材料(6)(3.79g,收率86.5%),ms(ei):616(m+)。
[0061]
实施例3:
[0062][0063]
有机化合物(7)的合成方法如下:
[0064][0065]
将化合物3-a (4g,563.45g/mol,7.12mmol)、化合物3-b(1.1eq,1.55g,198.03g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物3-a的20倍质量)和水(80g,化合物3-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机电致发光材料(7)(3.9g,收率86.1%),ms(ei):636(m+)。
[0066]
实施例4:
[0067][0068]
有机化合物(8)的合成方法如下:
[0069][0070]
将化合物4-a(4g,563.45g/mol,7.12mmol)、化合物4-b(1.1eq,1.94g,248.08g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物4-a的20倍质量)和水(80g,化合物4-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机电致发光材料(8)(3.99g,收率81.7%),ms(ei):686(m+)。
[0071]
实施例5:
[0072][0073]
有机化合物(10)的合成方法如下:
[0074][0075]
将化合物5-a(4g,339.97g/mol,11.84mmol)、化合物5-b(2.1eq,8.65g,348.20g/mol,24.86mmol)和碳酸钠(4eq,5.02g,105.99g/mol,47.35mmol)加入到乙二醇二胺醚(80g,化合物5-a的20倍质量)和水(80g,化合物5-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.59mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(10)(6.16g,收率66.2%),ms(ei):786(m+)。
[0076]
实施例6:
[0077][0078]
有机化合物(12)的合成方法如下:
[0079][0080]
将化合物6-a(4g,563.45g/mol,7.12mmol)、化合物6-b(1.1eq,2.26g,288.11g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物6-a的20倍质量)和水(80g,化合物6-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(12)(3.73g,收率72.2%),ms(ei):726(m+)。
[0081]
实施例7:
[0082][0083]
有机化合物(13)的合成方法如下:
[0084][0085]
将化合物7-a(4g,563.45g/mol,7.12mmol)、化合物7-b(1.1eq,2.46g,314.19g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物7-a的20倍质量)和水(80g,化合物7-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(13)(3.78g,收率70.6%),ms(ei):752(m+)。
[0086]
实施例8:
[0087][0088]
有机化合物(19)的合成方法如下:
[0089][0090]
将化合物8-a(4g,563.45g/mol,7.12mmol)、化合物8-b(1.1eq,1.09g,138.97g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物8-a的20倍质量)和水(80g,化合物8-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(19)(3.71g,收率90.2%),ms(ei):577(m+)。
[0091]
实施例9:
[0092][0093]
有机化合物(21)的合成方法如下:
[0094]
s1:
[0095][0096]
将化合物9-a(4g,339.97g/mol,11.84mmol)、化合物9-b(1.1eq,4.53g,348.20g/mol,13.02mmol)和碳酸钠(2eq,2.51g,105.99g/mol,23.68mmol)加入到乙二醇二胺醚(80g,化合物9-a的20倍质量)和水(80g,化合物9-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.59mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物9-c(4.78g,收率71.8%),ms(ei):563(m+)。
[0097]
s2:
[0098][0099]
将化合物9-c(4g,563.45g/mol,7.12mmol)、化合物9-d(1.1eq,1.15g,121.93g/mol,7.83mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.23mmol)加入到乙二醇二胺醚(80g,化合物9-c的20倍质量)和水(80g,化合物9-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(21)(3.33g,收率83.5%),ms(ei):560(m+)。
[0100]
实施例10:
[0101][0102]
有机化合物(41)的合成方法如下:
[0103]
s1:
[0104][0105]
将化合物10-a(5g,317.76g/mol,15.89mmol)、化合物10-b(1.1eq,3.9g,223.03g/mol,17.47mmol)和碳酸钠(2eq,3.37g,105.99g/mol,31.77mmol)加入到乙二醇二胺醚(100g,化合物10-a的20倍质量)和水(100g,化合物10-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.24g,304.37g/mol,0.79mmol)和乙酸钯(ii)(1%eq,0.04g,224.51g/mol,0.16mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物10-c(5.59g,收率84.5%),ms(ei):416(m+)。
[0106]
s2:
[0107][0108]
将化合物10-c(5g,416.07g/mol,12.08mmol)、化合物10-d (1.1eq,4.63g,348.20g/mol,13.29mmol)和碳酸钠(2eq,2.56g,105.99g/mol,24.16mmol)加入到乙二醇二胺醚(100g,化合物10-c的20倍质量)和水(100g,化合物10-c的20倍质量)中,搅拌混匀后再
依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.6mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物10-e(5.16g,收率66.9%),ms(ei):639(m+)。
[0109]
s3:
[0110][0111]
将化合物10-e(5g,639.54g/mol,7.84mmol)、化合物10-f(1.1eq,1.05g,121.93g/mol,8.62mmol)和碳酸钠(2eq,1.66g,105.99g/mol,15.67mmol)加入到乙二醇二胺醚(100g,化合物10-e的20倍质量)和水(100g,化合物10-e的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.12g,304.37g/mol,0.39mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.08mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(41)(4.22g,收率84.6%),ms(ei):636(m+)。
[0112]
实施例11:
[0113][0114]
有机化合物(41)的合成方法如下:
[0115]
s1:
[0116][0117]
将化合物11-a(5g,317.76g/mol,15.89mmol)、化合物11-b(1.1eq,3.9g,223.03g/mol,17.47mmol)和碳酸钠(2eq,3.37g,105.99g/mol,31.77mmol)加入到乙二醇二胺醚(100g,化合物11-a的20倍质量)和水(100g,化合物11-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.24g,304.37g/mol,0.79mmol)和乙酸钯(ii)(1%eq,0.04g,224.51g/mol,0.16mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物11-c(5.62g,收率85%),ms(ei):416(m+)。
[0118]
s2:
[0119][0120]
将化合物11-c(5g,416.07g/mol,12.08mmol)、化合物11-d(1.1eq,4.63g,348.20g/mol,13.29mmol)和碳酸钠(2eq,2.56g,105.99g/mol,24.16mmol)加入到乙二醇二胺醚(100g,化合物11-c的20倍质量)和水(100g,化合物11-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.6mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物11-e(4.96g,收率64.4%),ms(ei):639(m+)。
[0121]
s3:
[0122][0123]
将化合物11-e(4g,639.54g/mol,6.27mmol)、化合物11-f(1.1eq,1.05g,436.31g/mol,6.9mmol)和碳酸钠(2eq,1.33g,105.99g/mol,12.54mmol)加入到乙二醇二胺醚(80g,化合物11-e的20倍质量)和水(80g,化合物11-e的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.10g,304.37g/mol,0.31mmol)和乙酸钯(ii)(1%eq,0.01g,224.51g/mol,0.06mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(54)(3.72g,收率62.4%),ms(ei):951(m+)。
[0124]
实施例12:
[0125][0126]
有机化合物(69)的合成方法如下:
[0127]
s1:
[0128][0129]
将化合物12-a(5g,317.76g/mol,15.89mmol)、化合物12-b(1.1eq,3.9g,223.03/mol,17.47mmol)和碳酸钠(2eq,3.37g,105.99g/mol,31.77mmol)加入到乙二醇二胺醚(100g,化合物12-a的20倍质量)和水(100g,化合物12-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.24g,304.37g/mol,0.79mmol)和乙酸钯(ii)(1%eq,0.04g,224.51g/mol,0.16mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物12-c(5.51g,收率83.4%),ms(ei):416(m+)。
[0130]
s2:
[0131][0132]
将化合物12-c(5g,416.07g/mol,12.08mmol)、化合物12-d(1.1eq,4.63g,348.20g/mol,13.29mmol)和碳酸钠(2eq,2.56g,105.99g/mol,24.16mmol)加入到乙二醇二胺醚(100g,化合物12-c的20倍质量)和水(100g,化合物12-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.6mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物12-e(4.99g,收率64.8%),ms(ei):639(m+)。
[0133]
s3:
[0134][0135]
将化合物12-e(4g,639.54g/mol,6.27mmol)、化合物12-f(1.1eq,2.06g,298.14g/mol,6.9mmol)和碳酸钠(2eq,1.33g,105.99g/mol,12.54mmol)加入到乙二醇二胺醚(80g,化合物12-e的20倍质量)和水(80g,化合物12-e的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.10g,304.37g/mol,0.31mmol)和乙酸钯(ii)(1%eq,0.01g,224.51g/mol,0.06mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(69)(3.25g,收率63.8%),ms(ei):812(m+)。
[0136]
实施例13:
[0137][0138]
有机化合物(81)的合成方法如下:
[0139]
s1:
[0140][0141]
将化合物13-a(5g,317.76g/mol,15.89mmol)、化合物13-b(1.1eq,2.57g,146.94g/mol,17.47mmol)和碳酸钠(2eq,3.37g,105.99g/mol,31.77mmol)加入到乙二醇二胺醚(100g,化合物13-a的20倍质量)和水(100g,化合物13-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.24g,304.37g/mol,0.79mmol)和乙酸钯(ii)(1%eq,0.04g,224.51g/mol,0.16mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物13-c(4.58g,收率84.8%),ms(ei):339(m+)。
[0142]
s2:
[0143][0144]
将化合物13-c(4g,339.97g/mol, 11.84mmol)、化合物13-d(1.1eq,3.54g,272.11g/mol,13.02mmol)和碳酸钠(2eq,2.51g,105.99g/mol,23.68mmol)加入到乙二醇二胺醚(80g,化合物13-c的20倍质量)和水(80g,化合物13-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.59mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物13-e(4.06g,收率70.3%),ms(ei):487(m+)。
[0145]
s3:
[0146][0147]
将化合物13-e(4g,487.35g/mol,8.23mmol)、化合物13-f(1.1eq,1.1g,121.93g/mol,9.06mmol)和碳酸钠(2eq,1.74g,105.99g/mol,16.46mmol)加入到乙二醇二胺醚(80g,化合物13-e的20倍质量)和水(80g,化合物13-e的20倍质量)中,搅拌混匀后再依次加入三
(邻甲苯基)膦(5%eq,0.13g,304.37g/mol,0.41mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.08mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(81)(3.56g,收率89.4%),ms(ei):484(m+)。
[0148]
实施例14:
[0149][0150]
有机化合物(93)的合成方法如下:
[0151][0152]
将化合物14-a(4g,487.35g/mol,8.23mmol)、化合物14-a(1.1eq,2.84g,314.19g/mol,9.06mmol)和碳酸钠(2eq,1.74g,105.99g/mol,16.46mmol)加入到乙二醇二胺醚(80g,化合物14-a的20倍质量)和水(80g,化合物14-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.13g,304.37g/mol,0.41mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.08mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(93)(4.26g,收率76.5%),ms(ei):676(m+)。
[0153]
实施例15:
[0154][0155]
有机化合物(97)的合成方法如下:
[0156][0157]
将化合物15-a(4g,487.35g/mol, 8.23mmol)、化合物15-b(1.1eq,2.84g,287.12g/mol,9.06mmol)和碳酸钠(2eq,1.74g,105.99g/mol,16.46mmol)加入到乙二醇二胺醚(80g,化合物15-a的20倍质量)和水(80g,化合物15-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.13g,304.37g/mol,0.41mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.08mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,
得到粗品,粗品再经过柱层析后得到有机化合物(97)(4.26g,收率76.5%),ms(ei):649(m+)。
[0158]
实施例16:
[0159][0160]
有机化合物(101)的合成方法如下:
[0161]
s1:
[0162][0163]
将化合物16-a(5g,317.76g/mol,15.94mmol)、化合物16-b(1.1eq,2.58g,146.94g/mol,17.53mmol)和碳酸钠(2eq,3.38g,105.99g/mol,31.87mmol)加入到乙二醇二胺醚(100g,化合物16-a的20倍质量)和水(100g,化合物16-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.24g,304.37g/mol,0.8mmol)和乙酸钯(ii)(1%eq,0.04g,224.51g/mol,0.16mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物16-c(4.70g,收率86.7%),ms(ei):339(m+)。
[0164]
s2:
[0165][0166]
将化合物16-c(4g,339.97g/mol,11.87mmol)、化合物16-d(1.1eq,4.55g,348.20g/mol,13.06mmol)和碳酸钠(2eq,2.51g,105.99g/mol,23.68mmol)加入到乙二醇二胺醚(80g,化合物16-c的20倍质量)和水(80g,化合物16-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.59mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物16-e(4.36g,收率65.2%),ms(ei):563(m+)。
[0167]
s3:
[0168]
[0169]
将化合物16-e(4g,563.45g/mol,7.13mmol)、化合物16-f(1.1eq,0.96g,121.93g/mol,7.84mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.26mmol)加入到乙二醇二胺醚(80g,化合物16-e的20倍质量)和水(80g,化合物16-e的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(101)(3.07g,收率77.1%),ms(ei):560(m+)。
[0170]
实施例17:
[0171][0172]
有机化合物(190)的合成方法如下:
[0173]
s1:
[0174][0175]
将化合物17-a(4g,338.99g/mol,11.87mmol)、化合物17-b(1.1eq,3.55g,272.11g/mol,13.06mmol)和碳酸钠(2eq,2.51g,105.99g/mol,23.68mmol)加入到乙二醇二胺醚(80g,化合物17-a的20倍质量)和水(80g,化合物17-a的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.18g,304.37g/mol,0.59mmol)和乙酸钯(ii)(1%eq,0.03g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到化合物17-c(4.31g,收率74.9%),ms(ei):486(m+)。
[0176]
s2:
[0177][0178]
将化合物17-c(4g,486.36g/mol,7.13mmol)、化合物17-d(1.1eq,0.96g,348.20g/mol,7.84mmol)和碳酸钠(2eq,1.51g,105.99g/mol,14.26mmol)加入到乙二醇二胺醚(80g,化合物17-c的20倍质量)和水(80g,化合物17-c的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(5%eq,0.11g,304.37g/mol,0.36mmol)和乙酸钯(ii)(1%eq,0.02g,224.51g/mol,0.07mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,得到粗品,粗品再经过柱层析后得到有机化合物(190)(3.22g,收率63.6%),ms(ei):709(m+)。
[0179]
材料性质测试:
[0180]
测试etl-1及本发明有机化合物1、6、7、8、10、12、13、19、21、41、54、69、81、93、97、101、190的热失重温度td,测试结果如下表1所示。
[0181]
注:热失重温度td是在氮气气氛中失重5%的温度,在北光宏远的wrt-11系列热重分析仪上进行测定,测试时氮气流量为10ml/min。
[0182][0183]
表1:
[0184]
[0185][0186]
由上述数据可知,本发明有机化合物的热稳定性优于对照例etl-1,说明符合本发明结构通式的有机化合物具有良好的热稳定性,良好的热稳定性更有利于作为有机电致发光材料使用,能够提高使用该类材料制备的有机电致发光器件的寿命和发光效率。
[0187]
性能测试:
[0188]
应用例1:
[0189]
采用ito作为反射层阳极基板材料,并依次用水、丙酮、n2等离子对其进行表面处理;
[0190]
在ito阳极基板上方,沉积厚度为10nm的hat-cn形成空穴注入层(hil);
[0191]
在空穴注入层(hil)上方蒸镀npd形成厚度为120nm的空穴传输层(htl);
[0192]
将9,10-bis(2-naphthyl)anthraces(adn)作为蓝光主体材料、bd-1作为蓝光掺杂材料(bd-1用量为adn重量的5%)以不同速率蒸发在空穴传输层(htl)上形成厚度为20nm的发光层;
[0193]
将本发明有机化合物(1)蒸镀到发光层上得到厚度为35nm的电子传输层(etl),在电子传输层(etl)上方蒸镀厚度为2nm的liq形成电子注入层(eil);
[0194]
此后将镁(mg)和银(ag)以9:1的比例混合蒸镀得到厚度为15nm的阴极,在上述阴极封口层上沉积65纳米厚度的dntpd,此外,在阴极表面以uv硬化胶合剂和含有除湿剂的封装薄膜(seal cap)进行密封,以保护有机电致发光器件不被大气中的氧气或水分所影响至
此制备获得有机电致发光器件。
[0195][0196]
应用例2-17
[0197]
分别以本发明实施例2-17中制备的有机化合物6、7、8、10、12、13、19、21、41、54、69、81、93、97、101、190作为电子传输层(etl),其他部分与应用例1一致,据此制作出应用例2-17的有机电致发光器件。
[0198]
对照例
[0199]
与应用例1的区别在于,使用etl-1作为电子传输层(etl),其余与应用例1相同。
[0200]
上述应用例制造的有机电致发光器件及对照例制造的有机电致发光器件的特性是在电流密度为10ma/cm2的条件下测定的,结果如表2所示。
[0201]
表2:
[0202]
[0203][0204]
由如上表2的实验对比数据可知,采用本发明中有机化合物作为电子传输层(etl)制备的有机电致发光器件与对照例相比,驱动电压有所降低,发光效率和使用寿命显著提高。由此可见,本发明有机化合物作为电子传输层(etl)能使器件的驱动电压大大降低,大幅度减少了电能的消耗、显著提高了发光效率,另外通过降低驱动电压,有机电致发光器件的寿命有显著提高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1