一种三嗪类组合物及其制备方法和应用与流程
1.本发明属于有机电致发光材料技术领域,具体涉及一种三嗪类组合物及其制备方法和应用。
背景技术:
2.随着科学技术和信息技术的快速发展,人们对信息显示系统的性能也提出了新的目标和要求,显示器具有高亮度、高分辨率、宽视角、低能耗成为研究热点。有机电致发光(oled)显示技术能够满足人们的上述需求,同时具有较宽的工作温度、可实现柔性显示等其他优点,因此继crt(阴极射线管)显示器、lcd(液晶显示)、pdp(等离子显示)平板显示器后成为了新一代平板显示的新宠儿。当前,有机电致发光(oled)显示技术已经在智能手机,平板电脑等领域获得应用,并向电视等大尺寸应用领域扩展。
3.在近30年的发展过程中,对有机电致发光器件结构的不同设计、对有机电致发光器件寿命、效率等性能的优化以及各种性能优良的oled材料及其制备方法引起了人们的广泛关注和研究。因此,如何提供一种方法简便、目标产物纯度较高的oled材料的制备方法,成为目前亟待解决的技术问题。
技术实现要素:
4.针对现有技术的不足,本发明的目的在于提供一种三嗪类组合物及其制备方法和应用。本发明中通过对三嗪类组合物的制备方法进行设计得到的三嗪类组合物,此三嗪类组合物比较容易提纯得到较高的纯度的三嗪类化合物,并且产率较高。
5.为达此目的,本发明采用以下技术方案:
6.第一方面,本发明提供一种三嗪类化合物的制备方法,所述制备方法包括如下步骤:
7.(1)式m0所示化合物发生碘代反应,得到式m所示中间体化合物;
8.(2)式m所示中间体化合物与硼酸类化合物或二芳胺类化合物反应,得到三嗪类组合物;
9.其中,式m0所示化合物为式m所示中间体为
10.ar1和ar2各自独立地选自取代或未取代的c6-c40芳基、取代或未取代的c3-c20杂芳基中的任意一种;
11.ar3选自单键、取代或未取代的c6-c40亚芳基、取代或未取代的c3-c20亚杂芳基中的任意一种;
12.m选自0或1;
13.所述硼酸类化合物选自ar
11
取代或未取代的c6-c40芳基、取代或未取代的c3-c20杂芳基;
14.所述二芳胺化合物为ar
21
和ar
22
各自独立地选自取代或未取代的c6-c40芳基、取代或未取代的c3-c20杂芳基,ar
21
和ar
22
可以通过单键连接成环;
15.ar1、ar2、ar3、ar
11
、ar
21
和ar
22
中所述取代的取代基选自-d(氘原子,下同)、-f、-cn、c1~c12烷基、c1~c6烷氧基、c2~c8烯基、c6~c15芳基、c12~c20杂芳基中至少一种。
16.本发明中,通过对三嗪类组合物的制备方法进行设计得到的三嗪类组合物,此三嗪类组合物比较容易经过升华得到较高的纯度的三嗪类化合物,并且产率较高。本发明提供的三嗪类组合物和较高的纯度的三嗪类化合物均可作为有机薄膜层的制备原料,用以制备有机薄膜层,进而制备得到性能优异的有机电致发光器件,尤其是,本发明提供的三嗪类组合物不经升华提纯,制备得到的有机电致发光器件具有较好的性能。
17.需要说明的是,由于有机反应过程中,总是伴随着副反应的发生,因此,最终制备得到的产物为混合物。本发明中,以式m0所示化合物通过碘代反应,得到中间体,然后将中间体与硼酸类化合物或二芳胺类化合物反应,经过分液、洗涤、柱层析等后处理后,得到的产物是三嗪类化合物的混合物,三嗪类化合物的混合物中含有三嗪类化合物和三嗪类化合物的碘代物,即本发明中的三嗪类组合物,此三嗪类组合物比较容易经过升华得到较高的纯度的三嗪类化合物。
18.本发明中,所述制备方法包括如下步骤:
19.(1)式m0所示化合物发生碘代反应,得到式m所示中间体化合物:
[0020][0021]
(2)式m所示中间体化合物与硼酸类化合物反应,得到三嗪类组合物;
[0022][0023]
或者式m所示中间体化合物与二芳胺类化合物反应,得到三嗪类组合物:
[0024][0025]
需要说明的是,式m所示中间体化合物与硼酸类化合物反应,制备三嗪类组合物的过程中,可选用不同的硼酸类化合物,从而使三嗪类组合物主产物中的三嗪类化合物具有不同的芳香基,当m=1,反应式如下所述:
[0026][0027]
其中,ar
11
、ar
12
各自独立地选自取代或未取代的c6-c40芳基、取代或未取代的c3-c20杂芳基。
[0028]
现有技术中,通常采用含卤素原子x(x选自f、cl、br,下同)的中间体,即将本技术式m所示中间体种的i换成f、cl、br,与二芳胺类化合物进行c-n偶联反应或者和芳基硼酸进行c-c偶联反应制备得到三嗪类化合物,但是在制备目标产物三嗪类化合物的过程中,会产生微量游离的x正离子或者自由基,或者连接在上述中间体上的x会通过迁移,转移到目标产物上、或者转移到中间体上,导致目标产物中存在被x取代的结构、或者中间体被x取代的结构,尤其是目标产物中存在被x取代的结构时,因为此杂质和目标产物分子量较为接近,结构类似,提纯时较为复杂,影响目标产物的纯度,且微量的含有x取代的产物杂质,会对器件寿命产生大的影响。
[0029]
本发明中,步骤(2)中是通过含有ar
11
和ar
12
的二芳胺类化合物或含有ar
11
和ar
12
的芳基硼酸化合物与式m所示中间体化合物中间体发生取代反应或者偶联反应,得到式i所示三嗪类化合物的。
[0030]
本发明通过采用含碘原子的中间体与二芳胺类化合物进行c-n偶联反应或者和芳基硼酸进行c-c偶联反应制备得到目标产物,尽管也会产生目标产物被i取代的副产物、或者中间体被i取代的副产物,但是由于i的活性小于f、cl、br,因此,此类副产物的含量较少;且由于c-i健较弱,因此在产品的升华过程中,碘代物会分解,使得产品中不再含有i代物,目标产物的后处理过程简单,适用于制备oled器件的有机薄膜层。同时含有副产物的目标产物粗品也可直接用于制备oled器件的有机薄膜层,且制备得到的oled器件性能优异。
[0031]
本发明中,所述c6-c40可以为c6、c8、c10、c12、c15、c16、c18、c20、c22、c24、c30、c36或c40等。
[0032]
所述c3~c20可以为c3、c6、c8、c12、c15、c16、c18或c20等。
[0033]
所述c1~c12可以为c1、c2、c3、c4、c5、c6、c7、c8、c9、c10、c11或c12。
[0034]
所述c1~c6可以为c1、c2、c3、c4、c5或c6。
[0035]
所述c2~c8可以为c2、c3、c4、c5、c6、c7或c8。
[0036]
所述c6~c15可以为c6、c7、c8、c10、c12或c15等。
[0037]
所述c12~c20可以为c12、c14、c16、c18或c20等。
[0038]
本发明中,当m为1,三嗪类组合物由式m所示中间体化合物与二芳胺类化合物反应得到,其制备方法如下(下述反应式中仅写明了主产物,下同):
[0039][0040]
当m为0,三嗪类组合物由式m所示中间体化合物与二芳胺类化合物反应得到,其制备方法如下:
[0041][0042]
当m为1,三嗪类组合物由式m所示中间体化合物与硼酸类化合物反应得到,其制备方法如下:
[0043][0044]
当m为0,三嗪类组合物由式m所示中间体化合物与硼酸类化合物反应得到,其制备方法如下:
[0045][0046]
以下作为本发明的优选技术方案,但不作为对本发明提供的技术方案的限制,通过以下优选的技术方案,可以更好的达到和实现本发明的目的和有益效果。
[0047]
作为本发明的优选技术方案,所述ar1、ar2、ar
11
、ar
21
和ar
22
各自独立地选自苯基、联苯基、三联苯基、萘基、蒽基、菲基、吡啶基、芴基、二苯并呋喃、二苯并噻吩中的任意一种。
[0048]
优选地,所述ar3选自单键、亚苯基、亚联苯基、亚三联苯基、亚萘基、亚蒽基、亚菲基、亚芴基、二亚苯并呋喃、亚二苯并噻吩中的任意一种。
[0049]
作为本发明的优选技术方案,步骤(1)所述碘代反应的温度为25~150℃(例如可以是25℃、30℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃或、100℃、110℃、120℃、13℃0、140℃或150℃等),优选为35~120℃。
[0050]
优选地,步骤(1)所述碘代反应的时间为2~24h,例如可以是2h、4h、6h、8h、10h、12h、14h、16h、18h、20h、22h或24h等。
[0051]
需要说明的是,本发明中对于碘代反应中使用的反应物不做任何特殊的限定,只需要其可与式m0所示化合物反应生成式m所示中间体即可,示例性地包括但不限于:n-碘代丁二酰亚胺、单质碘、氢碘酸和氧化剂的组合物。
[0052]
优选地,所述碘代反应在有机溶剂存在下进行;
[0053]
优选地,所述有机溶剂选自dmf(二甲基甲酰胺)、二氯甲烷、三氯甲烷、四氯甲烷、二氯乙烷、氯苯、醋酸、乙酸乙酯、dmso(二甲基亚砜)、hmpa(六甲基磷酰三胺)中的任意一种或至少两种的组合。
[0054]
优选地,步骤(1)所述碘代反应完成后还包括后处理的步骤。
[0055]
优选地,所述后处理的方法包括分液、洗涤、干燥、浓缩、层析。
[0056]
需要说明的是,可通过控制式m0所示化合物与含碘反应物(例如可以是n-碘代丁二酰亚胺、单质碘、氢碘酸和氧化剂的组合物等)之间的用量关系,反应得到单碘代(m为0)或双碘代(m为1)的式m所示中间体化合物。
[0057]
本发明中,步骤(2)所述反应的温度为40~120℃,例如可以是40℃、50℃、60℃、70℃、80℃、90℃、100℃、110℃或120℃等。
[0058]
优选地,步骤(2)所述反应的时间为8~18h,例如可以是8h、9h、10h、11h、12h、13h、14h、15h、16h、17h或18h等。
[0059]
优选地,所述反应在有机溶剂和催化剂存在下进行。
[0060]
本发明中,对于步骤(2)所述反应的有机溶剂和催化剂不做任何特殊限制,本领域常用的有机溶剂和催化剂均适用。
[0061]
第二方面,本发明提供一种三嗪类组合物,所述三嗪类组合物由如第一方面所述的制备方法制备得到。
[0062]
第三方面,本发明提供三嗪类化合物,其特征在于,所述三嗪类化合物由如第二方面所述的三嗪类组合物纯化后得到。
[0063]
优选地,所述三嗪类化合物选自如下化合物1-12中的任意一种:
[0064][0065]
第四方面,本发明提供一种有机电致发光器件,所述有机电致发光器件包括阳极、阴极以及设置于所述阳极和阴极之间的有机薄膜层;
[0066]
所述有机薄膜层包括发光层和电子传输层;
[0067]
所述有机薄膜层的制备原料,采用包括如第二方面所述的三嗪类组合物或如第三方面所述的三嗪类化合物。
[0068]
作为本发明的优选技术方案,所述发光层包括红光发光层,所述红光发光层的主体材料采用包括如第二方面所述的三嗪类组合物或如第三方面所述的三嗪类化合物制备得到。
[0069]
第五方面,本发明提供一种显示装置,所述显示装置包括如第四方面所述的有机电致发光器件。
[0070]
第六方面,本发明提供一种用于制备如第一方面所述的三嗪类组合物的中间体,所述中间体具有如式m所示结构:
[0071][0072]
其中,ar1和ar2各自独立地选自取代或未取代的c6-c40芳基、取代或未取代的c3-c20杂芳基中的任意一种;
[0073]
ar3各自独立地选自单键、取代或未取代的c6-c40亚芳基、取代或未取代的c3-c20亚杂芳基中的任意一种;
[0074]
m选自0或1。
[0075]
作为本发明的优选技术方案,所述ar1、ar2各自独立地选自苯基、联苯基、三联苯基、萘基、蒽基、菲基、芴基、二苯并呋喃、二苯并噻吩中的任意一种;
[0076]
ar3选自单键、亚苯基、亚联苯基、亚三联苯基、亚萘基、亚蒽基、亚菲基、亚芴基、二亚苯并呋喃、亚二苯并噻吩中的任意一种。
[0077]
优选地,式m所示中间体选自如下化合物中的任意一种:
[0078][0079]
与现有技术相比,本发明具有以下有益效果:
[0080]
本发明中通过对三嗪类组合物的制备方法进行设计,进一步通过碘代反应得到含有碘原子的中间体,进而通过该中间体制备得到易提纯、且产率较高的三嗪类组合物。本发明提供的三嗪类组合物和三嗪类化合物均适用于制备有机电致发光器件的有机薄膜层材料,且制备得到的有机电致发光器件寿命较长。
具体实施方式
[0081]
为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0082]
合成实施例1
[0083]
本合成实施例提供一种包含化合物1的三嗪类组合物及其制备方法,所述制备方法如下:
[0084]
(1)中间体m1的合成
[0085][0086]
在500ml三口瓶中,加入200ml dmf,再加入m0所示化合物(4.74g),搅拌下升温至35℃,分批加入n-碘代丁二酰亚胺固体(2.3g),加毕后于35-40℃反应1h,再升温至45-50℃反应2h,再升温至65-70℃反应1h,降温至室温,加水和氯仿进行分液后,对有机层水洗后,用硫酸镁干燥,滤去硫酸镁后,浓缩至干,硅胶柱层析分离,使用石油醚:二氯甲烷=20:1(体积比)洗脱后,得到中间体m1(5.19g)。
[0087]
对得到的中间体m1进行质谱检测:测得质荷比(m/z)为600.08。
[0088]
对得到的中间体m1进行核磁检测:1h-nmr(瑞士bruker公司,avanceⅱ400mhz核磁共振波谱仪,cdcl3),δ8.57(m,1h),δ8.37(m,4h),δ8.18(d,1h),δ7.98~7.88(m,4h),δ7.69(m,1h),δ7.54~7.47(m,7h),δ7.20~7.10(m,3h)。
[0089]
(2)包含化合物1的三嗪类组合物的合成
[0090][0091]
在氮气保护下,向500ml三口瓶中,加入300ml干燥的甲苯、中间体m1(6.0g)、二苯胺(1.7g)、pd(dba)2(双二亚苄基丙酮钯,0.0575g,0.0001mol)、质量百分含量为10%的三叔丁基膦的甲苯溶液(三叔丁基膦的甲苯溶液的质量为0.4g,三叔丁基膦的物质的量为0.0002mol)和叔丁醇钠(1.44g,0.015mol),先加热至40℃反应2小时,再加热至60℃反应8小时,降温至室温后加水分液,然后将有机层水洗至中性,用硫酸镁干燥,过滤除去硫酸镁后,浓缩至干,用硅胶柱层析分离,用石油醚:二氯甲烷=10:1(体积比)洗脱,得到包含化合物1的三嗪类组合物(5.9g)。
[0092]
对包含化合物1的三嗪类组合物(包括化合物1和化合物1的单碘代物)进行hplc-ms检测,然后升华一次(提纯),升华前和升华后检测结果如下表1所示:
[0093]
表1
[0094]
成分升华前hplc含量m/z升华后hplc含量化合物199.22%641.2699.96%化合物1的单碘代物0.23%767.150%
[0095]
合成实施例2
[0096]
本合成实施例提供包含化合物2的三嗪类组合物及其制备方法,所述制备方法如
下:
[0097]
(1)中间体m2的合成
[0098][0099]
在500ml三口瓶中,加入250ml dmf,再加入m0所示化合物(4.74g),搅拌下升温至35℃,分批加入n-碘代丁二酰亚胺固体(4.6g),加毕于35-40℃反应1h,再升温至45-50℃反应2h,再升温至80-85℃反应4h,降温至室温,加水和氯仿进行分液后,对有机层水洗后,用硫酸镁干燥,滤去硫酸镁后,浓缩至干,硅胶柱层析分离,使用石油醚:二氯甲烷=20:1(体积比)洗脱后,得到中间体m2(5.8g)。
[0100]
对得到的中间体m2进行质谱检测:测得质荷比(m/z)为725.98。
[0101]
(2)包含化合物2的三嗪类组合物的合成
[0102][0103]
在氮气保护下,向500ml三口瓶中,加入400ml干燥的甲苯、中间体m2(7.26g)、二苯胺(3.4g)、pd(dba)2(双二亚苄基丙酮钯,0.0575g,0.0001mol)、质量百分含量为10%的三叔丁基膦的甲苯溶液(三叔丁基膦的甲苯溶液的质量为0.4g,三叔丁基膦的物质的量为0.0002mol)和叔丁醇钠(1.44g,0.015mol),先加热至40℃反应2小时,再加热至60℃反应16小时,降温至室温后加水分液,然后将有机层水洗至中性,用硫酸镁干燥,过滤除去硫酸镁后,浓缩至干,用硅胶柱层析分离,用石油醚:二氯甲烷=10:1(体积比)洗脱,得到包含化合物2的三嗪类组合物(7.1g)。
[0104]
对包含化合物2的三嗪类组合物(包括化合物2和化合物2的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表2所示:
[0105]
表2
[0106]
成分升华前hplc含量m/z升华后hplc含量化合物299.31%808.3399.97%化合物2的单碘代物0.29%934.230%
[0107]
合成实施例3
[0108]
本合成实施例提供包含化合物3的三嗪类组合物及其制备方法,所述制备方法如
下:
[0109]
(1)中间体m1的合成
[0110]
采用合成实施例1中中间体m1的合成方法进行制备。
[0111]
(2)包含化合物3的三嗪类组合物的合成
[0112][0113]
参照合成实施例1中三嗪类组合物的合成方法,区别仅在于,将二苯胺替换为等物质的量的换成3-苯基咔唑,得到包含化合物3的三嗪类组合物。
[0114]
对包含化合物3的三嗪类组合物(包括化合物3和化合物3的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表3所示:
[0115]
表3
[0116]
成分升华前hplc含量m/z升华后hplc含量化合物399.21%715.2799.97%化合物3的单碘代物0.11%841.170%
[0117]
合成实施例4
[0118]
本合成实施例提供包含化合物4的三嗪类组合物及其制备方法,所述制备方法如下:
[0119]
(1)中间体m2的合成
[0120]
采用合成实施例2中中间体m2的合成方法进行制备。
[0121]
(2)包含化合物4的三嗪类组合物的合成
[0122][0123]
参照合成实施例2中三嗪类组合物的合成方法,区别仅在于,将二苯胺替换为等物质的量的换成咔唑,得到包含化合物4的三嗪类组合物。
[0124]
对包含化合物4的三嗪类组合物(包括化合物4和化合物4的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表4所示:
[0125]
表4
[0126]
成分升华前hplc含量m/z升华后hplc含量化合物499.32%804.3099.99%化合物4的单碘代物0.16%930.200%
[0127]
合成实施例5
[0128]
本合成实施例提供包含化合物5的三嗪类组合物及其制备方法,所述制备方法如下:
[0129][0130]
参照合成实施例1中三嗪类组合物的合成方法,区别仅在于,将中间体m1替换为等物质的量的换成中间体m4,得到包含化合物5的三嗪类组合物。
[0131]
对包含化合物5的三嗪类组合物(包括化合物5和化合物5的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表5所示:
[0132]
表5
[0133]
成分升华前hplc含量m/z升华后hplc含量化合物599.75%563.2199.98%化合物5的单碘代物0.06%689.110%
[0134]
合成实施例6
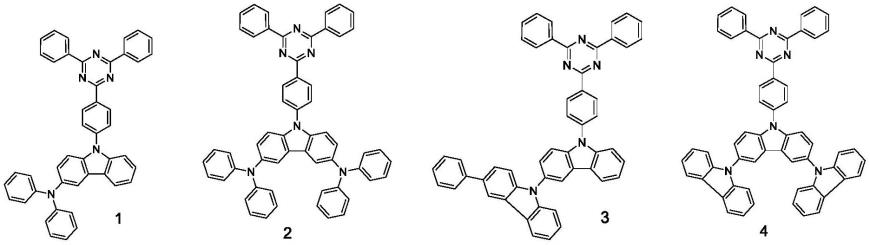
[0135]
本合成实施例提供包含化合物6的三嗪类组合物及其制备方法,所述制备方法如下:
[0136]
(1)中间体m3的合成
[0137][0138]
在500ml三口瓶中,加入220ml dmf,再加入m01所示化合物(3.98g),搅拌下升温至55℃,分批加入n-碘代丁二酰亚胺固体(4.6g),加毕于35-40℃反应1h,再升温至50-55℃反应2h,再升温至95-100℃反应4h,降温至室温,加水和氯仿进行分液后,对有机层水洗后,用硫酸镁干燥,滤去硫酸镁后,浓缩至干,硅胶柱层析分离,使用石油醚:二氯甲烷=20:1(体积比)洗脱后,得到中间体m3(4.1g)。
[0139]
对得到的中间体m3进行质谱检测:测得质荷比(m/z)为649.95。
[0140]
对得到的中间体m3进行核磁检测:1h-nmr(瑞士bruker公司,avanceⅱ400mhz核磁共振波谱仪,cdcl3),δ8.39~8.33(m,6h),δ7.69(m,2h),δ7.53~7.47(m,6h),δ7.31(d,
1h),δ7.19(d,1h)。
[0141]
(2)包含化合物6的三嗪类组合物的合成
[0142][0143]
参照合成实施例1中三嗪类组合物的合成方法,区别仅在于,将中间体m1替换为等物质的量的中间体m3,将二苯胺替换为二倍物质的量的咔唑,得到包含化合物6的三嗪类组合物。
[0144]
对包含化合物6的三嗪类组合物(包括化合物6和化合物6的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表6所示:
[0145]
表6
[0146]
成分升华前hplc含量m/z升华后hplc含量化合物699.58%728.2799.97%化合物6的单碘代物0.13%854.170%
[0147]
合成实施例7
[0148]
本合成实施例提供包含化合物7的三嗪类组合物及其制备方法,所述制备方法如下:
[0149]
(1)中间体m1的合成
[0150]
采用合成实施例1中中间体m1的合成方法进行制备。
[0151]
(2)包含化合物7的三嗪类组合物的合成
[0152][0153]
在氮气保护条件下,向500ml的三口瓶中加入100ml甲苯、30ml乙醇和20ml水,再加入中间体m1(6g)、苯硼酸(1.22g)、碳酸钠(2.12g,0.02mol)和四三苯基膦钯(0.115g,0.0001mol),缓慢升温至50℃反应2h,再升温至70℃反应6h,降温至室温,加水分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,硅胶柱层析分离,石油醚:二氯甲烷=10:1(体积比)洗脱,得到包含化合物7的三嗪类组合物(4.9g)。
[0154]
对包含化合物7的三嗪类组合物(包括化合物7和化合物7的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表7所示:
[0155]
表7
[0156]
成分升华前hplc含量m/z升华后hplc含量化合物799.56%550.2299.99%化合物7的单碘代物0.11%676.110%
[0157]
合成实施例8
[0158]
本合成实施例提供包含化合物8的三嗪类组合物及其制备方法,所述制备方法如下:
[0159]
(1)中间体m1的合成
[0160]
采用合成实施例1中中间体m1的合成方法进行制备。
[0161]
(2)包含化合物8的三嗪类组合物的合成
[0162][0163]
参照合成实施例7中三嗪类组合物的合成方法,区别仅在于,将苯硼酸替换为等物质的量的2-萘硼酸,得到包含化合物8的三嗪类组合物。
[0164]
对包含化合物8的三嗪类组合物(包括化合物8和化合物8的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表8所示:
[0165]
表8
[0166]
成分升华前hplc含量m/z升华后hplc含量化合物899.58%600.2399.98%化合物8的单碘代物0.13%726.130%
[0167]
合成实施例9
[0168]
本合成实施例提供包含化合物9的三嗪类组合物及其制备方法,所述制备方法如下:
[0169]
(1)中间体m1的合成
[0170]
采用合成实施例1中中间体m1的合成方法进行制备。
[0171]
(2)包含化合物9的三嗪类组合物的合成
[0172][0173]
参照合成实施例7中三嗪类组合物的合成方法,区别仅在于,将苯硼酸替换为等物
质的量的3-吡啶硼酸,得到包含化合物9的三嗪类组合物。
[0174]
对包含化合物9的三嗪类组合物(包括化合物9和化合物9的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表9所示:
[0175]
表9
[0176]
成分升华前hplc含量m/z升华后hplc含量化合物999.48%551.2199.96%化合物9的单碘代物0.06%677.110%
[0177]
合成实施例10
[0178]
本合成实施例提供包含化合物10的三嗪类组合物及其制备方法,所述制备方法如下:
[0179]
(1)中间体m1的合成
[0180]
采用合成实施例1中中间体m1的合成方法进行制备。
[0181]
(2)包含化合物10的三嗪类组合物的合成
[0182][0183]
参照合成实施例7中三嗪类组合物的合成方法,区别仅在于,将苯硼酸替换为等物质的量的9,9-二甲基芴-2-硼酸,得到包含化合物10的三嗪类组合物。
[0184]
对包含化合物10的三嗪类组合物(包括化合物10和化合物10的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表10所示:
[0185]
表10
[0186]
成分升华前hplc含量m/z升华后hplc含量化合物1099.62%666.2899.99%化合物10的单碘代物0.15%792.170%
[0187]
合成实施例11
[0188]
本合成实施例提供包含化合物11的三嗪类组合物及其制备方法,所述制备方法如下:
[0189]
(1)中间体m1的合成
[0190]
采用合成实施例1中中间体m1的合成方法进行制备。
[0191]
(2)包含化合物11的三嗪类组合物的合成
[0192][0193]
参照合成实施例7中三嗪类组合物的合成方法,区别仅在于,将苯硼酸替换为等物质的量的二苯并[b,d]呋喃-3-硼酸,得到包含化合物11的三嗪类组合物。
[0194]
对包含化合物11的三嗪类组合物(包括化合物11和化合物11的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表11所示:
[0195]
表11
[0196]
成分升华前hplc含量m/z升华后hplc含量化合物1199.66%640.2399.98%化合物11的单碘代物0.18%766.120%
[0197]
合成实施例12
[0198]
本合成实施例提供包含化合物12的三嗪类组合物及其制备方法,所述制备方法如下:
[0199]
(1)中间体m1的合成
[0200]
采用合成实施例1中中间体m1的合成方法进行制备。
[0201]
(2)包含化合物12的三嗪类组合物的合成
[0202][0203]
参照合成实施例1中三嗪类组合物的合成方法,区别仅在于,将二苯胺替换为等物质的量的咔唑,得到包含化合物12的三嗪类组合物。
[0204]
对包含化合物12的三嗪类组合物(包括化合物12和化合物12的单碘代物)进行hplc-ms检测,然后升华一次,升华前和升华后检测结果如下表12所示:
[0205]
表12
[0206][0207]
[0208]
对比合成实施例1
[0209]
本对比合成实施例提供一种化合物d-1-br及其合成方法,合成方法如下:
[0210][0211]
在氮气保护下,向500ml三口瓶中,加入220ml干燥的甲苯、中间体m-br(5.5g)、二苯胺(1.7g)、pd(dba)2(双二亚苄基丙酮钯,0.0575g,0.0001mol)、质量百分含量为10%的三叔丁基膦的甲苯溶液(三叔丁基膦的甲苯溶液的质量为0.4g,三叔丁基膦的物质的量为0.0002mol)和叔丁醇钠(1.44g,0.015mol),加热至回流反应8小时,降温至室温后加水分液,然后将有机层水洗至中性,用硫酸镁干燥,过滤除去硫酸镁后,浓缩至干,用硅胶柱层析分离,用石油醚:二氯甲烷=10:1(体积比)洗脱,得到化合物d-1-br的粗品(5.8g)。
[0212]
对化合物d-1-br的粗品进行hplc-ms检测,然后升华二次,升华前和升华后检测结果如下表13所示:
[0213]
表13
[0214][0215]
对比合成实施例2
[0216]
本对比合成实施例提供一种化合物d-1-f及其合成方法,合成方法如下:
[0217][0218]
在氮气保护下,向500ml三口瓶中,加入200ml干燥的dmf、中间体m-f(3.3g)、n,n-二苯基-9h-咔唑-3-胺(3.3g)、pd(dba)2(双二亚苄基丙酮钯,0.0575g,0.0001mol)、质量百分含量为10%的三叔丁基膦的甲苯溶液(三叔丁基膦的甲苯溶液的质量为0.4g,三叔丁基膦的物质的量为0.0002mol)和叔丁醇钠(1.44g,0.015mol),加热至回流反应48小时,降温至室温后加水和二氯甲烷分液,然后将有机层水洗至中性,用硫酸镁干燥,过滤除去硫酸镁
后,浓缩至干,用硅胶柱层析分离,用石油醚:二氯甲烷=10:1(体积比)洗脱,得到化合物d-1-f的粗品(3.9g)。
[0219]
对化合物d-1-f的粗品进行hplc-ms检测,然后升华二次,升华前和升华后检测结果如下表14所示:
[0220]
表14
[0221][0222]
对比合成实施例3
[0223]
本对比合成实施例提供一种化合物d-3-br及其合成方法,合成方法如下:
[0224][0225]
参照化合物d-1-br的合成方法,区别仅在于,将二苯胺替换为等物质的量的3-苯基咔唑,得到化合物d-3-br的粗品。
[0226]
对化合物d-3-br的粗品进行hplc-ms检测,然后升华二次,升华前和升华后检测结果如下表15所示:
[0227]
表15
[0228][0229]
对比合成实施例4
[0230]
本对比合成实施例提供一种化合物d-8-br及其合成方法,合成方法如下:
[0231][0232]
在氮气保护条件下,向500ml的三口瓶中加入100ml甲苯、30ml乙醇和20ml水,再加入中间体m1-br(5.5g)、2-萘硼酸(1.72g)、碳酸钠(2.12g,0.02mol)和四三苯基膦钯(0.115g,0.0001mol),缓慢升温至回流反应8h,降温至室温,加水分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,硅胶柱层析分离,石油醚:二氯甲烷=10:1(体积比)洗脱,得到化合物d-8-br的粗品(4.9g)。
[0233]
对化合物d-8-br的粗品进行hplc-ms检测,然后升华二次,升华前和升华后检测结果如下表16所示:
[0234]
表16
[0235][0236]
对比合成实施例5
[0237]
本对比合成实施例提供一种化合物d-11-br及其合成方法,合成方法如下:
[0238][0239]
参照化合物d-8-br的合成方法,区别仅在于,将2-苯硼酸替换为等物质的量的二苯并[b,d]呋喃-3-硼酸,得到化合物d-11-br的粗品。
[0240]
对化合物d-11-br的粗品进行hplc-ms检测,然后升华二次,升华前和升华后检测结果如下表17所示:
[0241]
表17
[0242][0243]
对比合成实施例6
[0244]
本对比合成实施例提供一种化合物d-12-br及其合成方法,合成方法如下:
[0245][0246]
参照化合物d-1-br的合成方法,区别仅在于,将二苯胺替换为等物质的量的咔唑,得到化合物d-12-br的粗品。
[0247]
对化合物d-12-br的粗品进行hplc-ms检测,然后升华二次,升华前和升华后检测结果如下表18所示:
[0248]
表18
[0249][0250][0251]
根据以上合成实施例及对比合成例的数据对比可知,根据本发明的合成方法制备得到的三嗪类化合物产品中杂质的含量显著低于对比合成例提供的化合物中杂质的含量,并且,经过升华一遍后,本发明的合成方法制备得到的三嗪类化合物产品中检测不到含有卤素的杂质。
[0252]
其他具体三嗪类化合物的制备方法可参照上述方法进行制备,本发明中不再一一进行说明。
[0253]
下述器件实施例和器件对比例中采用的化合物的具体结构如下所示:
[0254][0255]
器件实施例1
[0256]
本器件实施例提供一种有机电致发光器件,所述有机电致发光器件选用本发明合成实施例8所提供的升华后得到的化合物8作为有机电致发光器件中的电子传输材料;
[0257]
所述有机电致发光器件结构为:ito/npb(40nm)/em1(30nm)/电子传输材料(30nm)/lif(0.5nm)/al(150nm);
[0258]
所述有机电致发光器件制备过程如下:
[0259]
(1)将涂布了ito透明导电层(作为阳极)的玻璃基板在清洗剂中进行超声处理,然后在去离子水中冲洗,再在丙酮与乙醇混合溶剂中超声除油,再在洁净环境下烘烤至完全除水,用紫外光和臭氧清洗,并用低能阳离子束轰击表面,以改善表面的性质;
[0260]
(2)将上述玻璃基板置于真空腔内,抽真空至1
×
10-5
~1
×
10-6
pa,在阳极上真空蒸镀npb作为空穴传输层,蒸镀速率为0.1nm/s,蒸镀膜厚为40nm;
[0261]
(3)在空穴传输层之上真空蒸镀em1作为器件的有机发光层,蒸镀速率为0.1nm/s,蒸镀总膜厚为30nm;
[0262]
(4)在有机发光层之上真空蒸镀电子传输材料作为有机电致发光器件的电子传输层;其蒸镀速率为0.1nm/s,蒸镀总膜厚为30nm;
[0263]
(5)在电子传输层上真空蒸镀0.5nm的lif、150nm的al作为电子注入层和阴极。
[0264]
器件对比例1
[0265]
本器件对比例提供一种有机电致发光器件,与器件实施例1的区别仅在于,本器件对比例中使用对比合成实施例4提供的升华2次的d-8-br作为有机电致发光器件中的电子传输材料;其他条件与器件实施例1相同。
[0266]
性能测试:
[0267]
采用杭州远方生产的oled-1000多通道加速老化寿命与光色性能分析系统测量了所制备有机电致发光器件的亮度、驱动电压、电流效率以及寿命测试lt90,其中,寿命测试lt90是指在室温(25~27℃),保持初始亮度下的电流密度不变(此处为1000cd/m2),亮度降低为初始亮度90%所需要的时间,单位为小时,测试结果如下表19。
[0268]
表19
[0269]
[0270]
由表19的内容可知,以本发明提供的制备方法制备得到的三嗪类化合物作为电子传输层材料,制备得到的oled器件的寿命较长。
[0271]
器件实施例2-6
[0272]
器件实施例2-5分别提供一种有机电致发光器件,所述有机电致发光器件选用本发明合成实施例提供的升华后的化合物作为有机电致发光器件中的红光主体材料(详见表20);
[0273]
所述有机电致发光器件结构为:ito/npb(20nm)/红光主体材料:ir(piq)3[10%](35nm)/etm(25nm)/lif(0.5nm)/al(150nm);其中ir(piq)3[10%]是指红光染料的掺杂比例,即红光主体材料与ir(piq)3的体积份比为90:10;
[0274]
所述有机电致发光器件制备过程如下:
[0275]
(1)将涂布了ito透明导电层的玻璃板在商用清洗剂中超声处理,在去离子水中冲洗,在丙酮:乙醇混合溶剂中超声除油,在洁净环境下烘烤至完全除去水份,用紫外光和臭氧清洗,并用低能阳离子束轰击表面,以改善表面的性质;
[0276]
(2)把上述带有阳极的玻璃基片置于真空腔内,抽真空至1
×
10-5
~1
×
10-6
pa,在上述阳极层膜上真空蒸镀空穴传输层npb,蒸镀速率为0.1nm/s,蒸镀膜厚为20nm;
[0277]
(3)在空穴传输层之上真空蒸镀红光主体材料和染料ir(piq)3,作为有机电致发光器件的发光层,蒸镀速率为0.1nm/s,蒸镀总膜厚为35nm;
[0278]
(4)在发光层之上真空蒸镀电子传输层etm,其蒸镀速率均为0.1nm/s,蒸镀膜厚为25nm;
[0279]
(5)在电子传输层上真空蒸镀0.5nm的lif,150nm的al作为电子注入层和阴极。
[0280]
器件对比例2-5
[0281]
本器件对比例提供一种有机电致发光器件,与器件实施例2的区别仅在于,本器件对比例中使用本发明对比合成实施例提供的升华2次的化合物作为有机电致发光器件中的红光主体材料(详见表20),其他条件与器件实施例2相同。
[0282]
性能测试:
[0283]
采用杭州远方生产的oled-1000多通道加速老化寿命与光色性能分析系统测量所制备有机电致发光器件的亮度、驱动电压、电流效率以及寿命测试lt90其中,寿命测试lt90是指在室温(25~27℃),保持初始亮度下的电流密度不变(此处为1000cd/m2),亮度降低为初始亮度90%所需要的时间,单位为小时,测试结果如下表20。
[0284]
表20
[0285][0286]
由表20可知,以本发明提供的制备方法制备得到的三嗪类化合物作为红光主体材料,制备得到的oled器件的驱动电压较低,电流效率较高,使用寿命较长。
[0287]
器件实施例7-9
[0288]
器件实施例7-9提供一种有机电致发光器件,与器件实施例2的区别仅在于,本器件对比例中使用本发明合成实施例提供的氘代组合物作为有机电致发光器件中的红光主体材料,用来制备有机电致发光器件(详见表21,表21中使用化合物x的粗品表示包含化合物x的氘代组合物,例如,化合物1的粗品表示合成实施例1制备得到的包含化合物1的三嗪类组合物),其他条件与器件实施例2相同。
[0289]
性能测试:
[0290]
采用杭州远方生产的oled-1000多通道加速老化寿命与光色性能分析系统测量所制备有机电致发光器件的亮度、驱动电压、电流效率以及寿命测试lt90其中,寿命测试lt90是指在室温(25~27℃),保持初始亮度下的电流密度不变(此处为1000cd/m2),亮度降低为初始亮度90%所需要的时间,单位为小时,测试结果如下表21。
[0291]
表21
[0292][0293]
结合表20和表21的内容可知,相比于用纯化后得到的三嗪类化合物制备得到的oled器件而言,采用本发明提供的三嗪类组合物作为有机薄膜层的制备原料,制备得到的oled器件的驱动电压略有降低,电流效率略有提高,寿命有所下降。但是即使如此,以本发明提供的三嗪类组合物制备得到的oled器件的寿命均大大高于使用器件对比例2-5提供的
oled器件的寿命。由此可知,本发明提供的三嗪类组合物制备得到的oled器件性能较为优异。
[0294]
综上所述,本发明中通过对三嗪类组合物的制备方法进行设计,进一步通过碘代反应得到含有碘原子的中间体,进而通过该中间体制备得到易提纯、且产率较高的三嗪类组合物。本发明提供的三嗪类组合物和三嗪类化合物均适用于制备有机电致发光器件的有机薄膜层材料,且制备得到的有机电致发光器件寿命较长。
[0295]
申请人声明,本发明通过上述实施例来说明本发明的详细工艺流程,但本发明并不局限于上述详细工艺流程,即不意味着本发明必须依赖上述详细工艺流程才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1