集等温扩增和CRISPR/Cas核酸检测于一体的离心式微流控芯片及方法与流程
集等温扩增和crispr/cas核酸检测于一体的离心式微流控芯片及方法
技术领域
1.本发明属于微流控芯片技术领域,具体来说是一种集等温扩增和crispr/cas核酸检测于一体的离心式微流控芯片及其方法。
背景技术:
2.现场即时检测(point of care test,poct)对于预防和有效应对传染病爆发至关重要。而简单易用、多功能、高灵敏度且快速的核酸检测方法是poct的关键。目前核酸检测的主要方法是通过聚合酶链式反应(polymerase chain reaction,pcr)实现靶基因的扩增,后续再通过琼脂糖凝胶电泳实现结果可视化,或者可以通过荧光实时定量pcr在仪器上进行实时检测。pcr技术因灵敏度高、特异性好等优势,成为核酸检测的经典方法。但该技术依赖于精密的温控系统,设备价格高昂,反复升降温导致扩增时间较长,且需要专业的操作人员,无法很好得满足现场快速检测的需求。
3.规律成簇的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,crispr)是细菌中一种适应性免疫系统,crispr-cas系统以其特异性高、可开发性强、简单、高效等特点,成为基因编辑领域发展最快、应用最广的技术。既为体内基因编辑技术带来革命性突破,也为体外诊断领域开拓了新的方向。基于crispr-cas系统的体外诊断技术在病原体核酸检测方面展示出良好性能,在肿瘤基因诊断、遗传病筛查、移植排斥反应检测等方面也具有很大潜力。将crispr-cas系统应用于核酸检测,在提高诊断结果的可靠性方面表现出超高的灵敏度和单碱基分辨率的特异性,同时兼具检测时间短、成本低、便携式设计的特点,开辟了新一代核酸poct的应用场景,具有极大的市场潜力。
4.将crispr-cas系统与pcr或等温扩增技术相结合,在crispr检测前对目的片段进行扩增富集,可以显著提高检测灵敏度。但核酸扩增和crispr-cas体系是两个独立反应,即需先进行核酸扩增,然后再将扩增产物转移到crispr系统中进行靶基因检测。在转移过程中,由于存在扩增后开盖、产物转移、闭盖等操作,极易造成实验室气溶胶污染,导致检测结果假阳性,且在短时间内较难解决。另外,由于激活后的cas酶具有非特异反式切割功能,可以无差别切割荧光报告分子,导致crispr-cas体系无法实现多靶标同时检测,该项不足限制了crispr-cas方法在多种病原体筛查中的应用。因此,迫切需要建立一种方法或研制一种装置,在扩增结束后,完成产物得自动化、全封闭转移;同时,又能实现多个靶基因的同时扩增与检测。
5.公布号为cn112695073a的发明申请公开了一种rpa-crispr一步式核酸检测方法。所述核酸检测方法将待测溶液、rpa试剂混合放置在管底,将crrna与cas12a蛋白预装到注射器,在扩增反应后,通过推动注射器的活塞使得crrna和cas12a蛋白与反应混合物混合进行反应,再通过蓝光激发,得到检测结果。此方法通过注射器和离心管的结合将rpa反应和crispr反应整合到相对密闭的体系中,避免了核酸污染,具有一定的优越性。但是在操作过程中需要手动操作注射器,步骤繁琐且无法实现多个靶基因的同时检测。
6.微流控芯片作为最具发展潜力的新型分子诊断平台,将生物和化学等领域所涉及的样品制备、分离与检测等基本操作单元集成到一块几平方厘米的芯片上,具有样品用量少、分析时间短、高通量、灵敏度高、仪器小型化、污染小等优点。而离心式微流控芯片可以通过离心力来实现自动化进样,而且可以通过集成多个通道实现多个靶基因的同时扩增与检测。
7.公告号为cn205379906u的实用新型专利公开了一种多用途离心式微流控芯片,该芯片包括一条或者多条的波浪形主通道,每条主通道的一端与进样孔相连通,另一端与排气孔相连接,主通道的波谷处通过一连接管道与反应池相连接,在连接管道上设置缓存池。该芯片主要适合于一步法的等温扩增技术,即一阶段反应,核酸扩增和检测在一个腔体内进行,无法实现核酸扩增和crispr检测两阶段式反应。
技术实现要素:
8.本发明所要解决的技术问题在于如何实现核酸扩增和crispr检测两阶段分离。
9.本发明通过以下技术手段实现解决上述技术问题的:
10.集等温扩增和crispr/cas核酸检测于一体的离心式微流控芯片,包括一个或多个反应单元,按照液体流向,所述反应单元依次包括进样腔、第一连接通道、反应腔、第二连接通道、检测腔;所述第二连接通道包括弯曲部,液体流经所述弯曲部的阻力大于液体流经第一连接通道的阻力。
11.本发明通过在反应腔与检测腔中间加入弯曲部的第二连接通道,从而使第二连接通道的阻力大于第一连接通道,即液体经过第一连接通道所需的离心力小于第二连接通道,通过不同的离心力设定可保证在第一个阶段液体只进入反应腔,增大离心力可使反应腔内的液体进入检测腔,避免了样品在第一次离心时进入检测腔,影响后续检测反应。
12.进一步的,在第一离心力作用下,液体通过第一连接通道进入反应腔,并停留在反应腔,在第二离心力作用下液体从反应腔穿过第二连接通道进入检测腔,所述第一离心力小于第二离心力。
13.进一步的,所述弯曲部自第二连接通道的起始端开始。
14.进一步的,所述第一连接通道为直管。
15.进一步的,所述弯曲部为直角转弯的蛇形通道。
16.进一步的,在所述检测腔的上游还设置有缓冲腔。
17.进一步的,多个所述反应单元以微流控芯片的转动中心为圆心放射性均匀布置,多个所述反应单元的进样腔首尾连通,其中第一个反应单元的进样腔进口和最后一个反应单元的进样腔出口为样品进出口。
18.进一步的,相邻两个进样腔之间的连接通道为窄颈结构。
19.进一步的,所述反应单元除第二连接通道外为呈轴对称结构。
20.本发明还提供上述微流控芯片的使用方法,包括以下步骤:
21.将待测的核酸样本加入所述反应单元的进样腔后,启动离心机开始第一阶段的离心,使样品从进样腔进入反应腔,进行核酸扩增程序;在核酸扩增结束后,进行第二阶段离心,使反应腔内的液体进入检测腔,在检测腔内进行核酸检测程序,其中第一阶段的离心转速小于第二阶段的离心转速。
22.本发明的优点在于:
23.本发明通过在反应腔与检测腔中间加入弯曲部的第二连接通道,且弯折程度大于第一连接通道,从而使第二连接通道的阻力大于第一连接通道,即液体经过第一连接通道所需的离心力小于第二连接通道,通过不同的离心力设定可保证在第一个阶段液体只进入反应腔,增大离心力可使反应腔内的液体进入检测腔,避免了样品在第一次离心时进入检测腔,影响后续检测反应。
24.采用直角转弯的蛇形弯曲部可以延长第二连接通道的路径,转角处可以增大流通阻力,蛇形结构既可以减小芯片的直径,又可以增加阻力,实现两个阶段的离心目的。尤其是在第一连接通道为直管时,更容易拉开第一连接通道和第二连接通道的阻力差。
25.本发明通过缓冲腔的设计,可以使液体在进入检测腔的过程中不会产生气泡,从而均匀的充满检测腔;此外,缓冲腔的存在不仅可以容纳多余的液体,还可以在检测腔由于发生反应造成液体损失时给其补充液体,从而保证检测腔始终充满液体。
26.将反应单元设计成除第二连接通道外为轴对称结构,可以使得离心进样时更加均匀。
附图说明
27.图1为本发明实施例中微流控芯片的俯视图;
28.图2为本发明中实施例中微流控芯片的结构示意图;
29.图3为本发明中实施例中微流控芯片的单元结构解析图;
30.图4为本发明中实施例中微流控芯片中设置转折通道前后液体的分配情况;
31.图5为本发明中实施例中微流控芯片染料进样后,第一阶段离心后和第二阶段离心后的芯片照片;
32.图6为本发明中应用微流控芯片完成rpa-crisrp/cas反应测试的荧光图。
具体实施方式
33.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本实施例一部分实施例,而不是全部的实施例。基于本实施例中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本实施例保护的范围。
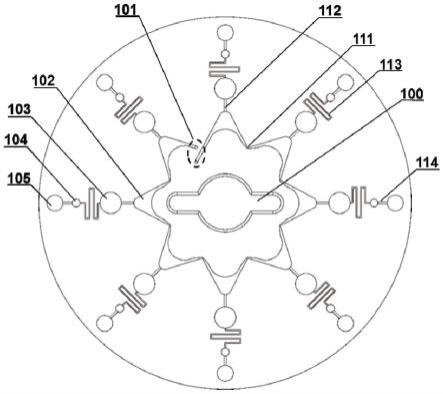
34.图1为本实施例提供的多功能检测的,两阶段式离心微流控芯片的俯视图。图2为本实施例微流控芯片的组成结构图。本实施例微流控芯片由下到上分别具有底片201,芯片基材202,盖片203。芯片的主要功能和结构在芯片基材层实现。本实施例的芯片为圆盘状,以中心为相对对称结构,其结构从内到外具有:位于芯片基材202中央部呈贯穿的芯片中轴100,此中轴的形状和离心设备的旋转轴相配套,通过离心设备带动芯片基材进行旋转,通过旋转的离心力实现对样品的分配。位于芯片基材202上的进出样品口101,包括进样口和出样口,出样口可以排出空气使得样品顺利注入,进出样品口位置相近,但是存在一定的距离,方便盖片对整个芯片进行密封,其中进出样品口101的锥型设计可与生物实验室常用的tips头严密配合,方便液体的注入;以及用于将样品输送到各个反应腔的流路,包括与各个反应腔相连的进样腔102,还包括连接各个进样腔的进样连接接通道111,流路两端分别与
进出样品口101相接;各个进样腔102和对应的反应腔103通过第一连接通道112相连接;第二连接通道113将对应的反应腔103和检测腔105相连接,检测腔105上游通过第三连接通道114与缓冲腔104连通。
35.如图3所示,进样腔102,反应腔103和检测腔105及其对应的连接通道构成一个反应单元,每一个反应单元除第二连接通道113整体呈轴对称,而反应单元间除进出样品口101呈旋转对称,这样的分布使得样品可以通过离心力的作用分配到反应腔和检测腔。本实施例中进样腔102呈月牙弯形状,在底端开口处和反应腔103通过第一连接通道112相连接,这样的设计方便在反应单元间均匀的分配试剂且防止交叉污染。
36.反应单元之间由一段窄颈部结构进样连接通道111相连接,与各个进样腔102共同组成花环状流路结构。呈窄颈部结构的进样连接通道111不仅起到连接流路的作用,还可以使得注入流路的液体在芯片旋转时被切割开,从而减少反应单元间的配液偏差。
37.如图3所示,在连接反应腔103和检测腔105的第二连接通道113呈弯曲回折结构,本实施例对第二连接通道113是否设置为弯曲回折结构的使用效果进行了对比。
38.如图4所示,当第二连接通道113为直流通道时,在芯片经过第一阶段的离心后,液体不仅从进样腔102进入了反应腔103,同时随着离心的作用,部分液体进入了检测腔105,造成液体在反应腔103和检测腔105同时存在的状况,从而与分阶段离心,分步反应的目的不符;当第二连接通道113为弯曲回折结构时,由于此结构的存在,使得通道的长度变长,同时由于弯折的作用使得液体从反应腔103进入检测腔105的阻力增大,导致液体从反应腔103进入检测腔105所需要的离心力增大,明显区别于从进样腔102到反应腔103所需要的离心力。因此,在合适的第一阶段离心作用下,液体刚好可以从进样腔102进入反应腔103,而不会进入检测腔105,从而实现分阶段进样的目的。
39.如图4所示,在检测腔105的前面设置了缓冲腔104,缓冲腔可以使液体在进入检测腔105的过程中不会产生气泡,从而均匀的充满检测腔105;此外,缓冲腔104的存在不仅可以容纳多余的液体,还可以在检测腔105由于发生反应造成液体损失时给其补充液体,从而保证检测腔105始终充满液体。
40.本实施例的微流控芯片中,芯片基材202优选使用含有聚丙烯、聚碳酸酯、丙烯酸、聚甲基丙烯酸甲酯中的任一种有机材料。使用这些材料使得芯片具有透光性,耐热性,强度特性。另外,芯片基材202的厚度优选的范围1~3mm,保证芯片的透光性,导热性,同时可以在其表面进行加工。加工的方法可以采用注塑成型,激光或者机械加工。
41.该芯片的底片201和盖片203采用具有一定粘合强度,耐高温性,光学透性且无基底荧光,生物相容性的具粘接层的材料,优选为聚烯烃、氯醋共聚物、丙烯酸树脂、有机硅中的任一种树脂材料。另外,底片和盖片材料的厚度优选的范围为0.05~1mm,保证芯片具有良好的热导率。底片201和盖片203在一定温度范围内具有耐受性,不同的温度条件配合各种生化反应;光学透性,方便后续搭配各种光学仪器的检测;低荧光背景,不会干扰样品后续的荧光检测;生物相容性,材料不会和生物试剂反应,不会抑制生物反应,不会影响生物试剂的反应;强力粘合性,能够承受一定的离心力,保证液体在离心时不会从检测腔的末段漏出。
42.本实施例的微流控芯片在装配基材之前,反应腔103和检测腔105可预埋不同的试剂。各个反应腔和各个检测腔可以分别固定不同的试剂,可以实现对一个样本同时实施不
同的处理,从而满足各个场景的检测需求。
43.对本实施例的微流控芯片用染料替代样品进行进样模拟,本模拟的芯片中应腔103的容积为1-10μl,且在特定的反应腔内预先装载与待测样本可以发生特异性反应的物质或核酸序列。检测腔105的容积为1-10μl,且检测腔内会预先装载可以和反应腔中的物质发生反应的成分,在发生反应之后可以被相应的外置设备检测或观察到。图5为分别为进样后,第一阶段离心后和第二阶段离心后的芯片照片。可以观察到,染料经过注样实验后,可以顺利充填全部进样腔102,同时没有染料进入反应腔103;接着,进行第一阶段的离心实验,转速优选为1000~5000rmp,离心的时间为10~60s。可以看到,经过第一阶段离心后,染料全部进入各个反应腔103,且配液均匀,同时没有染料进入检测腔105;最后,进行第二阶段的离心实验,转速优选为4000~10000rmp,离心的时间为10~60min。可以看到,经过第二阶段离心后,染料将各个检测腔105全部充满,同时无气泡产生,多余的染料进入缓冲腔104。因此,染料模拟进样实验表明,本实施例的微流控芯片可以实现通过控制不同的离心力实现分阶段进样的目的。
44.本实施例所提供的微流控芯片,可以开发多种应用,如生化反应,免疫反应,核酸反应等。本实施例以rpa-crispr核酸检测反应为例,说明此芯片的使用方式。
45.在本实施例的芯片平台上,等温扩增rpa和crispr检测分别在芯片的反应腔和检测腔进行。首先,经过第一阶段离心后,样品进入各个反应腔,利用等温扩增rpa的反应体系在恒温条件(37~42℃)对样品中的靶基因进行放大;然后,经过第二阶段离心后,样品进入各个检测腔,利用crispr酶在识别靶基因后会激活侧链切割活性,将报告基因进行切割,使得报告基因的荧光基团和淬灭基团分开,从而发出荧光,分别可以通过终点荧光检测和实时荧光检测判断靶基因的存在。rpa和crispr的反应体系所需的反应温度都在37~42℃,因此整个系统保持37~42℃恒温状态。整个反应系统可在15~40min内完成。
46.本实施例的特点是将rpa-crispr检测方法和微流控芯片技术相结合,可以在短时间内实现同时对多种核酸靶序列进行并行检测,即对一个样本同时检测多个病原体基因。
47.核酸检测微流控芯片在装配前需要在芯片基材层202预埋相应的反应试剂,分别将等温扩增试剂-重组酶聚合酶扩增(rpa)试剂,相应的寡核苷酸引物预埋在反应腔103;cas12酶,相应的crrna,rna inhibitor和reporter预埋在检测腔105。等预埋完成后,将底片201层与芯片基材层202进行装配,完成核酸检测微流控芯片的组装。
48.每个芯片具有8个反应单元,在每个单元中分别预埋一套rpa反应试剂和对应的一套crispr反应试剂。在芯片腔体中设置了阳性对照样品,可以检测7种不同的核酸靶序列,即在该芯片上可以同时检测7种病毒。
49.待检测样本可以是各种血液、痰液、采样拭子(喉、咽、鼻腔等),在检测前需要对样本进行处理,可以采用商业化提取试剂盒。采样拭子在采样时可以直接将样本保存在核酸释放保存液中。将处理过的样本与上样缓冲液进行混合,用生物实验室常见的tips对准进样口进行加样,上样总体积优选为60-100μl在加样结束后,用吸水纸将残余液体吸干,用盖片将进出样品口101进行密封。
50.将上样好的芯片放在离心装置上,进行第一阶段的离心,离心后,马上进行核酸扩增程序,在核酸扩增rpa结束后,进行第二阶段离心,最后,进行crispr核酸检测程序。在本实施例中,所诉第一阶段离心的转速优选为1000~5000rmp,离心的时间为10~60s;所述核
酸扩增rpa的程序优选为37℃~42℃,10~20min;所述第二阶段离心转速优选为4000~10000rmp,离心的时间为10~60min;所述crispr核酸检测程序优选为37℃~42℃,5~20min。
51.本实施例提供的离心式微流控芯片,只要在芯片制备时,将不同的试剂预埋至不同反应池内,即可实现两阶段反应的全封闭、自动化操作。该芯片的应用不仅仅局限于核酸扩增及检测,也可用于生化反应、免疫反应等多种形式的检测。其中,核酸检测也不仅仅局限于等温扩增与crispr/cas检测体系的结合,也可以用于等温扩增与其他产物检测方式的结合,如显色反应、电化学传感、胶体金试纸条等。
52.如图6,为使用本实施例的微流控芯片进行rpa-crisrp核酸检测实施例的荧光图,此荧光图是使用终点荧光法在反应结束后通过蓝光激发获得的荧光图。可以观察到,检测腔105分别显示出不同的荧光强度,说明此芯片可以完成rpa-crispr核酸检测。
53.以上实施例仅用以说明本实施例的技术方案,而非对其限制;尽管参照前述实施例对本实施例进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本实施例各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1