一种正交、双组份蛋白质自组装偶联体系及其构建方法
1.本发明属于基因工程和生物工程技术领域,具体涉及一种正交、双组份蛋白质自组装偶联体系及其构建方法。
背景技术:
2.类病毒颗粒(vlps)是一种由病毒单一或多个结构蛋白自行装配而成的高度结构化的蛋白质颗粒,直径大小介于20-150nm,形态上类似未成熟的病毒粒子,保持了病毒抗原蛋白的天然构象,但是由于缺乏调节蛋白和感染性核酸,因此无感染能力和致病能力。类病毒颗粒具有表面结构规则、空间结构稳定、生物相容性好和亲和力强等特点,在蛋白招募、药物载体、疫苗开发、合成生物学等方面均有广阔的应用前景。
3.鉴于类病毒颗粒上述的结构特点,目前专家学者将其广泛应用于蛋白质招募体系中,例如专利cn108064276b公开了一种将植物黄瓜花叶病毒(cmv)的类病毒颗粒和th细胞表位蛋白基因融合构成嵌合体招募蛋白的方法,nabel等人通过将病毒血凝素与铁蛋白亚基的n末端基因融合,自发组装成vlps,制备疫苗。尽管取得了上述成功,但功能性蛋白质或多肽与蛋白质笼的基因融合通常会导致不良结果,例如形成不溶性融合蛋白或破坏亚基不能组装成适当的笼状结构等。trevor douglas等人使用来自噬菌体l的三聚体装饰蛋白(dec)与p22类病毒颗粒非共价结合,实现了蛋白招募,但该方法结合力不强,限制了其进一步的应用,尽管目前vlps的研究越来越多,但其修饰依然存在许多个性问题,面临着很多挑战。
技术实现要素:
4.针对上述问题,本发明提供了一种正交、双组份蛋白质自组装偶联体系及其构建方法,选用一种人工计算设计并改造的类病毒颗粒-mi3,mi3是由60个单体亚基自行装配而成的多孔十二面体蛋白质颗粒,具有结构稳定,大小均一,生物相容性好等特点,非常适合作为蛋白招募的支架;为了提高类病毒颗粒mi3招募蛋白的结合能力,本发明选用了两对短肽作为招募结合标签:来源于cnab2结构域的spycatcher/spytag和来源于rrga结构域的dogcatcher/dogtag,这两对短肽之间能自发形成共价键,结构稳定,亲和力高,并且基因融合后对类病毒颗粒亚基结构的影响很小,不影响类病毒颗粒的自组装,有利于提高mi3与蛋白结合的稳定性。本发明选用青色荧光蛋白(cfp)和黄色荧光蛋白(yfp)作为模式蛋白,利用该方法对cfp和yfp在体外进行共价招募,有较好的招募效果,为降低目的产物的合成成本、提高生产效率提供了技术支持。
5.本发明的第一目的在于提供一种dogtag-linker-mi3-linker-spytag融合蛋白及其制备方法。
6.本发明的第二目的是提供一种dogcatcher-linker-yfp融合蛋白及其制备方法。
7.本发明的第三目的是提供一种spycatcher-linker-cfp融合蛋白及其制备方法。
8.本发明的第四目的是提供一种正交、双组份蛋白质自组装偶联体系的构建方法。
9.本发明的第五目的是提供上述构建方法得到的双组份蛋白质自组装偶联体系。
10.为了实现本发明的上述目的,提供以下技术方案:
11.一种dogtag-linker1-mi3-linker2-spytag融合蛋白,其主要由类病毒颗粒mi3亚基、短肽结合标签dogtag和spytag组成,所述融合蛋白能够自行装配成类病毒颗粒。
12.基于上述技术方案,进一步地,所述linker1和linker2的氨基酸序列独立为gsgesg或(ggggs)n,n=1-10。
13.基于上述技术方案,进一步地,所述mi3亚基的核苷酸序列如seq id no.5所示。
14.基于上述技术方案,进一步地,短肽结合标签dogtag的核苷酸序列如seq id no.6所示。
15.基于上述技术方案,进一步地,短肽结合标签spytag的核苷酸序列如seq id no.7所示。
16.上述dogtag-linker1-mi3-linker2-spytag融合蛋白的制备方法,将短肽结合标签dogtag基因和spytag基因嵌合到类病毒颗粒mi3的蛋白基因中得到融合的基因重组片段,该重组片段经表达体系表达得到所述融合蛋白。
17.基于上述技术方案,进一步地,dogtag嵌合位点为类病毒颗粒mi3蛋白的n端,spytag嵌合位点为类病毒颗粒mi3蛋白的c端。
18.一种dogcatcher-linker3-yfp融合蛋白,其主要由模式蛋白yfp和短肽结合标签dogcatcher组成,所述融合蛋白能够与dogtag-linker1-mi3-linker2-spytag融合蛋白自行组装。
19.基于上述技术方案,进一步地,所述linker3的氨基酸序列为(ggggs)n,n=1-10。
20.基于上述技术方案,进一步地,所述模式蛋白yfp的核苷酸序列如seq id no.8所示。
21.基于上述技术方案,进一步地,短肽结合标签dogcatcher的核苷酸序列如seq id no.9所示。
22.上述dogcatcher-linker3-yfp融合蛋白的制备方法,将短肽结合标签dogcatcher基因嵌合到类病毒颗粒mi3的蛋白基因中得到融合的基因重组片段,该重组片段经表达体系表达得到所述融合蛋白。
23.基于上述技术方案,进一步地,dogcatcher嵌合位点为模式蛋白yfp蛋白的n端。
24.一种spycatcher-linker4-cfp融合蛋白,其主要由模式蛋白cfp和短肽结合标签spycatcher组成,所述融合蛋白能够与dogtag-linker1-mi3-linker2-spytag融合蛋白自行组装。
25.基于上述技术方案,进一步地,所述linker4的氨基酸序列为(ggs)n,n=1-10。
26.基于上述技术方案,进一步地,所述模式蛋白cfp的核苷酸序列如seq id no.10所示。
27.基于上述技术方案,进一步地,短肽结合标签spycatcher的核苷酸序列如seq id no.11所示。
28.上述spycatcher-linker4-cfp融合蛋白的制备方法,将短肽结合标签spycatcher基因嵌合到类病毒颗粒mi3的蛋白基因中得到融合的基因重组片段,该重组片段经表达体系表达得到所述融合蛋白。
29.基于上述技术方案,进一步地,spycatcher嵌合位点为模式蛋白cfp蛋白的n端。
30.一种正交、双组份蛋白质自组装偶联体系的构建方法,主要包括以下步骤:
31.(1)构建能够在宿主细胞中表达dogtag-linker1-mi3-linker2-spytag融合蛋白的质粒,转化入宿主细胞中,培养后,分离纯化获得dogtag-linker1-mi3-linker2-spytag融合蛋白;
32.(2)构建能够在宿主细胞中表达dogcatcher-linker3-yfp融合蛋白的质粒,转化入宿主细胞中,培养后,分离纯化获得dogcatcher-linker3-yfp融合蛋白;
33.(3)构建能够在宿主细胞中表达spycatcher-linker4-cfp融合蛋白的质粒,转化入宿主细胞中,培养后,分离纯化获得spycatcher-linker4-cfp融合蛋白;
34.(4)将步骤(1)-(3)获得的dogtag-linker1-mi3-linker2-spytag融合蛋白、dogcatcher-linker3-yfp融合蛋白和spycatcher-linker4-cfp融合蛋白混合,进行自组装,得到mi3-cfp-yfp组装的复合体。
35.基于上述技术方案,进一步地,宿主细胞包括大肠杆菌、酵母菌和动物细胞。
36.基于上述技术方案,进一步地,dogtag-linker1-mi3-linker2-spytag融合蛋白、dogcatcher-linker3-yfp融合蛋白和spycatcher-linker4-cfp融合蛋白的摩尔比为1:1-10:1-10,优选摩尔比为1:3:3。
37.上述的构建方法获得的正交、双组份蛋白质自组装偶联体系。
38.本发明相对于现有技术具有的有益效果如下:
39.本发明首次利用类病毒颗粒mi3以及两对短肽spycatcher/spytag和dogcatcher/dogtag自反应系统,开发了一种正交、双组份蛋白质自组装偶联体系构建方法,且该方法能够同时实现大分子蛋白cfp和yfp的共组装,为构建人工仿生多酶复合物、降低目的产物的合成成本、提高生产效率提供了技术支持。因而该方法对于推动构建结构稳定、装载量高、成本低廉的多酶复合物具有重要的意义。
附图说明
40.为了更清楚地说明本发明实施例,下面将对实施例涉及的附图进行简单地介绍。
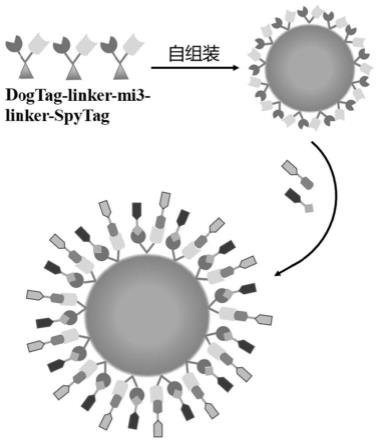
41.图1为本发明的dogtag-mi3-spytag系统的自组装示意图。
42.图2为sds-page蛋白电泳检验dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp表达图谱,其中条带1为spycatcher-linker-cfp,理论分子量为39.1kda;条带2为dogcatcher-linker-yfp,理论分子量为41.3kda;条带3为dogtag-linker-mi3-linker-spytag,理论分子量为29.6kda。
43.图3为凝胶色谱技术检测dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp结果图谱;(a)spycatcher-linker-cfp;(b)dogcatcher-linker-yfp;(c)dogtag-linker-mi3-linker-spytag。
44.图4为动态光散射技术检测dogtag-linker-mi3-linker-spytag的结果图。
45.图5为sds-page蛋白电泳检验体外组装结果图,其中,条带1为dogtag-linker-mi3-linker-spytag和spycatcher-linker-cfp按目的蛋白摩尔比1:3体外组装;条带2为dogtag-linker-mi3-linker-spytag和dogcatcher-linker-yfp按目的蛋白摩尔比1:3体外组装;条带3为dogtag-linker-mi3-linker-spytag、spycatcher-linker-cfp和
dogcatcher-linker-yfp按目的蛋白摩尔比1:3:3体外组装;条带4为条带3的重复试验,m为marker。
46.图6为凝胶色谱技术检测dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp体外组装的结果图。
47.图7为动态光散射技术检测dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp体外组装的结果示意图。
48.图8为激光扫描共聚焦显微镜观察胞内dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的组装结果图(比例尺:10μm),其中a为cfp荧光分布;b为yfp荧光分布;c为明场分布图;d为a、b、c三图叠加。
49.图9为激光扫描共聚焦显微镜观察胞内dogcatcher-linker-yfp和spycatcher-linker-cfp的组装结果示意图(比例尺:10μm),其中a为cfp荧光分布;b为yfp荧光分布;c为明场分布图;d为a、b、c三图叠加。
50.图10为western blot蛋白质免疫印迹检验胞内dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的组装结果示意图,其中,条带1为pcdfduet-1-spycatcher-linker-cfp-stag-dogcatcher-linker-yfp重组蛋白工程菌;条带2为pet28a-dogtag-linker-mi3-linker-spytag和pcdfduet-1-spycatcher-linker-cfp-stag-dogcatcher-linker-yfp共表达重组蛋白工程菌,m为marker。
具体实施方式
51.为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
52.下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
53.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
54.本发明选择类病毒颗粒生物支架组装技术,利用spytag/spycatcher和dogtag/dogcatcher作为功能组装模块,构建了mi3-cfp-yfp组装复合体,并将其应用于大肠杆菌的胞内组装中,提供了一种新的基于类病毒颗粒的组装方法,首先,根据相关基因片段的特点,利用同源重组技术构建工程菌,获得dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp融合蛋白;其次,体外混合dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp融合蛋白进行自组装,获得mi3-cfp-yfp组装复合体,并利用相关的实验表征验证组装效果,最后,将该组装方法应用于大肠杆菌的胞内,探究该方法在胞内的组装效果。本发明为构建多酶复合物提供技术支持,也为spytag/spycatcher和dogtag/dogcatcher自组装模块应用于多酶复合体的构
建提供理论实验依据。
55.以下实施例中所用到的材料与试剂:质粒pet28a-spycatcher-mi3(spycatcher-mi3的基因序列如seq id no.1所示)、pet28a-dogcatcher-mi3(dogcatcher-mi3的基因序列如seq id no.2所示)、pet28a-dogtag-cfp(dogtag-cfp的基因序列如seq id no.3所示)、pet28a-dogcatcher-yfp(dogcatcher-yfp的基因序列如seq id no.4所示)和质粒pcdfduet-1-cfp-yfp(pcdfduet-1-cfp-yfp中,mcs-1为cfp的核苷酸序列,mcs-2为yfp的核苷酸序列)均为本实验室保存(根据以下基因序列,也可以通过常规方法构建得到);大肠杆菌dh5α和bl21(de3)感受态细胞均为本实验室保存;质粒提取试剂盒和pcr纯化试剂盒,广州飞扬生物工程有限公司。
56.以下通过具体实施例,对本发明做进一步的阐述,但是不用于限制本发明的保护范围。
57.实施例1:dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的工程菌构建
58.本实施的所有构建过程均依据聚合酶链式反应(polymerase chain reaction,pcr)基本原理。
59.为了构建pet28a-dogtag-linker-mi3-linker-spytag(此处前后linker分别为gsgesg和(ggggs)3,即ggggsggggsggggs),利用同源重组的方法,由于dogtag和spytag的基因片段较小(69bp和39bp),故以插入突变的方式,将dogtag和spytag基因片段设计在引物中,首先以pet28a-spycatcher-mi3为模板,以dt-mi3-st-f和dt-mi3-st-r为引物,扩增得到含有dogtag-linker-mi3-linker-spytag的dna片段;然后以pet28a-spycatcher-mi3为模板,以voc-dt-mi3-st-f/r为引物,扩增得到pet28a载体片段;将上述得到的两片段经pcr产物纯化后,进行gibson连接并转化,获得阳性质粒后测序验证,准确测序的质粒保存备用。
60.为了构建pet28a-dogcatcher-linker-yfp(选择的linker为(ggggs)3即ggggsggggsggggs),采用同源重组方式,以pcdfduet-1-cfp-yfp为模板,以dc-yfp-f/r为引物,经过pcr扩增得到质粒dna片段linker-yfp;然后以pet28a-dogcatcher-mi3为模板,以voc-dc-yfp-f/r为引物,扩增得到pet28a-dogcatcher载体片段;将两片段经pcr产物纯化后,进行gibson连接并转化,获得阳性质粒后测序验证,准确测序的质粒保存备用。
61.为了构建pet28a-spycatcher-linker-cfp(选择的linker为(ggs)4即ggsggsggsggs),采用同源重组方式,以pet28a-spycatcher-mi3为模板,以sc-cfp-f/r为引物,经过pcr扩增得到dna片段spycatcher;然后以pet28a-dogtag-cfp为模板,以voc-sc-cfp-f/r为引物,扩增得到pet28a-linker-cfp载体片段;将两片段经pcr产物纯化后,进行gibson连接并转化,获得阳性质粒后测序验证,准确测序的质粒保存备用。
62.所有质粒均经测序验证,然后转化到大肠杆菌bl21(de3)中进行重组蛋白表达。研究中使用的引物见表1,相应的pcr扩增体系见表2。
63.表1.本实施例中设计融合质粒所使用的主要引物
[0064][0065]
表2.pcr体系和同源重组体系
[0066]
[0067]
实施例2:融合蛋白的表达、纯化与表征
[0068]
(1)重组质粒转化表达:将所得的融合蛋白重组质粒pet28a-dogtag-linker-mi3-linker-spytag、pet28a-dogcatcher-linker-yfp和pet28a-spycatcher-linker-cfp分别采用热激转化法导入e.coli bl21(de3)中,获得的阳性克隆菌株经放大培养,当培养至od
600
吸光值达到0.6-0.8时,添加iptg(终浓度均为0.2mm)进行诱导表达,分别在16℃下培养16h,待表达过程完成后,将菌液进行超声破碎后保留上清,利用亲和层析技术对其进行纯化,再利用凝胶色谱技术对其进一步纯化,获得极高纯度的蛋白,收集蛋白后浓缩分装并加入10%甘油于-80℃保存备用;
[0069]
(2)融合蛋白表征:利用sds-page电泳检测所得蛋白质单体的分子量,电泳结果显示目的条带分子量与理论分子量一致;利用凝胶色谱技术检测所得蛋白质的分子量,出峰位置显示目的条带分子量与理论分子量一致,表明类病毒颗粒dogtag-linker-mi3-linker-spytag成功进行了自组装;利用动态光散射技术测定dogtag-linker-mi3-linker-spytag的粒径,结果显示dogtag-linker-mi3-linker-spytag粒径约为42.3nm,且均一度很好,呈现稳定的笼状结构,与理论结构一致。
[0070]
图2为sds-page蛋白电泳检验dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的结果,由图2可知,目的蛋白单体分子量与理论分子量一致,所构建的融合蛋白均可表达。
[0071]
图3为凝胶色谱技术检验dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的结果,由图3可知,目的蛋白分子量出峰位置与理论分子量一致,说明dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp成功进行了自组装。
[0072]
图4为动态光散射技术检测dogtag-linker-mi3-linker-spytag的结果,由图4可知,dogtag-linker-mi3-linker-spytag均一度很好,呈现稳定的笼状结构,与理论结构一致。
[0073]
实施例3:体外组装复合物的构建
[0074]
(1)体外mi3-cfp-yfp复合物的构建:在20mm,ph=7.4的pbs中按目的蛋白摩尔比1:3:3胞外混合dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp,25℃静置12h;
[0075]
(2)组装复合物的表征:取组装结束后的样品进行sds-page蛋白电泳,并利用凝胶色谱技术和动态光散射技术对组装产物进行表征,检测组装效果。
[0076]
图5为sds-page蛋白电泳检验dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的组装效果,由图5可知,目的组装蛋白分子量与理论分子量一致,dogtag-linker-mi3-linker-spytag与dogcatcher-linker-yfp和spycatcher-linker-cfp有较好的组装效果。
[0077]
图6为凝胶色谱技术检验dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的组装效果,由图6可知,目的组装蛋白在第一个出峰位置,与理论一致,组装后没有破坏蛋白的结构。
[0078]
图7为动态光散射技术检测dogtag-linker-mi3-linker-spytag、dogcatcher-linker-yfp和spycatcher-linker-cfp的组装结果,由图7可知,组装后的复合体粒径约为
cfp重组蛋白共价组装的条带,证明dogtag-linker-mi3-linker-spytag在胞内成功进行了招募。
[0089]
最后应说明的是:虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1