一种检测内源性H2O2和H2S共存及交替存在的荧光探针及其制备方法和应用
一种检测内源性h2o2和h2s共存及交替存在的荧光探针及其制备方法和应用
技术领域
1.本发明属于生物化学领域,涉及一种荧光探针和其合成及应用,可用于检测内源性h2o2和h2s共存及交替存在,具体地说,涉及有机荧光探针的合成方法和细胞成像应用。
背景技术:
2.过氧化氢(h2o2)和硫化氢(h2s)在哺乳动物复杂的氧化还原调节中发挥调节作用。作为研究较多的活性氧,h2o2由nadp/h氧化酶、黄嘌呤氧化酶和胺氧化酶等内源性合成。同时,h2s通过胱硫醚-γ-裂解酶、胱硫醚-β-合酶和3-巯基丙酮酸硫转移酶从l-半胱氨酸生成。h2o2和h2s的不同信号通路已被分别确定。有文献表明,h2o2和h2s在生理条件下的反应很慢,因此它们在氧化还原生物学中的相互作用被认为是间接的。然而,人们对h2o2和h2s之间的潜在作用机制的认识仍然非常不完整。
3.到目前为止,人们已经构建了各种特异性针对h2o2或h2s的荧光探针,然而这些荧光探针无法阐明h2o2和h2s在生物体内的相互作用,因为它们仅对一种特定的分析物有响应性。作为一种替代策略,多年来人们已经开发了几种具有双刺激响应位点的单分子探针。与单刺激响应探针相比,这些双刺激响应探针减少了信号串扰并大大提高了空间分辨率。然而,与特定生物标志物的反应导致这些双刺激响应探针对进一步的刺激失去活性,从而使它们无法对h2o2和h2s的动态和交替存在做出响应。已经存在的几种动态可逆探针能够监测h2o2和硫醇的交替存在。然而,这些动态可逆探针是由一种分析物激活循环过程的,这使它们无法可视化h2o2和h2s的共存。由于h2o2和h2s在某些生物事件中发挥协同作用,因此开发能够阐明h2o2和h2s之间相互作用的新型荧光探针具有重要意义。
4.基于此背景下,本发明设计合成了一种对h2o2和h2s具有优异响应性能的有机荧光探针,该探针能够在h2o2和h2s共存时开启荧光发射,并在接下来的h2o2和h2s交替存在时顺序关闭和开启荧光,并成功地将其应用于细胞内源性h2o2和h2s共存和交替存在的荧光可视化。
技术实现要素:
5.本发明第一个目的是首次提供一种检测内源性h2o2和h2s共存及交替存在的荧光探针,其是能够同时检测内源性h2o2和h2s共存及交替存在的荧光探针。
6.本发明第二个目的是首次提供一种能够同时检测内源性h2o2和h2s共存及交替存在的有机荧光探针制备方法。
7.本发明第三个目的是首次提供一种能够同时检测内源性h2o2和h2s共存及交替存在的荧光探针利用近红外荧光分析手段在检测细胞中内源性过氧化氢和硫化氢共存及交替存在上的应用。
8.本发明通过下述技术方案实现:
9.本发明首次提供了一种检测内源性h2o2和h2s共存及交替存在的荧光探针,即其为
同时具有h2o2和h2s共存及交替存在响应性能的荧光探针,其结构如式ⅰ所示。
[0010][0011]
本发明提供了上述荧光探针在800nm处强的近红外荧光发射,将其首次用于hek293细胞中内源性h2o2和h2s共存及交替存在的荧光成像。
[0012]
进一步,所述检测内源性h2o2和h2s的有机荧光探针利用的是近红外荧光的分析手段来检测内源性过氧化氢和硫化氢的共存及交替存在。
[0013]
本发明还提供一种所述检测内源性h2o2和h2s共存及交替存在的荧光探针的制备方法,路线为:
[0014][0015]
具体方法为:
[0016]
化合物1的合成
[0017]
将化合物a、硫代乙酸钾和甲醇在室温下搅拌。真空除去溶剂,用dcm稀释,合并有机相,用去离子水洗涤,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到产物为白色粉末。
[0018]
化合物2的合成
[0019]
将化合物1溶于甲醇中,氩气保护下,加入hcl,搅拌回流。将混合物冷却至室温后,
真空除去溶剂,用dcm稀释,合并有机相,用去离子水洗涤,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到白色粉末状产物。
[0020]
化合物b的合成
[0021]
化合物b的合成参考专利-赵春常,张秀丽,张丽丽,王飞翼,江海沨,安建才,张帆,一种检测内源性h2s的荧光探针及其制备方法和应用,中国:专利号:zl201410766204.6,2015-03-11,证书号:第2250092号,
[0022]
化合物3的合成
[0023]
将化合物b、化合物2、dmap和乙腈在室温下搅拌。在真空下除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到产物为红色粉末。
[0024]
化合物4的合成
[0025]
将丙二腈溶于无水乙醇中,加入化合物3,在氩气保护下加热回流。冷却至室温,用dcm稀释,合并有机相并用水洗涤,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到红色固体产物。
[0026]
化合物5的合成
[0027]
将化合物4溶于甲苯中,加入4-羟基苯甲醛、哌啶、乙酸,在氩气保护下加热回流。冷却至室温,用dcm稀释,合并有机相并用水洗涤,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到黑色固体产物。
[0028]
荧光探针ⅰ的合成
[0029]
将化合物5溶于乙腈中,然后加入2,4-二硝基苯磺酰氯和无水碳酸钾,将混合物在氩气保护下加热回流。冷却至室温,用dcm稀释,合并有机相并用水洗涤,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到黑色固体产物,即为检测内源性h2o2和h2s共存及交替存在的荧光探针。
[0030]
本发明还提供一种所述检测内源性h2o2和h2s共存及交替存在的荧光探针在检测内源性h2o2和h2s共存上的应用。
[0031]
本发明还提供一种所述检测内源性h2o2和h2s共存及交替存在的荧光探针在检测内源性h2o2和h2s交替存在上的应用。
[0032]
本发明有益的技术效果:
[0033]
本发明提供的荧光探针合成方法简单,成本相对低廉,但成像性能优异,其能够在共聚焦显微镜下通过近红外荧光强度变化清晰成像活细胞中的h2o2和h2s的共存及交替存在(见附图6),首次实现了细胞中内源性h2o2和h2s共存及交替存在的荧光可视化。
[0034]
本发明中所提供的有机荧光探针具有非常优良的近红外荧光性能,能够在h2o2和h2s同时存在时开启近红外荧光发射,并且在接下来的h2o2和h2s交替存在时顺序关闭和开启荧光发射,首次实现了内源性h2o2和h2s共存和交替存在的荧光可视化,在生物化学及医学领域的荧光成像中有着及其可观的应用前景。
附图说明
[0035]
图1为式ⅰ所示荧光探针的合成路线图。
[0036]
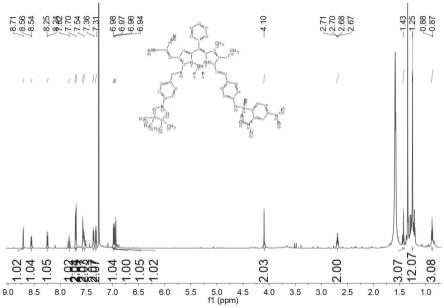
图2为式ⅰ所示荧光探针在cdcl3中的1h nmr图谱。
[0037]
图3为式ⅰ所示荧光探针对h2o2和h2s的响应机制。
[0038]
图4(a)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s共存的紫外吸收光谱响应,图4(b)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s交替存在的紫外吸收光谱响应(备注:h2o2浓度为1mmol/l,h2s浓度为100μmol/l,测试溶剂为pbs:乙腈=1:1)。
[0039]
图5(a)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s共存的荧光发射光谱响应,图5(b)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s交替存在的荧光发射光谱响应(备注:h2o2浓度为1mmol/l,h2s浓度为100μmol/l,测试溶剂为pbs:乙腈=1:1,激发波长为730nm)。
[0040]
图6为式ⅰ所示荧光探针在hek293细胞中成像h2o2和h2s共存及交替存在时的效果图(备注:激发波长为633nm,收集波长为737-800nm)。
具体实施方式
[0041]
下面结合实施例对本发明作进一步阐述,本领域技术人员应当理解,所述实施例仅用于示例,而不对本发明构成任何限制。
[0042]
实施例1
[0043]
式ⅰ所示荧光探针的合成
[0044][0045]
化合物1的合成
[0046]
将4.32g(14.55mmol)化合物a(从商业公司购买,没有进一步纯化)、3.58g(31.35mmol)硫代乙酸钾和35ml甲醇在室温下搅拌3小时。真空除去溶剂,用dcm稀释,合并有机相,用去离子水洗涤3次,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到产物为白色粉末(2.15g,50.57%)。1h nmr(400mhz,cdcl3)δ=7.73(d,2h),7.30(d,2h),4.12(s,2h),2.34(s,3h),1.33(s,12h).
[0047]
化合物2的合成
[0048]
将2g(6.84mmol)化合物1溶于30ml甲醇中,氩气保护下,加入8mlhcl,66℃搅拌回
流2小时。将混合物冷却至室温后,真空除去溶剂,用dcm稀释,合并有机相,用去离子水洗涤3次,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到白色粉末状产物(1.32g,77.14%)。1h nmr(400mhz,dmso-d6)δ=7.61(d,2h),7.34(d,2h),3.34(s,2h),2.90-2.86(t,1h),1.29(s,12h).
[0049]
化合物b的合成
[0050]
化合物b的合成参考专利-赵春常,张秀丽,张丽丽,王飞翼,江海沨,安建才,张帆,一种检测内源性h2s的荧光探针及其制备方法和应用,中国:专利号:zl201410766204.6,2015-03-11,证书号:第2250092号,
[0051]
化合物3的合成
[0052]
将300mg(0.78mmol)化合物b、250mg(1mmol)化合物2、120mg(0.98mmol)dmap和20ml乙腈在室温下搅拌12小时。在真空下除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到产物为红色粉末(220mg,46.99%)。1h nmr(400mhz,cdcl3)δ=9.35(s,1h),7.65(d,2h),7.51-7.49(m,3h),7.32-7.30(m,2h),7.15(d,2h),6.58(s,1h),4.23(s,2h),2.75(s,3h),2.42-2.38(q,2h),1.50(s,3h),1.32(s,12h),1.08-1.04(t,3h).
[0053]
化合物4的合成
[0054]
将66mg(1mmol)丙二腈溶于20ml无水乙醇中,加入200mg(0.33mmol)化合物3,在氩气保护下加热回流4h。冷却至室温,用30mldcm稀释,合并有机相并用水洗涤3次,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到红色固体产物(156mg,73%)。1h nmr(400mhz,cdcl3)δ=7.69(d,2h),7.55-7.54(m3h),7.35(m,2h),6.96(d,2h),6.94(s,1h),6.91(s,1h),4.08(s,2h),2.76(s,3h),2.44-2.41(q,2h),1.53(s,3h),1.34(s,12h),1.09-1.07(t,3h).
[0055]
化合物5的合成
[0056]
将150mg(0.23mmol)化合物4溶于20ml甲苯中,加入4-羟基苯甲醛100mg(0.82mmol)、哌啶0.1ml、乙酸0.1ml,在氩气保护下加热回流12h。冷却至室温,用30mldcm稀释,合并有机相并用水洗涤3次,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到黑色固体产物(60mg,35%)。1h nmr(400mhz,cdcl3)δ=7.78(d,1h),7.69(d,2h),7.64-7.63(m,3h),7.55-7.54(m,3h),7.36(d,2h),6.96-6.92(m,5h),6.90(s,1h),4.11(s,2h),2.74-2.69(q,2h),1.55(s,3h),1.35(s,12h),1.23-1.21(t,3h).
[0057]
荧光探针ⅰ的合成
[0058]
将60mg(0.08mmol)化合物5溶于10ml乙腈中,然后加入27mg(0.1mmol)2,4-二硝基苯磺酰氯和10mg(0.07mmol)无水碳酸钾,将混合物在氩气保护下加热回流3h。冷却至室温,用30mldcm稀释,合并有机相并用水洗涤3次,用无水硫酸钠干燥,真空除去溶剂。所得粗产物通过硅胶柱色谱法纯化,得到黑色固体产物(22mg,28%)。1h nmr(400mhz,cdcl3)δ=8.71(s,1h),8.56(d,1h),8.25(d,1h),7.85(d,1h),7.71(d,2h),7.70(d,2h),7.57(d,2h),7.54(d,2h),7.37(dd,2h),7.32(d,2h),6.98(s,1h),6.97(s,1h),6.96(s,1h),6.94(s,1h),4.10(s,2h),2.71-2.67(q,2h),1.43(s,3h),1.25(s,12h),0.89-0.87(t,3h).
[0059]
实施例2
[0060]
hek293细胞在添加了10%胎牛血清和1%青霉素-链霉素的dulbecco'seagle培养基中于37℃在5/95co2/空气培养箱的湿润气氛中培养24h。将细胞接种在玻璃底培养皿中,
并在实验前使其粘附24小时,并在成像前用pbs缓冲液(ph7.4)洗涤。这些细胞分别使用3μg/ml过氧化氢激动剂pma,10μm荧光探针ⅰ,1mm硫化氢抑制剂aoaa,3mm硫化氢激动剂sam单独或组合处理,在成像之前使用pbs缓冲液洗涤3次。在1ml细胞培养基中加入1μldmso作为探针助溶剂。使用leicatcssp8共聚焦显微镜和63倍油镜进行荧光成像,激发波长:633nm,收集波长737-800nm。
[0061]
图3为式ⅰ所示荧光探针对h2o2和h2s的响应机制,说明了探针反应前后其化学结构的变化,表明了该探针对h2o2和h2s荧光响应的原理。
[0062]
图4(a)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s共存的紫外吸收光谱响应,图4(b)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s交替存在的紫外吸收光谱响应,表明了该探针能够在h2o2存在时开启近红外吸收并在h2s共存时进一步开启近红外吸收,并且在h2o2和h2s交替存在时交替关闭和开启近红外吸收,证明了该荧光探针能够在h2o2和h2s的共存及交替存在时做出近红外吸收响应(备注:h2o2浓度为1mmol/l,h2s浓度为100μmol/l,测试溶剂为pbs:乙腈=1:1)。
[0063]
图5(a)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s共存的荧光发射光谱响应,图5(b)为式ⅰ所示荧光探针浓度为10μmol/l时对h2o2和h2s交替存在的荧光发射光谱响应,表明了该探针能够在h2o2和h2s共存时开启近红外荧光发射,并在h2o2和h2s交替存在时交替关闭和开启近红外荧光发射,证明了该荧光探针能够使用近红外荧光检测h2o2和h2s的共存及交替存在(备注:h2o2浓度为1mmol/l,h2s浓度为100μmol/l,测试溶剂为pbs:乙腈=1:1,激发波长为730nm)。
[0064]
图6为式ⅰ所示荧光探针在hek293细胞中成像h2o2和h2s共存及交替存在时的效果图,表明了该探针能够在活细胞中h2o2和h2s共存时开启近红外荧光发射,并在h2o2和h2s交替存在时交替关闭和开启近红外荧光发射,证明了该荧光探针能够使用近红外荧光检测活细胞中内源性h2o2和h2s的共存及交替存在(备注:激发波长为633nm,收集波长为737-800nm)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1