一种从棘孢木霉中提取腺苷的方法以及腺苷和应用
1.本发明属于微生物制备领域,更具体地,涉及一种从棘孢木霉中提取腺苷的方法以及腺苷和应用。
背景技术:
2.木霉菌拮抗植物病原菌的一个重要机制就是其代谢产物的抑菌作用。目前对木霉菌次级代谢产物抑制植物病原菌生长方面的报道有很多,相关报道表明:从哈茨木霉(trichoderma harzianum)中分离得到的化合物包括:6-戊基-2h-吡喃-2-酮(6-pentyl-2h-pyran-2-one,6-pp)、1,2-二溴-4-叔丁基苯(harzianopyridone)、2(5h)-呋喃酮(2(5h)-furanone)和δ-癸内酯(δ-decanolactone),对菜豆壳球孢菌(macrophomina phaseolina)、立枯丝核菌(rhizoctonia solani)、齐整小核菌(sclerotium rolfsii)和尖孢镰刀菌(f.oxysporum)等植物病原菌均具有显著的抑制效果。其中6-pp是从木霉中分离到的第一个挥发性物质,首次在绿色木霉(t.viride)中发现,后来从多种木霉中均分离到该物质,包括深绿木霉(trichoderma atroviride)、哈茨木霉(trichoderma harzianum)、棘孢木霉(t.asperellum)等。哈茨木霉菌株t16和t23产生的6-pp可抑制串珠镰刀菌(fusarium moniliforme)的毒素物质萎蔫酸的产生。共培养哈茨木霉和长春花产生的嵌入木霉素能够显著抑制枯草芽孢杆菌的活性。来自长枝木霉(trichoderma longibrachiatum)的麦角素a(ergokonin a)对枯草芽孢杆菌(bacillus subtilis)、烟曲霉菌(aspergillus fumigatus)和新型隐球菌(cryptococcus neoformans)均具有抑制作用。绿木霉(t.virens)菌株ps1-7可产生抗性物质胡萝卜-4烯-9,10-二醇,能够防治由于植物苗床伯克霍尔德氏菌(burkholderia plantarii)引起的水稻幼苗枯萎病。
3.木霉菌次级代谢产物不仅能够抑制植物病原菌的生长,还能够促进植物生长、诱导植物产生系统性抗性提高植物抗病性。来自奶油木霉的cremenolide对番茄幼苗生长具有显著促进作用。来源于哈茨木霉的harzianic acid浓度为100和10μg时抑制了油菜种子根和茎的生长,但是在浓度为100、10和1ng时具有明显的促进生长的作用。来源于哈茨木霉的harzianolide能够促进番茄、油菜和小麦的生长。6-pp除了能抑制病原菌的生长,还具有促进植物生长、调节根系结构、诱导植物产生系统抗性等功能。从哈茨木霉中分离得到的6-戊基-α-吡喃酮(6-pentyl-α-pyrone,6-pap)能够抑制黄瓜枯萎病病原菌尖孢镰刀菌黄瓜专化型的生长,并能诱导黄瓜对病原菌的抗病性。el-hasan等发现6-pap在高浓度(200-300mg/l)浸种处理玉米种子时抑制了玉米种子的生长,但是相同的使用浓度在温室条件下促进了玉米的生长,并通过提高玉米体内的抗性酶活性来提高玉米的抗性。
4.在农作物生产上,农作物病害长期以来一直是造成减产的重要原因,为了预防和减少病害的发生,大量使用化学农药仍然是大部分地区的防治策略。然而,推进化肥农药减量增效已是大势所趋。因此,木霉菌作为一种生物防治菌十分有必要在农业生产中进行更广泛、更全面的应用。目前在木霉菌中发现的次级代谢产物有上百种之多,但是关于这些次级代谢产物的活性分析主要集中于抑菌活性、抗肿瘤活性、细胞毒性等生物活性的初步探
索上,应用于植物生长调节和抗病性方面的研究还相对较少。
5.腺苷,又名腺嘌呤核苷,是一种天然存在的遍布人体的内源性嘌呤核苷,是体内重要的能量代谢合成物质。腺苷作为一种被广泛应用于医药行业的药物,具有巨大的商业价值。在临床上,腺苷在心血管系统和神经系统方面的应用较多在冠状血管障碍、糖尿病、动脉硬化症、高血压症、心律失常等疾病治疗方面有重要的作用。腺苷的生产方法主要是化学合成和生物合成两大类。化学合成不但成本高,而且对环境不友好,并且会产生不需要的副产物,合成效率底,因此很难应用到大规模的工业生产上。生物合成法中的rna降解法,由于在水解rna的过程中会产生4种核苷的混合物,在工业生产时工艺比较复杂,目前基本上被淘汰。微生物发酵法生产核苷主要是利用腺苷高产菌株自身的代谢积累作用得到腺苷。发酵法生产腺苷由于其具有成本低、易发酵、产苷速度快、产量高、品质好等特点,目前已成为主要的生产腺苷的方法。被广泛使用的菌株主要是枯草芽孢杆菌,而利用木霉菌生产腺苷的报道则很少,利用腺苷提高植物抗病性和促进植物生长的报道几乎没有。
6.因此,目前亟待提出一种从木霉中提取腺苷的方法,使得提取的苯腺苷可应用在植物生长调节和抗病性方面。
技术实现要素:
7.本发明的目的是针对现有技术的不足,提出一种从棘孢木霉中提取腺苷的方法以及腺苷和应用。本发明方法提取的腺苷可应用于促进植物生长、抑制植物病原菌生长、诱导植物产生抗病性和降低植物发病率。
8.为了实现上述目的,本发明第一方面提供了一种从棘孢木霉中提取腺苷的方法,该方法包括如下步骤:
9.s1:将棘孢木霉的孢子悬液接种于装有玉米粉液体培养基的发酵罐中进行发酵培养,得到发酵物;
10.s2:利用大孔吸附树脂柱对所述发酵物进行洗脱处理,收集洗脱液;将所述洗脱液进行旋蒸处理并收集代谢物溶液;
11.s3:将所述代谢物溶液进行萃取处理并收集上层溶液再进行旋蒸处理,得到浸膏;
12.s4:将所述浸膏在有机混合溶剂中溶解,得到溶解混合物;利用正相硅胶柱层析法对所述溶解混合物进行梯度洗脱层析处理,得到22组馏分;利用半制备液相色谱仪在其中至少一组馏分中分离得到所述腺苷。
13.在本发明中,所述棘孢木霉(trichoderma asperellum)cbs 433.97,保藏号为accc30536,购自中国农业微生物保藏中心(accc)。
14.根据本发明,优选地,所述棘孢木霉的孢子悬液的制备方法包括:
15.(1)在无菌条件下,将棘孢木霉菌丝体接种于pda培养基中,在25-30℃倒置培养1-5天,得到活化平板菌落;
16.(2)将所述活化平板菌落接种于pd培养基中,在25-30℃、150-200rpm下震荡培养5-10天,得到培养液;
17.(3)在超净工作台中,用无菌纱布对所述培养液进行过滤,得到滤液;
18.(4)在光学显微镜下,用血球计数板对所述滤液中的孢子进行计数,然后用无菌蒸馏水稀释所述滤液至孢子含量为1.5
×
10
8-2.5
×
108个/ml,得到所述棘孢木霉的孢子悬液。
19.根据本发明,优选地,在步骤s1中,将棘孢木霉的孢子悬液接种于装有玉米粉液体培养基的发酵罐中之前,还包括对所述装有玉米粉液体培养基的发酵罐在115-125℃下进行灭菌处理25-35分钟,待所述灭菌处理完成后,将所述装有玉米粉液体培养基的发酵罐冷却至25-30℃,接入所述棘孢木霉的孢子悬液。
20.根据本发明,优选地,将棘孢木霉的孢子悬液接种于装有玉米粉液体培养基的发酵罐中进行发酵培养的条件包括:发酵温度25-30℃,发酵时间10-20天,通气量为0.12-1vvm。
21.根据本发明,优选地,所述玉米粉液体培养基的体积为85-95l。
22.根据本发明,优选地,接种于装有玉米粉液体培养基的发酵罐中的所述棘孢木霉的孢子悬液的用量为90-110ml。
23.根据本发明,优选地,在步骤s2中,所述旋蒸处理的温度为40-50℃。
24.根据本发明,优选地,在步骤s3中,所述萃取处理包括:利用乙酸乙酯对所述代谢物溶液萃取2-4次;所述代谢物溶液与乙酸乙酯的体积比为1:(0.8-1.2)。
25.根据本发明,优选地,在步骤s4中,所述有机混合溶剂为二氯甲烷和甲醇的混合物,所述二氯甲烷和甲醇的体积比为1:(0.8-1.2)。
26.根据本发明,优选地,在步骤s4中,所述浸膏与所述有机混合溶剂的比为1:(3-5)g/ml。
27.根据本发明,优选地,在步骤s4中,进行梯度洗脱层析处理所用的洗脱体系为石油醚-二氯甲烷-甲醇洗脱体系。
28.根据本发明,优选地,所述腺苷的结构式为式(1)所示:
[0029][0030]
本发明第二方面提供了所述的从棘孢木霉中提取腺苷的方法提取得到的腺苷。
[0031]
本发明第三方面提供了所述的腺苷在促进植物生长、抑制植物病原菌生长、诱导植物产生抗病性和降低植物发病率中的至少一种中的应用。
[0032]
根据本发明,优选地,包括:
[0033]
将所述腺苷用于促进小麦和苦瓜幼苗的生长;
[0034]
将所述腺苷用于抑制小麦赤霉病病原菌和苦瓜枯萎病病原菌的生长;
[0035]
将所述腺苷用于诱导苦瓜对苦瓜枯萎病产生抗病性;
[0036]
将所述腺苷用于诱导小麦对赤霉病产生抗病性;
[0037]
和将所述腺苷用于对小麦赤霉病的防效至36.04-46.48%。
[0038]
本发明的技术方案的有益效果如下:
[0039]
(1)本发明方法提取的腺苷具有明显的促进小麦株长高和根长;促进苦瓜株长高、根长、根数多和控制叶片大小的作用。
[0040]
(2)本发明方法提取的腺苷具有明显的抑制小麦赤霉病病原菌禾谷镰刀菌
(fusarium graminearum)ph-1和苦瓜枯萎病病原菌尖孢镰刀菌苦瓜转化型(fusarium oxysporum f.sp.momordicae)的生长以及抗氧化酶系统的建立。
[0041]
(3)本发明方法提取的腺苷具有明显的诱导小麦和苦瓜产生抗病性的作用。
[0042]
(4)本发明方法提取的腺苷具有明显的防治小麦赤霉病和苦瓜枯萎病的作用。
[0043]
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
[0044]
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显,其中,在本发明示例性实施方式中,相同的参考标号通常代表相同部件。
[0045]
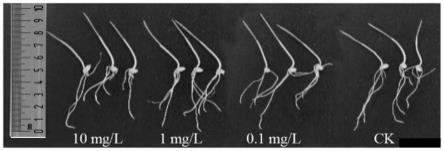
图1(a)示出了本发明实施例1提取的腺苷对小麦幼苗生长情况的影响的示意图。(其中,ck表示使用等量蒸馏水的对照组)
[0046]
图1(b)示出了本发明实施例1提取的腺苷对小麦幼苗生长指标的影响的示意图。(其中,ck表示使用等量蒸馏水的对照组;小写字母a、b、ab表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0047]
图2(a)示出了本发明不同浓度的实施例1提取的腺苷对小麦禾谷镰刀菌的抑菌率的示意图。(其中,小写字母a、b、c表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0048]
图2(b)示出了本发明不同浓度的实施例1提取的腺苷对小麦禾谷镰刀菌丝生长情况的影响示意图。
[0049]
图3(a)-(d)示出了本发明实施例1提取的腺苷对含有禾谷镰刀菌ph-1的小麦的生理指标的影响(其中,ppo活性为多酚氧化酶活性;pod活性为过氧化物酶活性;小写字母a、b、c表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0050]
图4示出了使用不同浓度本发明实施例1提取的腺苷处理后小麦苗期赤霉病发病程度图。
[0051]
图5示出了使用不同浓度本发明实施例1提取的腺苷处理后小麦大田赤霉病发病程度图。
[0052]
图6(a)-(c)示出了本发明实施例1提取的腺苷对苦瓜幼苗生长情况的影响的示意图。(其中,ck表示使用等量蒸馏水的对照组)
[0053]
图6(d)示出了本发明实施例1提取的腺苷对苦瓜幼苗根长的影响的示意图。(其中,小写字母a、b、c、ab表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0054]
图6(e)示出了本发明实施例1提取的腺苷对苦瓜幼苗根数的影响的示意图。(其中,小写字母a、b、c、ab表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0055]
图6(f)示出了本发明实施例1提取的腺苷对苦瓜幼苗株高的影响的示意图。(其中,小写字母a、b、c、ab表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0056]
图6(g)示出了本发明实施例1提取的腺苷对苦瓜幼苗叶片大小的影响的示意图。(其中,小写字母a、b、c、ab表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0057]
图7(a)示出了本发明不同浓度的实施例1提取的腺苷对尖孢镰刀菌菌的抑菌率的
示意图。(其中,小写字母a、b、c表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
[0058]
图7(b)示出了本发明不同浓度的实施例1提取的腺苷对尖孢镰刀菌菌丝生长情况的影响示意图。
[0059]
图8(a)-(d)示出了本发明实施例1提取的腺苷对含有尖孢镰刀菌菌的小麦的生理指标的影响(其中,ppo活性为多酚氧化酶活性;pod活性为过氧化物酶活性;小写字母a、b、c表示p<0.05水平下差异显著;柱形图数值为3次重复的平均值
±
sd)
具体实施方式
[0060]
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了使本发明更加透彻和完整,并且能够将本发明的范围完整地传达给本领域的技术人员。
[0061]
以下实施例中,所述棘孢木霉(trichoderma asperellum)cbs 433.97,保藏号为accc30536,购自中国农业微生物保藏中心(accc);
[0062]
所述小麦为周麦36,选自周口市农业科学院;
[0063]
所述苦瓜为赛碧绿,购自于山东寿光市洪亮种子有限公司。
[0064]
实施例1
[0065]
本实施例提供一种从棘孢木霉中提取腺苷的方法,该方法包括如下步骤:
[0066]
s1:所述棘孢木霉的孢子悬液的制备,其包括:
[0067]
(1)在无菌条件下,用接种环在菌落边缘挑取一块棘孢木霉cbs433.97菌丝体于pda培养基中间,在28℃倒置培养3天,得到活化平板菌落;
[0068]
(2)用直径为6mm的打孔器在活化平板菌落边缘打取一块菌饼接种于100mlpd培养基中,在28℃、180rpm下震荡培养7天,得到培养液;
[0069]
(3)在超净工作台中,用无菌纱布对所述培养液进行过滤,得到滤液;
[0070]
(4)在光学显微镜下,用血球计数板对所述滤液中的孢子进行计数,然后用无菌蒸馏水稀释所述滤液至孢子含量为2
×
108个/ml,得到所述棘孢木霉的孢子悬液。
[0071]
对所述装有90l玉米粉液体培养基的发酵罐在120℃下进行灭菌处理30分钟后,将所述装有玉米粉液体培养基的发酵罐冷却至28℃,接入100ml棘孢木霉的孢子悬液,28℃发酵培养14天,通气量为0.12-1vvm,得到发酵物;
[0072]
s2:先对大孔吸附树脂柱进行预处理:将大孔吸附树脂与99%的工业乙醇混合加入柱内,用洗耳球敲打层析柱柱壁以除去气泡,浸泡4小时。用工业乙醇冲洗大孔吸附树脂3-4个柱体积,直至流出的乙醇不浑浊,然后将蒸馏水加入洗脱体系中进行冲洗,直至下端流出的液体无醇味。
[0073]
然后,将步骤s1得到的发酵物加入洗脱体系进行吸附(发酵物从大孔吸附树脂柱上端开始吸附,离底端约1/3处为大孔吸附树脂极限),然后用蒸馏水进行冲洗(2-3个柱体积),除去水溶性物质,随后加入工业乙醇进行洗脱,收集洗脱液;将所述洗脱液在45℃下进行旋蒸处理并收集代谢物溶液;
[0074]
s3:利用乙酸乙酯对所述代谢物溶液萃取3次(所述代谢物溶液与乙酸乙酯的体积
比为1:1),收集上层溶液再进行旋蒸处理,得到浸膏55g,4℃冰箱保存备用;
[0075]
s4:将所述浸膏55g在二氯甲烷和甲醇的混合物(所述二氯甲烷和甲醇的体积比为1:1)溶剂200ml中溶解,得到溶解混合物;利用正相硅胶柱层析法对所述溶解混合物进行梯度洗脱层析处理(即将溶解混合物加入180g层析硅胶吸附拌样减压蒸干后,添加到预装硅胶玻璃减压柱(360g硅胶)上,用石油醚-二氯甲烷-甲醇洗脱体系进行梯度洗脱层析),得到22组馏分,利用半制备液相色谱仪(10%甲醇,流速10ml/min,检测波长:210nm,30mg,tr=17.3min)在21组馏分中分离得到所述腺苷,如式(1)所示:
[0076][0077]
测试例1
[0078]
本测试例用于测试实施例1提取的腺苷对促进小麦生长的作用。
[0079]
挑选籽粒饱满的小麦种子用45℃温水浸泡两小时然后将小麦种子平均均匀的放在4个培养皿中(9mm),培养皿底部铺有一层滤纸片,每个皿50颗小麦种子。将实施例1提取的腺苷分别制成0.1、1、10mg/l的溶液,吸取5ml配置好的各个浓度的溶液分别加入到3个培养皿中,使用等量蒸馏水作为对照组ck加入到第4个培养皿中,每个培养皿进行3次重复试验。室温培养一段时间后测量小麦根长、株高和根数。
[0080]
在小麦发芽后3天,测量小麦幼苗的根数、根长和株高来评估实施例1提取的腺苷是否对小麦具有促进生长的作用,如图1(a)、(b)所示,当腺苷浓度为0.1-10mg/l时,对小麦根长和根数均无明显影响(图1(b)),当腺苷浓度为0.1mg/l时,显著促进了小麦的株高(p<0.05),株高增加了4.7%(图1(b))。
[0081]
测试例2
[0082]
本测试例用于测试实施例1提取的腺苷对小麦禾谷镰刀菌ph-1菌丝生长的抑制作用。
[0083]
采用含药培养基法,将实施例1提取的腺苷加入pda培养基(45-55℃)中,分别配制成浓度为0mg/l、50mg/l、100mg/l、200mg/l、300mg/l的含药培养基,倒板。在培养3天的病原菌(禾谷镰刀菌ph-1)平板的边缘打取一个6mm的菌饼,接种于含药培养基中央,28℃培养,并记录菌落直径,每组浓度实验重复3次。
[0084]
由图2(a)、(b)可以看出,当腺苷浓度为50mg/l时对禾谷镰刀菌的抑制作用较明显,在2-4天的抑菌率分别为11.23%、8.11%和8.46%。
[0085]
测试例3
[0086]
本测试例用于测试实施例1提取的腺苷对含有禾谷镰刀菌ph-1的小麦的生理指标的影响。
[0087]
本测试例采用测试例1的方法对小麦种子进行处理,室温培养72h后将小麦苗移栽到花盆中,每盆200g土,在盆中生长3天后,用接种针将小麦苗胚轴中间刺破,滴加10μl禾谷镰刀菌ph-1菌液(孢子数为2
×
107个/ml)。在小麦接种禾谷镰刀菌ph-1菌液后7天测定小麦
叶片内的ppo、pod活性、游离脯氨酸含量和丙二醛含量,如图3(a)-(d)所示,腺苷增加了小麦叶片内的ppo和pod活性,减少了丙二醛(mda)的含量,但是游离脯氨酸含量也减少了。当腺苷浓度为10mg/l时,ppo活性提高了106.3%,pod活性提高了606.5%,丙二醛含量减少了61.9%。
[0088]
测试例4
[0089]
本测试例用于测试实施例1提取的腺苷对小麦苗期赤霉病的防效。
[0090]
1)小麦赤霉病病麦粒的制备
[0091]
将小麦种子用蒸馏水浸泡2小时,然后将种子装入锥形瓶中在121℃下进行灭菌15min。然后在锥形瓶中接种1ml小麦赤霉病病原菌孢子悬液(禾谷镰刀菌ph-1菌液),孢子悬液的制备方法与测试例3的方法一致,在28℃培养箱中培养7天,每天晃动一次,得到小麦赤霉病病麦粒,放置4℃冰箱保存备用。
[0092]
2)将实施例1提取的腺苷配制成浓度为10mg/l、100mg/l、300mg/l的药液备用。
[0093]
3)小麦苗期赤霉病防效试验
[0094]
将健康的小麦种子用50℃的温水浸泡2小时,然后平均且均匀的种在3个花盆中,每盆20颗健康小麦种子;待小麦发芽7天后,将步骤2)中不同浓度的腺苷溶液喷施于小麦叶片,每盆喷施药液10ml,作为处理组,同时设置阳性对照组:250mg/l恶霉灵,设置阴性对照组:水;喷洒药液1天后将步骤1)的病麦粒接种于小麦根部,每株一颗病麦粒,根据小麦幼苗叶鞘发病情况对发病程度进行分级,病情指数及防效计算方法见公式(1)和(2):
[0095]
0级:无症状;
[0096]
1级:外层叶鞘有明显的褐色或黑褐色斑,病斑小于1/2直径;
[0097]
3级:外层叶鞘有明显的褐色或黑褐色斑,病斑大于1/2直径,但内层叶鞘无症状;
[0098]
5级:内层叶鞘有明显的褐色或黑褐色斑,病斑小于1/2直径;
[0099]
7级:内层叶鞘有明显的褐色或黑褐色斑,病斑大于1/2直径,但植株不死苗;
[0100]
9级:植株死苗。
[0101][0102][0103]
不同浓度腺苷处理后小麦的发病情况如图4所示,当腺苷浓度为300mg/l时,小麦的病斑大小与阴性对照组的水处理相比具有显著性差异,降低了25.68%,对小麦赤霉病的防效为36.04%。但是腺苷浓度在10-300mg/l时小麦的发病率均高于恶霉灵和水处理,病情指数无显著性差异,如表1所示。(不同小写字母a、b、c、ab表示p<0.05水平下差异显著)
[0104]
表1
[0105][0106]
测试例5
[0107]
本测试例用于测试实施例1提取的腺苷对小麦大田赤霉病的防效。
[0108]
小麦扬花期时,在大田中的小麦穗部和叶部喷施10mg/l、100mg/l、300mg/l的腺苷溶液,2天后在小麦穗部喷施小麦赤霉病孢子悬液,孢子悬液的制备方法与测试例3的方法一致,田间随机区组设计,每小区面积1m2,每个处理3个重复。20天后各小区采用5点取样法,每点抽取20-30个麦穗,逐个记载发病情况,计算小麦病情指数,病情指数与防效的计算公式见公式(1)和(2),分级标准如下:
[0109]
0级:无症状;
[0110]
1级:发病小穗占全穗的1/4以下;
[0111]
2级:发病小穗占全穗的1/4-1/2;
[0112]
3级:发病小穗占全穗的1/2-3/4;
[0113]
4级:发病小穗占全穗的3/4以上。
[0114]
不同浓度腺苷处理田间小麦后,小麦赤霉病发病情况见图5,小麦病情指数和小麦赤霉病发病情况见表2。腺苷浓度为300mg/l时,小麦的病情指数为30.31,与水处理相比,对小麦赤霉病的防效为46.48%,与恶霉灵的病情指数与防效相比有显著性差异,病情指数比恶霉灵低8.1,防效比恶霉灵提高了14.55%。
[0115]
表2
[0116][0117]
测试例6
[0118]
本测试例用于测试实施例1提取的腺苷对促进苦瓜生长的作用。
[0119]
将苦瓜种子用45℃温水浸泡5小时,然后将苦瓜种子平铺在湿纱布上,再在上面覆盖一层湿纱布,28℃黑暗培养至胚根长出,然后将实施例1提取的腺苷分别制成0.1、1、10mg/l的溶液,用不同浓度的溶液分别浸泡苦瓜种子12h,将苦瓜种子转移至花盆中,每盆200g土。
[0120]
在苦瓜发芽后第10天时,测量苦瓜幼苗的根数、根长和株高来评估腺苷是否对苦瓜具有促进生长的作用。如图6(a)-(g)所示,当腺苷浓度为0.1-10mg/l时,对苦瓜的根长、根数和叶片大小无明显的促进作用。当腺苷浓度为10mg/l时,显著促进了苦瓜的株高(p<0.05),株高增加了14.81%。
[0121]
测试例7
[0122]
本测试例用于测试实施例1提取的腺苷对尖孢镰刀菌菌丝生长的抑制作用。
[0123]
采用含药培养基法,将实施例1提取的腺苷加入pda培养基(45-55℃)中,分别配制成浓度为0mg/l、50mg/l、100mg/l、200mg/l、300mg/l的含药培养基,倒板。在培养3天的病原菌(尖孢镰刀菌菌)平板的边缘打取一个6mm的菌饼,接种于含药培养基中央,28℃培养,并记录菌落直径,每组浓度实验重复3次。
[0124]
由图7(a)、(b)可以看出,腺苷对尖孢镰刀菌具有抑制作用,但是各浓度之间的抑菌率差异不大。
[0125]
测试例8
[0126]
本测试例用于测试实施例1提取的腺苷对含有尖孢镰刀菌菌的苦瓜的生理指标的影响。
[0127]
本测试例采用测试例6的方法对苦瓜种子进行处理,之后采用浸根法对苦瓜接种病原菌,将苦瓜根部浸泡在病原菌悬液中半小时,将苦瓜苗再移栽到土中。接种病原菌14天后测定苦瓜叶片内的ppo和pod活性、游离脯氨酸含量和丙二醛含量,如图8(a)-(d)所示,ppo活性增加了41.9%,pod活性增加了166.7%,游离脯氨酸含量增加了18.1%。随着浓度的降低苦瓜叶片内的丙二醛含量出现了降低的情况,但是依然比对照高。
[0128]
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1