制造膜联蛋白V的方法与流程
本技术涉及用于生产包含膜联蛋白a5(anxa5)序列的蛋白质的方法。更具体地,所述方法用于anxa5蛋白的回收和/或提纯,特别是从重组宿主细胞(如细菌宿主细胞)中。本文中所描述的方法是非常高效且具成本效益的,并且可以用于工业规模(例如,使用具有约1000l或以上的培养体积的重组宿主细胞培养物)从而快速且方便地生产医药级anxa5蛋白产物。
背景技术:
1、在本说明书中明显在先发表文件的列表或论述不应必须看作是承认该文件是现有技术水平的部分或者是公知常识。
2、动脉粥样硬化性血栓形成(形成于潜在动脉粥样硬化斑块上)是大多数临床上显而易见的缺血性心血管疾病(包括急性冠状动脉疾病、脑血管和周围动脉闭塞)的关键致病机制。如在cederholm和frostegard,2007,《药物新闻与视点(drug news perspect.)》,20(5):321-6中所描述,膜联蛋白a5(以前被称为膜联蛋白v,是膜联蛋白超家族中的一员)是具有强大且独特抗血栓特性的蛋白质。由膜联蛋白a5所产生的抗血栓作用被认为主要是由于对磷脂类(尤其是磷脂酰丝氨酸)的结构屏蔽来减少它们对凝固反应的可利用性而导致。然而,报道了可能导致其抗血栓作用的膜联蛋白a5的其他令人感兴趣的特性,特别是表面表达的组织因子的下调,或者与和止血有关联的另外配体(如硫脑苷脂和肝素)的相互作用以及尿激酶型纤溶酶原激活物的上调。膜联蛋白a5在体内作为内源性抗血栓系统一员的的生物学意义已被建议用于大脉管系统和胚胎微循环。
3、实际上,已知膜联蛋白a5在医学中、在提供直接治疗效果中具有大范围的应用。例子包括膜联蛋白a5的下列应用:
4、用于预防动脉粥样硬化性血栓形成和/或斑块破裂,如在wo 2005/099744中所描述(所述专利的内容通过引用并入本文);
5、用于治疗血管功能障碍、减轻缺血性疼痛和/或治疗血管病破裂,如在wo 2009/077764中所描述(所述专利的内容通过引用并入本文);
6、用于预防或治疗再狭窄,如在wo 2009/103977中所描述(所述专利的内容通过引用并入本文);
7、用于抑制氧化心磷脂(oxcl)的活性并用于治疗、预防和/或减少患上心血管疾病、自身免疫性疾病或炎症状态的风险,如在wo 2010/069605中所描述(所述专利的内容通过引用并入本文);以及
8、用于预防和/或减少在手术干预之后的围手术期或手术后并发症,例如血管手术(特别是外周血管手术)之后的并发症,如在wo 2012/136819中所描述(所述专利的内容通过引用并入本文)。
9、因此,膜联蛋白a5代表具有高治疗利益和潜能的蛋白质。因此,迫切需要利用高效且具有成本效益的方法来生产治疗级膜联蛋白a5蛋白质的有效方法;所述方法可以被扩大并且方便地应用于工业规模生产(例如,从具有约1000l或以上培养体积的重组宿主细胞培养物中采集膜联蛋白a5蛋白质)。
10、一个具体的问题是,当在标准细菌宿主细胞,如大肠杆菌(e.coli)中重组地表达膜联蛋白a5时被来源于宿主细胞的成分(尤其是内毒素)所污染。内毒素是一种脂多糖(lps),所述脂多糖是由脂质和通过共价键连接的o抗原、外核以及内核所组成的多糖构成;lps被发现于革兰氏阴性细菌的外膜中,并且在动物中引起强免疫应答。膜联蛋白a5的特征是其与含有带负电荷磷脂的生物膜的强结合,因此对内毒素有特别高的亲和力。这使得由内毒素产生宿主大规模地工业化生产膜联蛋白a5更加具有挑战性。
11、迄今为止,尚未提供这种方法以利用高效且具有成本效益的方法来生产治疗级膜联蛋白a5蛋白质,所述方法可以被扩大并且方便地应用于工业规模生产(例如,从具有约1000l或以上培养体积的重组宿主细胞培养物中采集膜联蛋白a5蛋白质),更不用说以解决内毒素污染的方式。
12、1991年,kumar报道了对用于膜联蛋白a5的生产和提纯的方法的开发(本科荣誉学院论文,标题为“人重组膜联蛋白v蛋白质的表达、提纯以及大规模生产”,呈递给阿肯色大学工学院化工学院,阿肯色州费耶特维尔市,可通过网址https://uarkive.uark.edu/xmlui/handle/10826/981在线获得)。kumar的方法包括:在100ml培养瓶中利用重组大肠杆菌宿主细胞来表达膜联蛋白a5,使细胞形成团块,在由50mm tris hcl、10mm cacl2(ph7.2)所组成的匀化/裂解缓冲液的存在下重悬细胞,然后利用超声处理使细胞破裂从而释放出膜联蛋白a5蛋白质。所加入的cacl2导致膜联蛋白a5以钙依赖性方式结合到碎片中的细胞膜,然后使混合物经历20分钟的第一提纯离心步骤,其后将上清液丢弃并且将含有细胞碎片和结合的膜联蛋白a5的细胞团块加以回收。使用edta将膜联蛋白a5从团块中释放出,接着是20分钟的第二提纯离心步骤和采集上清液中的膜联蛋白a5。然后,在deae-琼脂糖凝胶柱上的阴离子交换和利用盐梯度对膜联蛋白a5进行洗脱的进一步的步骤之前,进行一夜透析从而将用于膜联蛋白a5的缓冲液改变为tris hcl(ph 8.0)。
13、本发明申请人已意识到kumar的方法中存在着许多限制和缺点。第一,其仅使用100ml培养物小规模进行,并且在提纯方法期间需要两个独立的离心步骤。这不可扩展到以高效方式使用大体积培养物(例如1000l或以上)的工业化方法。如下面进一步的描述,这种大体积流体的离心将会是非常耗时且昂贵的。然而,kumar的方法必须采用离心,而离心依赖于作为初步捕获步骤的利用膜联蛋白a5与细胞碎片中膜的钙诱导结合。第二,本发明申请人已意识到kumar的方法导致膜联蛋白a5蛋白质的高损失,例如由于对第一提纯离心步骤的产物上清液中未结合的可溶性膜联蛋白a5的处理。第三,kumar的方法完全不能将内毒素去除到适合于治疗应用的水平,并且值得注意的是,没有对最后产物中的内毒素水平进行检查。因此,kumar的方法不能以高效且有时效的方式扩展到工业生产,导致膜联蛋白a5蛋白质的高损失(即,低产率)并且导致不适合于治疗应用的低级蛋白质提纯。
14、2008年,位于华盛顿大学医学中心的实验室医学部的tait研究实验室发表了标题为“由质粒pet12a-papi生产重组膜联蛋白v”的文件。其可通过网址https://depts.washington.edu/labweb/faculty/tait/108.pdf在线获得。所描述的方法非常类似于由kumar提出的方法。所述方法包括:在1l培养物中的重组大肠杆菌宿主细胞中表达膜联蛋白a5,使细胞形成团块,在由50mm tris hcl、10mm cacl2(ph 7.2)所组成的匀化/裂解缓冲液的存在下重悬细胞,然后利用超声处理使细胞破裂从而释放出膜联蛋白a5蛋白质。所加入的cacl2导致膜联蛋白a5以钙依赖性方式结合到碎片中的细胞膜,然后使混合物经历20分钟的第一提纯离心步骤,其后将上清液丢弃并且将含有细胞碎片和结合的膜联蛋白a5的团块加以回收。利用edta将膜联蛋白a5从团块中释放出,接着是20分钟的第二提纯离心步骤和采集上清液中的膜联蛋白a5。然后,在mono q柱上的阴离子交换和利用盐梯度将膜联蛋白a5洗脱的进一步的步骤之前,执行透析步骤将用于膜联蛋白a5的缓冲液改变成trishcl(ph 8.0)。本发明的申请人已意识到kumar的方法中的许多限制和缺点也适合于此方法。
15、2014年,在marder等人,2014,《bmc生物技术(bmc biotechnology)》,14:33中标题为“利用流加培养生产重组人膜联蛋白v”的文章中提出了用于膜联蛋白a5的提纯的另一个方法。marder等人报告了其方法是用以大规模生产重组人膜联蛋白v的流加方法,并且提出了此方法可将用于重组人膜联蛋白a5的工业应用扩展到如体内成像研究的应用。
16、但是,marder等人的方法非常类似于kumar的1991方法和位于华盛顿大学医学中心的实验室医学部的2008方法。marder等人在容纳于2l贮罐中的1l培养物中的重组大肠杆菌宿主细胞中表达膜联蛋白a5。如在marder等人的方法的提纯部分中所描述,在由50mmtris hcl、10mm cacl2(ph 7.2)所组成的匀化/裂解缓冲液(缓冲液a)的存在下重悬所采集的细胞,然后利用超声处理使细胞破裂从而释放出膜联蛋白a5蛋白质。所加入的cacl2导致膜联蛋白a5以钙依赖性方式结合到碎片中的细胞膜,然后使混合物经历30分钟的第一提纯离心步骤,其后丢弃上清液并且将含有细胞碎片的团块和结合的膜联蛋白a5加以回收。利用edta将膜联蛋白a5从团块中释放出,接着是30分钟的第二提纯离心步骤和对上清液中的膜联蛋白a5的采集。然后,在20分钟的第三提纯离心步骤之前,执行透析步骤将用于膜联蛋白a5的缓冲剂改变为tris hcl(ph 8.0),以便去除残余的沉淀物,然后是在mono q柱上的阴离子交换和利用盐梯度将膜联蛋白a5洗脱的进一步的步骤。再一次地,本发明申请人已意识到kumar的方法中的许多限制和缺点也适用于此方法。
17、kumar的1997方法、华盛顿大学医学中心的实验室医学部的2008方法以及marder等人的2014方法清楚地表明本技术领域已开发并确立了用于工业目的之膜联蛋白a5产物的生产和提纯的方法,尽管这些方法的限制和缺点在本技术领域不受欢迎的,但没有现成的替代方法。
18、所有用于膜联蛋白a5回收的这些现有技术方法已显示仅在实验室规模的方法下被证明并且不能应用于扩大或者考虑较大规模的工业标准或可用设备。这些方法具有固有的缺点,从而使它们不适用于大规模生产。特别地,这些现有技术方法的高度限制性特征是方法所要求的两次或(在marder等人的2014方法的情况下)三次高g力离心,其中膜联蛋白a5可替代地是在溶液中或者作为沉淀物。可以合理地估计到,仅将两个离心步骤应用于1000l批次的处理,导致将会花费约12周并且任何装备精良的生物制造设备每日轮班12小时的过程,从而造成无法接受的高生产成本。参见比较实施例1。
19、因此,本发明的一个目的是提供用于膜联蛋白a5的提纯和回收的方法步骤,所述方法步骤对于以工业规模(例如具有约1000l或以上培养体积的重组宿主细胞培养)运行的生产方法而言是高效且具有成本效益的,并且进一步克服现有技术方法所具有的产率损失和低纯度(包括内毒素污染)的缺点。
20、本发明的另一个目的是提供利用本发明的方法生产的医药级膜联蛋白a5产物。
技术实现思路
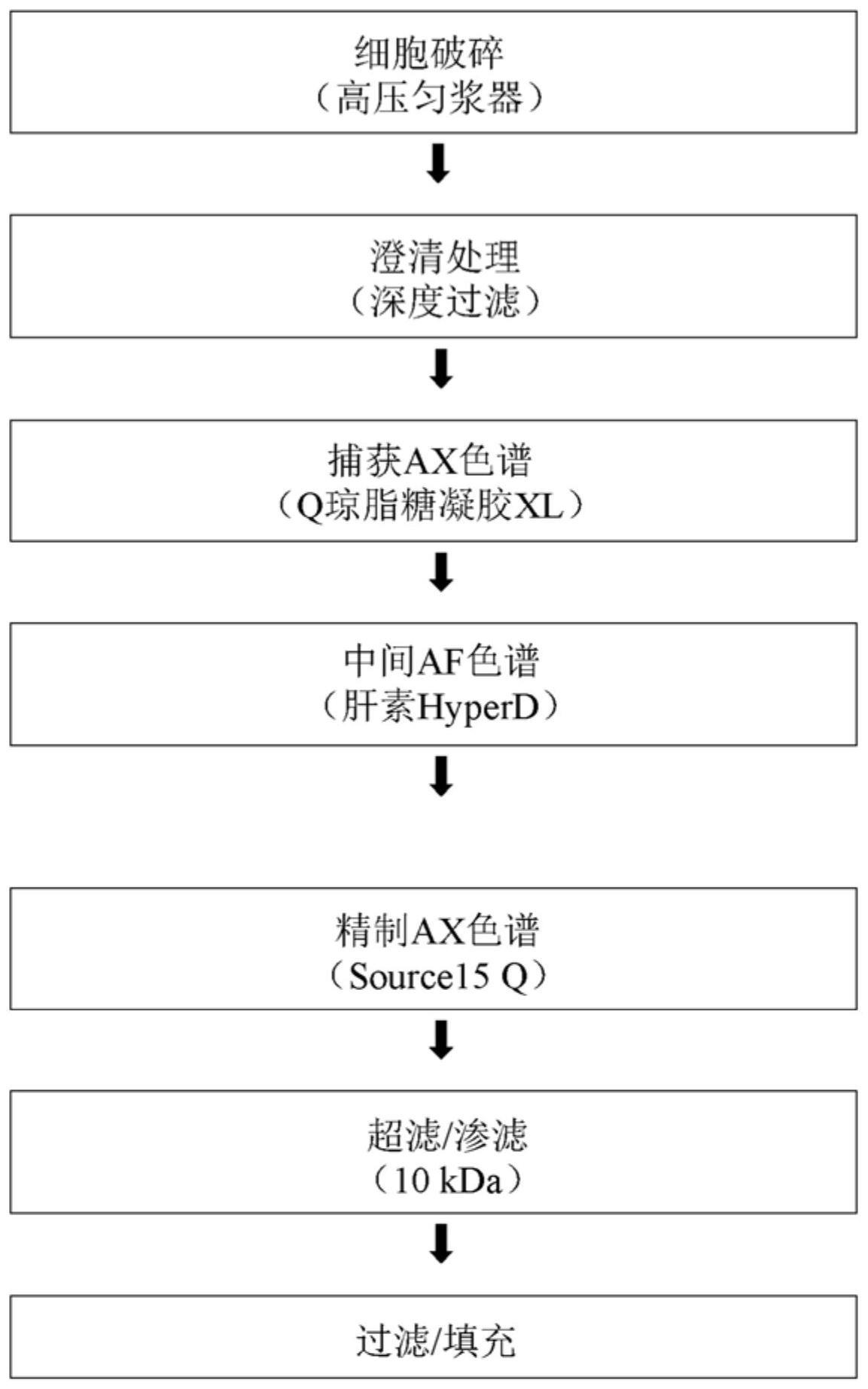
1、本发明申请人已对用于生产包含膜联蛋白a5(anxa5)序列的蛋白质的方法进行了许多开发和改进,并且已设计出若干非常高效的提纯步骤,这些提纯步骤可独立地和/或联合地用于改进现有方法。最优选地,用于生产膜联蛋白a5的方法包含全部开发的方法步骤。
2、特别地,本发明申请人的开发提供了用于通过一种方法回收anxa5蛋白的非常高效的方法的可能性,其中在整个方法中anxa5蛋白优选地停留在溶液中(除暂时结合到色谱树脂时)。也就是说,本发明申请人的开发工作提供了一种可以优选地执行而无需在将anxa5蛋白从宿主细胞中释放出之后采用任何针对anxa5蛋白的提纯离心步骤的用于回收anxa5蛋白的方法。这具有巨大的工业效益,因为用于采集沉淀物的高g力离心对于应用于大规模生物药物生产车间而言是困难的、缓慢的且高成本的。此外,这意味着本发明的方法都可以在不依赖于膜联蛋白a5与膜(例如,宿主细胞膜和/或脂质体)结合能力的情况下而执行,所述结合能力会常常导致膜联蛋白a5与不期望的污染物(如内毒素)共同提纯。
3、因此,所述方法可以应用于以高度时效性的方式对大体积(例如,约100l、500l、1,000l、5,000l、10,000l、50,000l、100,000l或以上)宿主细胞培养物的处理,并且不存在由一个或多个提纯离心步骤所导致的瓶颈。例如,优选的是,所述提纯方法在每1,000l(或少1,000l)被处理宿主细胞培养物中进行5周、4周、3周、2周,最通常地小于1周。此外,出人意料地,所述方法可以用于提供与较慢的、较低效率的现有技术方法相比提高的产率和/或提高的纯度(包括例如改进的内毒素去除)。
4、因此,本发明的第一方面提供从宿主细胞中释放蛋白质的改进步骤。更具体地,提供一种用于从具有细胞壁的内毒素产生宿主细胞中回收和/或提纯包含膜联蛋白a5(anxa5)序列的重组表达细胞内蛋白质的方法,其中所述方法包括从宿主细胞中释放细胞内蛋白质,其特征在于释放细胞内anxa5蛋白的步骤是在包含非离子洗涤剂的匀化缓冲液的存在下执行。优选地,所述非离子洗涤剂是聚山梨醇酯,更优选地选自吐温20和吐温80的聚山梨醇酯,最优选地吐温80。
5、本发明申请人也已发现(如在下面的实施例2中进一步描述),与其中提纯步骤的相继添加导致不断增加的产率损失(因为产物是在各步骤中损失)的常规方法相反,阴离子交换步骤与肝素亲和色谱步骤的组合具有出人意料的益处,即获得由单独肝素亲和色谱步骤所实现的高纯度并具有大幅提高的产率(即,回收率从约30%至40%提高到约70%至90%)。这与通常将会从提纯步骤的组合中所预料的正好相反。
6、因此,本发明的第二方面提供一种用于从包含anxa5蛋白和一种或多种杂质的溶液中回收和/或提纯包含膜联蛋白a5(anxa5)序列的蛋白质的方法,所述方法包括:
7、使包含anxa5蛋白和一种或多种杂质的溶液经历阴离子交换树脂从而执行第一阴离子交换步骤,由此产生包含释放的anxa5蛋白的第一阴离子交换产物;和
8、使第一阴离子交换产物直接地或间接地经历亲和色谱步骤,由此产生包含释放的anxa5蛋白的第一亲和色谱产物。
9、优选地,根据本发明的第二方面的方法,亲和色谱步骤可包括使anxa5蛋白与固定化肝素结合,任选地其中利用钙离子的存在促进结合,并且进而任选地,利用含有钙离子螯合剂(如edta)的洗脱缓冲液将anxa5蛋白从固定化肝素中洗脱出。
10、此外,如在实施例3中所描述,本发明申请人已发现吐温80对于肝素亲和色谱步骤具有尤其有利的作用(与其他非离子洗涤剂相比,包括其他吐温,例如吐温20)。将吐温80例如以大约0.1%(w/v)的含量包含在肝素亲和色谱步骤所使用的缓冲液中,可以有助于在单个峰中洗脱anxa5蛋白、减小压力以及防止沉淀。
11、因此,本发明的第三方面提供一种用于从包含anxa5蛋白和一种或多种杂质的溶液中回收和/或提纯包含膜联蛋白a5(anxa5)序列的蛋白质的方法,所述方法包括在吐温80存在下(优选地在约0.1%w/v吐温80存在下)使包含anxa5蛋白和一种或多种杂质(其可以是或者可以不是如本文中所描述的第一阴离子交换色谱捕获步骤的直接或间接产物)的溶液经历肝素亲和色谱步骤,由此产生包含释放的anxa5蛋白的第一亲和色谱产物。
12、本发明的第四方面是基于本发明申请人对于钙金属离子螯合剂(例如edta)可以对阴离子交换步骤的效能产生负面影响的认识。游离的edta(或其他螯合剂)可以直接地与阴离子交换官能团结合,由此降低结合能力和由阴离子交换步骤所实现的分离。另一方面,试图在阴离子交换步骤之前去除钙金属离子螯合剂是耗时的,因此也增加成本。因此,包括用于缓冲剂置换的慢速透析步骤的现有技术方法是低效率的。此外,在阴离子交换步骤期间,anxa5产物中包含的钙金属离子螯合剂可以是防止anxa5蛋白与杂质(包括内毒素)的钙介导结合的重要成分。因此,导入阻止或减少钙离子螯合剂与阴离子交换树脂结合的添加剂将会是方便且有效的,这将会允许在没有不便之处和与透析相关成本的情况下执行阴离子交换步骤,并且在阴离子交换步骤期间不妨碍钙金属离子螯合剂的有利作用。
13、本发明申请人已意识到这可以通过在阴离子交换之前将一种或多种类型的其他所选择金属离子包含在anxa5蛋白产物中而实现,其中对其他的所选择金属离子进行选择使得钙金属离子螯合剂对所选择金属离子的结合亲和力大于其对阴离子交换树脂的结合亲和力但小于其对钙离子的结合亲和力。适当的其他金属离子的选择将取决于钙离子螯合剂的性质和阴离子交换树脂的性质。例如,在使用edta作为钙离子螯合剂的情况下,mg2+离子通常适合于实现本发明的目的,并且可以在阴离子交换步骤之前被加入到anxa5蛋白产物中。
14、因此,本发明的第四方面提供一种用于从包含anxa5蛋白和钙金属离子螯合剂的组合物中回收和/或提纯包含膜联蛋白a5(anxa5)序列的蛋白质的方法,
15、其特征在于,所述方法包括该组合物经过阴离子交换树脂从而执行阴离子交换步骤,并由此从组合物中回收和/或提纯anxa5蛋白,并且
16、其特征还在于,阴离子交换步骤在其他所选择金属离子的存在下执行,
17、其中对其他的所选择金属离子进行选择使得钙金属离子螯合剂对所选择金属离子的结合亲和力大于其对阴离子交换树脂的结合亲和力但小于其对钙离子的结合亲和力。
18、本发明的第五方面提供一种包含anxa5蛋白的组合物,其中所述组合物是根据本发明第一、第二、第三或第四方面中任一方面的方法的直接或间接产物(或者可直接地或间接地获得)。任选地,所述组合物是药学上可接受的和/或兽医学上可接受的组合物。
19、本发明的第六方面还提供本发明第五方面的组合物在医学中的使用。换句话说,本发明的第六方面提供一种包括将治疗有效量的本发明第五方面的组合物施用于人或动物的方法。
20、可想到的是,本文中所描述的任何方法或组合物可以应用于本文中所描述的任何其他方法或组合物。
21、当在权利要求和/或说明书中结合术语“包括”而使用时,词语“一个”或“一种”的使用可表示“一个”,但它也与“一个或多个”、“至少一个”和“一个或多于一个”的含义一致。
22、此外,当结合以下的描述和附图考虑时,将更好地领会并理解本发明的各方面。然而,应当理解的是,以下的描述虽然说明了本发明的各种方面和实施方式以及其许多具体细节,但是通过说明而给出并非限制。可在不背离本发明的精神的前提下在本发明的范围内作出许多替换、修改、添加和/或重新布置,并且本发明包括所有的这种替换、修改、添加和/或重新布置。
- 还没有人留言评论。精彩留言会获得点赞!