靶向禽流感病毒M2的多肽、流感疫苗及应用的制作方法
靶向禽流感病毒m2的多肽、流感疫苗及应用
技术领域
1.本发明涉及流感疫苗技术领域,尤其涉及靶向禽流感病毒m2的多肽、流感疫苗及应用。
背景技术:
2.禽流感(avian influenza,ai)是由a型流感病毒(avian influenza virus,aiv)的各种亚型引起的禽类疾病综合征,几乎所有的野生及家养禽类都可感染。根据病毒毒力的不同,可将其分为高致病性禽流感(highly pathogenic avian influenza,hpai)、低致病性禽流感(low pathogenic avian influenza,lpai)和非致病性禽流感三大类。根据病毒粒子表面的血凝素(hemagglutinin,ha)和神经氨酸酶(neuraminidase,na,可将其分为17个ha亚型和9个na亚型。其中感染人的主要是h5n1、h9n2和h7n7亚型,感染禽类的主要是h5n1和h9n2亚型,感染猪的主要是h1n1和h3n2亚型。
3.其中,ha是流感病毒表面主要的保护性抗原之一,能诱导机体产生中和抗体,含有多个tb细胞表位,ha2位于ha的c端,含有高度保守的融合序列,基于ha2保守区域的通用疫苗研究一直是一个热点。基质蛋白2(matrix protein 2,m2)是流感病毒表面的跨膜蛋白,由97个氨基酸组成,膜蛋白m2的氨基酸序列高度保守,以m2作为候选抗原制备成流感疫苗具有一定广谱性保护功效,然而其在特异性和产生抗体水平上仍有待改善。
技术实现要素:
4.为此,本发明提供了一类抗原肽,能够靶向禽流感病毒m2的抗原肽、流感疫苗及应用,该类抗原肽能够有效地在体内产生免疫反应,具有较强的抗原性,能够有效地诱导机体产生针对禽流感病毒m2特异性抗体和t细胞增殖应答,从而为机体提供的针对禽流感病毒m2引起相关疾病的免疫保护,提示该多肽可以作为一种抗原用于制备流感疫苗,具有广泛的应用前景。
5.第一方面,本发明实施例公开了一种抗原肽,具有如seq id no.1~5所示的氨基酸序列。
6.第二方面,本发明实施例公开了一种抗原肽的制备方法,所述抗原肽具有如seq id no.1~5所示的氨基酸序列,所述制备方法包括:
7.分别合成第一肽段和第二肽段,所述第一肽段具有如seq id no.7~9任一所示的氨基酸序列,所述第二肽段具有如seq id no.10~24所示任一的氨基酸序列;
8.将所述第一肽段和所述第二肽段经过taec连接反应得到具有全长序列的抗原肽。
9.在本发明实施例中,第一肽段的合成方法包括:将所述第一肽段的序列以fmoc-蛋氨酸作为起点,采用固相合成方法,在偶连试剂的作用下依序连接,合成多肽酰肼衍生物fmoc-第一肽段-nh-nh2。
10.在本发明实施例中,第二肽段的合成方法包括:获得第二肽段的氮端第1个具有boc保护基团的氨基酸,将其与氯甲酸乙酯反应形成活性中间体,然后顺序与第二肽段中的
氨基酸缩合反应,得到合成具有boc保护基团的二肽;将boc保护基团的二肽作为原料,重复上述步骤直至合成具有全长序列的第二肽段,再进行脱除boc反应,得到第二肽段。
11.在本发明实施例中,所述第一肽段具有如seq id no.7所示的氨基酸序列,所述第二肽段具有如seq id no.10~14所示任一的氨基酸序列。
12.在本发明实施例中,所述第一肽段具有如seq id no.8所示的氨基酸序列,所述第二肽段具有如seq id no.15~19所示任一的氨基酸序列。
13.在本发明实施例中,所述第一肽段具有如seq id no.9所示的氨基酸序列,所述第二肽段具有如seq id no.20~24所示任一的氨基酸序列。
14.第三方面,本发明实施例公开了一种嵌合体,其包括第一方面的抗原肽以及与所述抗原肽偶联的载体蛋白。
15.第四方面,本发明实施例公开了一种多肽疫苗,其包括第一方面所述的抗原肽与用于提高抗原肽稳定性和免疫原性的载体,所述载体包括载体蛋白和疫苗佐剂,所述载体蛋白用于与所述抗原体偶联形成嵌合体,所述疫苗佐剂用于对所述嵌合体进行吸附形成稳定的纳米悬浮液。
16.第五方面,本发明实施例公开了第一方面所述的抗原肽、第二方面所述的制备方法制得的抗原肽在制备流感疫苗中的应用。
17.与现有技术相比,本发明至少具有以下有益效果之一:
18.本发明实施例公开了一类抗原肽能够有效地在体内产生免疫反应,具有较强的抗原性,能够有效地诱导机体产生针对禽流感病毒m2特异性抗体和t细胞增殖应答,从而为机体提供的针对禽流感病毒m2引起相关疾病的免疫保护,提示该多肽可以作为一种抗原用于制备流感疫苗,具有广泛的应用前景。
19.进一步将其与载体蛋白偶联成为嵌合体和多肽疫苗,并将对应的抗原肽、嵌合体和多肽疫苗进行体外分析发现,以实施例提供的抗原肽制备的嵌合体,以实施例提供的抗原肽制备的多肽疫苗分别作为供试品具有更强的抗原性。通过体内试验发现,以实施例提供的抗原肽制备的嵌合体,以实施例提供的抗原肽制备的多肽疫苗能够在小鼠体内高水平的特异性抗体,并未其提供进一步病毒攻击的保护,降低死亡率,为其发展成为流感疫苗提供坚实的研究支持。
附图说明
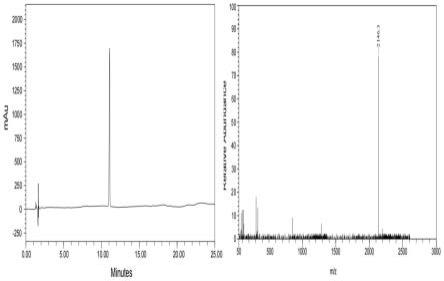
20.图1为本发明实施例1提供的抗原肽的第一肽段的hplc图(左图)和质谱图(右图)。
21.图2为本发明实施例1提供的抗原肽的第二肽段的hplc图(左图)和质谱图(右图)。
22.图3为本发明实施例1提供的抗原肽全长肽段的hplc图(左图)和质谱图(右图)。
23.图4为本发明实施例1提供的抗原肽(泳道1)、嵌合体(泳道2)和多肽疫苗(泳道3),以及对比例1提供的抗原肽(泳道4)、嵌合体(泳道5)和多肽疫苗(泳道6)分别与m2抗体特异性结合的western blotting结果图,35kd左右为结合的目的条带。
24.图5为本发明提供的体内实验中,对照组(a)、抗原肽组实施例1(b)、嵌合体肽组实施例1(c)和多肽疫苗组实施例1(d)小鼠肺脏he染色图。
具体实施方式
25.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。本发明中未详细单独说明的试剂均为常规试剂,均可从商业途径获得;未详细特别说明的方法均为常规实验方法,可从现有技术中获知。
26.需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序,也不对其后的技术特征起到实质的限定作用。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
27.抗原肽
28.本发明发明人创造性地发现了如表1中实施例1~5提供的多肽,能够有效地在体内产生免疫反应,具有较强的抗原性,能够有效地诱导机体产生针对禽流感病毒m2特异性抗体和t细胞增殖应答,从而为机体提供的针对禽流感病毒m2引起相关疾病的免疫保护,提示该多肽可以作为一种抗原用于制备流感疫苗,具有广泛的应用前景。
29.表1
30.实施方式序列实施例1mslltevetptrte we c rcs baadss,如seq id no.1所示实施例2mslltevetptrte we c rcs dpmss,如seq id no.2所示实施例3mslltevetptrte we c rc(ahyl)dss,如seq id no.3所示实施例4mslltevetptrte we c rc(ahyl)d(ahyl)s,如seq id no.4所示实施例5mslltevetptrte we c rcssss,如seq id no.5所示对比例1mslltevetptrte wec rcs dss,如seq id no.6所示
31.本发明拟设计合如表1所示的6种多肽,为合成此两种多肽,本发明实施例公开了一种多肽的合成方法,其方法包括以下步骤:先分别合成第一肽段和第二肽段;再将所述第一肽段和所述第二肽段经过taec连接反应得到具有全长序列的抗原肽。
32.在某些实施方式i中,第一肽段的合成方法包括:将所述第一肽段的序列以fmoc-蛋氨酸作为起点,采用固相合成方法,在偶连试剂((coupling reagents)的作用下依序连接,合成多肽酰肼衍生物fmoc-第一肽段-nh-nh2。
33.在一个具体的第一肽段的合成实施例1中,采用fmoc-e-nh-nh2(fmoc-l-谷氨酸(南京肽业生物科技有限公司,cas:71989-28-1纯度:99%)酰肼化,该酰肼化方法参照“merrifield rb.solid phase tetrapeptide[j].jam chem soc,peptide synthesis.i.the synthesis of a 1963,85(20):2149-2154.”)通过连接剂(linker)与树脂相连的树脂进行fmoc spps肽链合成结束后,保留n-端fmoc基团,用tfa将肽链从树脂上切下,即可得到fmoc-第一肽段-nh-nh2。其中,精氨酸(arg)的胍基(-nh-c(nh2)=nh)(例如pth-精氨酸,117756-28-2,上海阿拉丁生化科技股份有限公司)所带的的侧链保护基可在tfa作用下都可被脱除。在该实施例中,树脂选用wang树脂,将fmoc-e-nh-nh2与树脂连接,
fmoc-e-nh-nh2在树脂上的取代度为0.66mmol/g,经tfa脱除侧链保护基纯化得到fmoc-第一肽段-nh-nh2,如图1可知,其hplc纯度达到95.6%,如图1所示,电喷雾离子质谱检测其分子量为2146.3,说明合成了fmoc-第一肽段-nh-nh2。
[0034]
在某些实施方式ii中,第二肽段的合成方法包括:获得第二肽段的氮端第1个具有boc保护基团的氨基酸,将其与氯甲酸乙酯反应形成活性中间体,然后顺序与第二肽段中的氨基酸缩合反应,得到合成具有boc保护基团的二肽;将boc保护基团的二肽作为原料,重复上述步骤直至合成具有全长序列的第二肽段,再进行脱除boc反应,得到第二肽段。
[0035]
在一个具体的第二肽段的合成实施例中,第二肽段为wecrcsdss,准确称取boc-l-w(色氨酸)为起始原料(北京百灵威科技有限公司,纯度99%,cas:13139-14-5),取261mg boc-l-w,溶于2ml乙醚中,加入108mg氯甲酸乙酯,之后加入151mg三乙胺,溶液变浑浊,3h后加入115mg谷氨酸,过夜,氮气保护,后,乙酸乙酯萃取多次,干燥后,进行去除boc反应(硅胶催化的选择性去除n-boc保护基[j]高等学校化学学报,2007年,第12期,issn:0251-079),即可得到第二肽段。如图2所示,第一肽段的hplc图可知其纯度达到93.8%,如图2所示,电喷雾离子质谱检测其分子量为1072.1,说明第二肽段合成成功。
[0036]
在某些实施方式iii中,采用taec技术(jiang l,davison a,tennant q et al.synthesis and application of a novel coupling reagent,ethyl1-hydroxy-lh-1,2,3triazole-4-carboxylate[j].tetrahedron,1998,54(47):14233~14254),可将多肽酞脐衍生物fmoc-第一肽段-nh-nh2有效地转化为相应的活性酯fmoc-第一肽段-oct,之后再与第二肽段相连而得到产物,脱除fmoc基团(robertson n,jiang l,ramage r.racemisation studies of a novel coupling reagent for solid phase peptide synthesis[j].tetrahedron,1999,55(9):2713~2720)后,即可得到全长序列的抗原肽。
[0037]
在一个实施例1提供的抗原肽合成过程中,fmoc-mslltevetptrte-nh-nh2与wecrcsdss反应得到fmoc-mslltevetptrtewecrcsdss,再脱除fmoc,得到的全长抗原肽,如图3所示,经过hplc图可知其纯度达到92.4%,如图3所示,电喷雾离子质谱检测其分子量为2660.8。
[0038]
在某些实施方式中,对第一肽段、第二肽段或全长抗原肽进行hplc检测、或者对全长抗原肽进行纯化均采用hplc检测或制备级hplc进行制备,包括:以waters-2487型色谱柱(美国waters公司)进行纯化,以乙腈/水(含0.1%tfa)为分离体系,乙腈18%-38%,流速2ml/min,40min;然后浓缩,除去乙腈,冻干,得白色粉末,即为抗原肽纯品。取纯化后样品经hplc分析柱(acclaim pepmap c18)分析,以乙腈,水(含0.1%tfa)为分析体系,乙腈15%~35%,流速1ml/min。
[0039]
在某些实施方式中,第一肽段为mslltevetptrte,如seq id no.7所示,第二肽段选自wecrc s-baad-ss(如seq id no.10所示)、wecrc s-dpm-ss(如seq id no.11所示)、wecrc ahyldss(如seq id no.12所示)、wecrc ahyl-d ahyls(如seq id no.13所示)和wecrcssss(如seq id no.14所示)。如此,采用上述实施方式i~iii,其合成如对比例1和实施例1~5所示的抗原肽的收率为70~85%(收率为合成实际所得产物量与理论产物量的百分比)。
[0040]
在某些实施方式中,第一肽段为mslltevetp,如seq id no.8所示,第二肽段选自trtew ecrcs-baad-ss(如seq id no.15所示)、trtew ecrcs-dpm-ss(如seq id no.16所
示)、trtew ecrc-(a hyl)-dss(如seq id no.17所示)、trtew ecrc-(ahyl)-d-(ahyl)-s(如seq id no.18所示)和trtewecrcssss(如seq id no.19所示)。如此,采用上述实施方式i~iii,其合成如对比例1和实施例1~5所示的抗原肽的收率为65~70%。
[0041]
在某些对比实施方式中,第一肽段为mslltevetptrte,如seq id no.9所示,第二肽段选自wecrc s-baad-ss(如seq id no.20所示)、wecrc s-dpm-ss(如seq id no.21所示)、wecrc-(ahyl)-dss(如seq id no.22所示)、wecrc-(ahyl)-d-(ahyl)-s(如seq id no.23所示)和wecrcssss(如seq id no.24所示),第一肽段采用实施方式ii进行合成,第二肽段采用实施方式i合成,其合成如对比例1和实施例1~5所示的抗原肽的收率为35~55%。
[0042]
体外性能分析
[0043]
1、多肽疫苗构建
[0044]
为验证上述实施例制得的抗原肽的抗原性,本部分将其作为抗原进行相关抗原性分析,并将其制备成疫苗进行相关抗原性分析。
[0045]
为此,本发明实施例公开了一种多肽疫苗,其包含如实施例1~5任一提供的抗原肽,用于提高抗原肽稳定性和免疫原性的载体。在一些实施例中,该载体为载体蛋白,如钥孔血蓝蛋白(klh)偶联,以改变其空间构象,提高其稳定性和免疫原性,将多肽偶联至klh蛋白上,形成多肽-载体嵌合体,此种这种嵌合体免疫机体后,易被单核巨噬细胞等抗原呈递细胞识别,并迅速处理后将抗原呈递给t\b淋巴细胞,从而促进了机体对抗原肽的免疫反应。在一些实施例中,该载体为疫苗佐剂,例如铝佐剂,钙盐佐剂,不仅能够提供抗原肽的稳定性,还能进一步提高其免疫效果。
[0046]
在某些实施方式中,该多肽疫苗的制备方法包括:先将如实施例1~5任一提供的抗原肽与载体蛋白(如klh蛋白)偶联以形成嵌合体,再用佐剂对次此种嵌合体进行吸附或者包埋以形成多肽疫苗。以对比例1提供的抗原肽制备多肽疫苗的制备过程与此相同。
[0047]
在一个实施例中,该多肽疫苗的制备方法包括:称取20g mbs(百奥莱博,gs4329)溶解于1.6ml dmf中,另称取200mg klh(磷酸盐冻干粉,美国biosyn)溶解于6m1水中;把mbs溶液加入至klh溶液中,搅拌反应30min,将反应液过g-25葡聚糖凝胶层析柱,用ph=6.5的磷酸二氢纳进行洗脱,收集洗脱液16ml,加入20m实施例1提供的抗原肽,用三乙胺调节反应液ph至7.3,搅拌反应约5h,反应液,浓缩,冷冻干燥,即可得到抗原肽-klh的嵌合体,对该抗原肽和嵌合体进行蛋白凝胶电泳分析。以实施例2~5和对比例1提供的抗原肽制备的嵌合体参照此方法进行。
[0048]
在一个实施例中,该多肽疫苗的制备方法包括:将上述以实施例1供的抗原肽制备的嵌合体,混入纳米磷酸钙溶液中,配制浓度为100μg/ml,于4℃震荡混合吸附3h,即可制得多肽疫苗;其中,该纳米磷酸该溶液的制备包括:将浓度均为10mm cac12溶液和na2hpo4溶液等体积混合反应3h后,加入500mm柠檬酸钠50μl,加入羧甲基纤维素钠使得其终浓度为0.5mm,通过高压均质机15000psi压力进行高压均质,冰浴中循环6次,得到粒径218.3
±
35.8nm,zeta电位绝对值43
±
3mv的纳米磷酸钙混悬液稳定体系。以实施例2~5和对比例1提供的抗原肽制备的多肽疫苗参照此方法进行。
[0049]
将实施例1~5和对比例1提供的抗原肽,以实施例1~5和对比例1提供的抗原肽制备的嵌合体,以及以实施例1~5和对比例1提供的抗原肽制备的多肽疫苗分别作为供试品
进行以下实验。其中,抗原肽和嵌合体均用ph=6.8的pbs配制成溶液,浓度均为100μg/ml。
[0050]
2、抗原性分析
[0051]
本实验例中,采用western blotting分别对实施例1~5和对比例1提供的由偶联klh蛋白的抗原肽复合体以及抗原肽进行抗原性分析,并以偶联蛋白klh蛋白作为对照组。具体步骤包括:
[0052]
1)将上述各供试品及预染蛋白marker sds-page电泳结束后,准备与page分离胶大小相同的尼龙膜于甲醇中浸泡5min后,打开电转移盒,加入转移缓冲液,于电转移盒中将电泳得到的凝胶置于铺设有滤纸的海绵垫上,再将尼龙膜置于凝胶的胶面上,放置过程中避免产生气泡,将尼龙膜一侧连接正极,凝胶一侧连接负极,接通电泳恒压100v电转移2h;
[0053]
2)电转结束后,将尼龙膜置于平皿中,加入封闭液,37℃摇床中50r/min慢摇封闭1h,弃封闭液,用pbst洗膜1次;
[0054]
3)将尼龙膜放入一塑料袋中,每平方厘米膜加入约0.5ml 1:500稀释的禽流感病毒h5n1-m2蛋白抗体(上海卡努生物科技有限公司,作为一抗),去掉所有气泡,封口,平放入37℃摇床中50r/min慢摇1h;
[0055]
4)将尼龙膜从一抗中取出,用tbst洗3次,10min/次,同时回收一抗,可反复用pbst洗涤3~5次;
[0056]
5)将尼龙膜放于一新塑料袋中,加入0.5ml 1:500稀释的辣根过氧化物酶(hrp)偶联的羊抗兔igg(华美生物ie0030,作为二抗),封闭塑料袋,平放入37℃摇床中50r/min慢摇1h;
[0057]
6)将膜从二抗血清中取出,用tbst洗3次,10min/次,同时回收二抗,可反复用pbst洗涤3~5次;
[0058]
7)临时配制tmb显色液,洗好的膜放入显色液中室温显色,显色至一定的深度时,立即用扫描仪扫描图片记录实验结果。
[0059]
为此通过tanon凝胶成像分析系统分析条带灰度值和面积大小,以此判别与m2抗体结合能力,将其统计于表2中,表2中,*表示每列数据与对比例1相比具有显著性差异标记(p《0.05),表2中“-”表示无目的条带检出。
[0060]
结果2和图4所示,实施例1~5提供的抗原肽与m2抗体有特异性结合,但是其杂交的目的条带信号较弱,而以实施例1~5提供的抗原肽制备的嵌合体,以及以实施例1~5提供的抗原肽制备的多肽疫苗分别作为供试品能够提供较强的杂交的目的条带信号,由此说明,以实施例1~5提供的抗原肽制备的嵌合体,以实施例1~5提供的抗原肽制备的多肽疫苗分别作为供试品具有更强的抗原性。而对比例1提供的抗原肽无检测杂交的目的条带,以对比例1提供的抗原肽制备的嵌合体和多肽疫苗分别作为供试品其检测的杂交的目的条带信号较弱。
[0061]
表2
[0062]
供试品抗原肽嵌合体多肽疫苗实施例10.15
±
0.030.35
±
0.08*0.39
±
0.07*实施例20.19
±
0.050.42
±
0.12*0.46
±
0.11*实施例30.17
±
0.0040.46
±
0.09*0.51
±
0.08*实施例40.22
±
0.060.51
±
0.11*0.54
±
0.13*
实施例50.17
±
0.060.44
±
0.07*0.46
±
0.06*对比例1-0.09
±
0.020.09
±
0.02
[0063]
4、纯化表达蛋白交叉抗原性检测
[0064]
本实验例中,将上述各供试品用酶标板包被缓冲液稀释2~10倍,包被酶标板,分别用禽流感病毒h5n1-m2蛋白抗体(上海卡努生物科技有限公司)从1:100倍开始2倍倍比稀释进行方阵滴定,加入辣根过氧化物酶(hrp)偶联的羊抗兔igg(华美生物ie0030,作为二抗),tmb底物显色,确定抗原最佳工作浓度。然后用确定的最佳抗原浓度包被酶标板,依次加入倍比稀释的a型禽流感病毒h1n1 m2蛋白抗体(北京百奥莱博科技有限公司)、a型禽流感病毒h7n9 m1蛋白抗体(上海沪震实业有限公司)、a型禽流感病毒h5n1 m2蛋白抗体(上海冠导生物工程有限公司)、禽流感b病毒核蛋白抗体(上海振誉生物科技有限公司),与抗原反应,tmb底物显色10min,加入终止液终止反应,用酶标仪测定450nm处od值,记录各孔od值,根据od值检测各供试品与不同亚型禽流感病毒抗体的交叉反应性。
[0065]
表3抗原肽于1:100\1:200\1:400稀释比例下的elisa反应od450值
[0066][0067][0068]
表3示出了以实施例1~5和对比例1分别提供的抗原肽作为供试品,分别于1:100\1:200\1:400稀释比例下与h1n1 m2抗体、h5n1 m2抗体、h7n9 m1抗体和b型抗体进行elisa反应的od450值。由表3可知,实施例1~5提供的抗原肽于1:100\1:200\1:400稀释比例下的od450值均显著高于对比例1,说明实施例1~5提供的抗原肽对h1n1 m2抗体、h5n1 m2抗体、h7n9 m1抗体和b型抗体四种抗体具有更强的免疫亲和力,而进一步对比发现,实施例1~3提供的抗原肽对h1n1 m2抗体的免疫亲和性更强,而实施例4和5提供的抗原肽对h5n1 m2抗体的免疫亲和性更强。
[0069]
表4嵌合体于1:100\1:200\1:400稀释比例下的elisa反应od450值
[0070]
供试品h1n1 m2抗体h5n1 m2抗体h7n9 m1抗体b型抗体实施例10.682\0.322\0.1630.425\0.267\0.1350.131\0.104\0.0760.149\0.088\0.053实施例20.768\0.439\0.3480.437\0.315\0.1820.143\0.085\0.0350.125\0.078\0.038实施例30.869\0.548\0.4820.726\0.434\0.2960.161\0.095\0.0680.151\0.098\0.076实施例40.314\0.257\0.1360.872\0.542\0.3800.176\0.097\0.0780.142\0.081\0.051实施例50.325\0.269\0.1610.745\0.532\0.3670.173\0.108\0.0750.129\0.083\0.038对比例10.169\0.084\0.030.206\0.131\0.0890.003\0.005\0.0010.001\0.002\0.001
[0071]
表4示出了以实施例1~5和对比例1分别提供的嵌合体作为供试品,分别于1:100\1:200\1:400稀释比例下与h1n1 m2抗体、h5n1 m2抗体、h7n9 m1抗体和b型抗体进行elisa反应的od450值。由表4可知,实施例1~5提供的嵌合体于1:100\1:200\1:400稀释比例下的od450值均显著高于对比例1,说明实施例1~5提供的嵌合体对h1n1 m2抗体、h5n1 m2抗体、
h7n9 m1抗体和b型抗体四种抗体具有更强的免疫亲和力,而进一步对比发现,实施例1~3提供的嵌合体对h1n1 m2抗体的免疫亲和性更强,而实施例4和5提供的嵌合体对h5n1 m2抗体的免疫亲和性更强。
[0072]
表5多肽疫苗于1:100\1:200\1:400稀释比例下的elisa反应od450值
[0073][0074][0075]
表5示出了以实施例1~5和对比例1分别提供的多肽疫苗作为供试品,分别于1:100\1:200\1:400稀释比例下与h1n1 m2抗体、h5n1 m2抗体、h7n9 m1抗体和b型抗体进行elisa反应的od450值。由表4可知,实施例1~5提供的多肽疫苗于1:100\1:200\1:400稀释比例下的od450值均显著高于对比例1,说明实施例1~5提供的多肽疫苗对h1n1 m2抗体、h5n1 m2抗体、h7n9 m1抗体和b型抗体四种抗体具有更强的免疫亲和力,而进一步对比发现,实施例1~3提供的多肽疫苗对h1n1 m2抗体的免疫亲和性更强,而实施例4和5提供的多肽疫苗对h5n1 m2抗体的免疫亲和性更强。
[0076]
综合表3~5可知,对于同一稀释比例下,实施例1~5提供的嵌合体作为供试品,其分别对于h1n1 m2抗体、h5n1 m2抗体、h7n9 m1抗体和b型抗体四种抗体的od450值均高于其提供的抗原肽,由此说明嵌合体由于偶联了载体蛋白,其免疫性得以增强。另外,无论抗原肽、嵌合体还是多肽疫苗,其于同一稀释比例下,施例1~3提供的多肽疫苗对h1n1 m2抗体的免疫亲和性更强,而实施例4和5提供的多肽疫苗对h5n1 m2抗体的免疫亲和性更强,而实施例1~5均对h7n9 m1抗体和b型抗体的免疫亲和力较弱,由此说明,本发明实施例1~5提供的抗原肽、嵌合体和多肽疫苗具有一定的禽流感病毒免疫特异性。
[0077]
体内实验
[0078]
1、供试品
[0079]
将实施例1~5和对比例1提供的抗原肽,以实施例1~5和对比例1提供的抗原肽制备的嵌合体,以及以实施例1~5和对比例1提供的抗原肽制备的多肽疫苗分别作为供试品进行以下实验。其中,抗原肽和嵌合体均用ph=6.8的pbs配制成溶液,浓度均为10μg/ml。
[0080]
2、免疫小鼠
[0081]
6-8周龄的c57bl/6小鼠随机分为四组,每组20只,四组分别为抗原肽组、嵌合体组、多肽疫苗组和对照组。抗原肽组免疫0.1ml/只小鼠10μg/ml抗原肽2次,肌肉注射,第1次免疫后间隔14天后进行第2次免疫;嵌合体组免疫0.1ml/只小鼠10μg/ml嵌合体2次,肌肉注射,第1次免疫后间隔14天后进行第2次免疫;多肽疫苗组免疫0.1ml/只小鼠10μg/ml多肽疫苗2次,肌肉注射,第1次免疫后间隔14天后进行第2次免疫;对照组免疫0.1ml/只小鼠10μg/ml ph=6.8的pbs溶液2次,肌肉注射,第1次免疫后间隔14天后进行第2次免疫。
[0082]
3、血清特异性抗体水平检测实验
[0083]
用间接elisa法各组小鼠血清中的特异性抗体水平,血清收集方法:为第2免疫后1
周眼眶采血处死小鼠,分离血清,室温静置2h,血液完全凝固后,5000rpm离心5min,取血清分装后置于-80℃保存备用。该方法包括:取各组对应的实施例1~5和对比例1提供的10μg/ml的抗原肽加入96孔酶标板中,每孔100μl,4℃包被过夜,弃去包被液,用pbst洗涤3次;包被完成后,再向每孔加入200μl封闭液(含1%bsa的pbst),37℃孵育2h,弃去封闭液,用pbst洗涤3次,拍干;用封闭液按1:500稀释待检血清并加入96孔酶标板(每孔100μl),37℃孵育2h,弃去孔内液体,用pbst洗涤3次,拍干;加入1:10000稀释的hrp标记的山羊抗鼠igg(每孔100μl)37℃孵育1h,用pbst洗涤3次,拍干。加入tmb显色液(每孔100μl),室温避光反应5min,每孔加入100μl 2m h2so4终止液,酶标仪读取450nm波长吸光光度值。
[0084]
4、t细胞免疫反应检测
[0085]
本实验例中,采用“小鼠来源调节性t细胞的体外扩增培养及鉴定[j]中国医师杂志,2019,第10期,1008~1372”方法分离下小鼠脾脏中t细胞,采用elispot方法检测该t细胞分别的ifn-γ水平。具体的elispot方法步骤包括:采用mouse-ifn-y elispot kit(el485,bio-techne)试剂盒进行,先向96孔板中每孔加入15μl的包被缓冲液预湿10min后,去除包被缓冲液,每孔加入100μl用包被缓冲液按1:250稀释的包被抗体,于4℃包被过夜;包被完成后,pbs洗板3次,每孔加入200μl封闭缓冲液于37℃含5%co2培养箱中封闭1h;向每孔加入100μl 107个/ml分离的各组小鼠脾脏t细胞悬液分为阳性组、对照组和实验组;阳性组每孔加入10μl阳性刺激物pma(货号2030421,达优),阴性对照组每孔加入10μl rpmi1640完全培养基,实验组每孔加入10μl实施例1~5和对比例1分别提供的抗原肽10μg/ml;所有样品和刺激物加完后,放入37℃含5%co2培养箱培养40h;倾倒孔内细胞及培养基,加4℃双蒸水,-20℃放置3min后再置于4℃7min,以低渗裂解细胞;去除孔板内液体,洗板5~7次,拍干;将稀释好的生物素标记的抗体工作液加入各实验孔,100μl/孔,37℃孵育1h,洗板,拍干;向实验组各孔中加入100μl稀释好的酶标亲和素工作液加入37℃孵育1h,洗板,拍干;加入100μlaec显色工作液至实验组各孔,室温避光静置15-40min;终止显色,elispot板斑点计数。
[0086]
5、攻毒实验
[0087]
第2次免疫两周后,取每组10只小鼠用2.4
×
105eid
50
/25μl的h1n1毒株biovector ntcc中国质粒载体菌种细胞基因保藏中心)进行滴鼻攻毒,攻毒7天后每组处死2只小鼠取肺脏,用于病毒滴度测定和病理切片制作,剩余小鼠连续观察两周,每天称量体重,记录发病、死亡情况。
[0088]
其中,病毒滴度检测方法包括:人道处死小鼠,取肺脏,加入1ml含青霉素1000u和链霉素1000u的pbs研磨至匀浆状,于4℃、12000rpm离心smin,取上清液用含青霉素1000u和链霉素1000u的pbs稀释10倍,每个稀释度接种3枚10日龄spf鸡胚,37℃孵化72h,然后通过血凝试验判断尿囊液中是否含有病毒,利用reed-muench法计算肺脏中病毒滴度。各组小鼠肺脏病理切片,进行he染色和观察。
[0089]
二、结果
[0090]
本实验例中,采用实施例1~5和对比例1分别提供的抗原肽分别作为抗原包被、间接elisa法检测检测,上述抗原肽组、嵌合体组、多肽疫苗组和对照组免疫后小鼠血清中的特异性抗体水平,以od450表征,结果如表6所示。表6中,od450为与pbsod450值的差值,“-”表示差值的绝对值低于0.05,表示无检出抗体水平;表6中,横向项表示如seq id no.1~6
所示的抗原肽包被孔板进行检测,竖向表示实施例1~5和对比例1提供的如seq id no.1~6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组小鼠血清中抗体水平项,“*”表示同一组内与对比例1提供的如seq id no.6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组小鼠血清中抗体水平比较具有显著性差异(p《0.05),“#”表示不同组之间对应的供试品之间比较具有显著性差异(p《0.05,例如以实施例1提供的嵌合体和多肽疫苗分别作为供试品免疫得到的小鼠血清与以实施例1提供的抗原肽免疫的的小鼠血清中的抗体水平进行比较)。
[0091]
表6 od450
[0092][0093][0094]
结果如表6所示,分别于抗原肽组、嵌合体组和多肽疫苗组内,小鼠血清中得到的抗体能够分别具有正对如no.1~5抗原的特异性抗体,以及均具有针对no.6抗原肽的抗体,而经过no.6为基础进行的免疫得到的小鼠血清中的抗体能够具有no.1~6的免疫广谱性,但是抗体水平显著低于实施例1~5提供的小鼠血清,由此说明,采用本发明实施例1~5提供的抗原肽、嵌合体或多肽疫苗免疫小鼠,产生的小鼠血清中的抗体不仅具有特异性,还能对一般性的no.6所示的m2抗原肽具有一定的亲和力。
[0095]
本实验例中,分离抗原肽组、嵌合体组、多肽疫苗组和对照组免疫后小鼠脾脏t细胞,elispot方法检测该t细胞分别的ifn-γ水平,结果以每106个t细胞形成的斑点数表征。表6中,横向项表示实施例1~5和对比例1提供的如seq id no.1~6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗作为供试品,竖向相表示实施例1~5和对比例1提供的如seq id no.1~6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组小鼠脾脏t细胞ifn-γ水平,“*”表示同一组内与对比例1提供的如seq id no.6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组小鼠脾脏t细胞ifn-γ水平比较具有显著性差异(p
《0.05),“#”表示所有组之间对应的供试品与对照组比较具有显著性差异(p《0.05)。
[0096]
表7每106个t细胞形成的斑点数
[0097][0098]
结果如表6所示,分别于抗原肽组、嵌合体组和多肽疫苗组内,小鼠t细胞ifn-γ水平均显著高于对比例1提供的如seq id no.6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组小鼠脾脏t细胞ifn-γ水平,且各组小鼠t细胞ifn-γ水平均显著高于对照组。由此说明,采用本发明实施例1~5提供的抗原肽、嵌合体或多肽疫苗免疫小鼠,能够经由外源途径的mhc类分子共同提呈抗原,并活化t细胞,诱导机体产生抗体免疫反应和细胞免疫反应。
[0099]
本实验例中,采用h1n1病毒攻击抗原肽组、嵌合体组、多肽疫苗组和对照组小鼠,功能后7天的肺脏中病毒滴度如表8所示。表8中,横向项表示病毒滴度和攻毒后10天小鼠死亡率,“*”表示同一组内与对比例1提供的如seq id no.6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组肺脏中病毒滴度比较具有显著性差异(p《0.05),“#”表示所有组之间对应的供试品与对照组比较具有显著性差异(p《0.05)。
[0100]
结果如表8中,分别于抗原肽组、嵌合体组和多肽疫苗组内,小鼠肺脏中病毒滴度水平和死亡率均显著低于对比例1提供的如seq id no.6所示的抗原肽、以及以此制备的嵌合体和多肽疫苗进行免疫各组小鼠肺脏中病毒滴度水平和死亡率,且各组小鼠肺脏中病毒滴度水平和死亡率均显著低于对照组。
[0101]
如图5所示,攻毒10天攻毒后,小鼠肺脏he染色切片并进行病理组织学观察,在sc09(h1n1)攻毒组中,对照组小鼠肺脏结构被中度破坏,肺间隔显著增宽,肺间隔血管扩张充血并伴有大量炎性细胞浸润,而抗原肽组、嵌合体组和多肽疫苗组的肺脏结构基本完整,而多肽疫苗组小鼠肺脏结果最为完整,无炎症细胞和充血发生。
[0102]
由此说明,采用本发明实施例1~5提供的抗原肽、嵌合体或多肽疫苗能够给予免疫给予小鼠禽流感病毒的攻击保护,并减轻对肺脏的病理损伤。
[0103]
表8
[0104]
[0105][0106]
综上所述,本发明实施例公开了一类抗原肽能够有效地在体内产生免疫反应,具有较强的抗原性,能够有效地诱导机体产生针对禽流感病毒m2特异性抗体和t细胞增殖应答,从而为机体提供的针对禽流感病毒m2引起相关疾病的免疫保护,提示该多肽可以作为一种抗原用于制备流感疫苗,具有广泛的应用前景。
[0107]
进一步将其与载体蛋白偶联成为嵌合体和多肽疫苗,并将对应的抗原肽、嵌合体和多肽疫苗进行体外分析发现,以实施例1~5提供的抗原肽制备的嵌合体,以实施例1~5提供的抗原肽制备的多肽疫苗分别作为供试品具有更强的抗原性。通过体内试验发现,以实施例1~5提供的抗原肽制备的嵌合体,以实施例1~5提供的抗原肽制备的多肽疫苗能够在小鼠体内高水平的特异性抗体,并未其提供进一步病毒攻击的保护,降低死亡率,为其发展成为流感疫苗提供坚实的研究支持。
[0108]
较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1