一种无金属光催化氧化制备芳香酸的方法
1.本发明属于有机合成技术领域,具体涉及一种无金属光催化氧化制备芳香酸的方法。
背景技术:
2.芳香酸是一种基础的化工原料,被广泛应用于药物、食品、颜料、增塑剂和防腐剂等有机合成领域。苯甲酸是最简单的芳香酸类化合物之一,目前我国年产量可达49万吨,市场需求量大。因此,利用廉价易得的可大宗量获得的原料,寻求绿色经济的催化体系制备芳香酸,在工业化生产上存在着重大经济环保价值。
3.目前芳香酸的制备有多种合成途径,如芳烃、苄醇、芳醛、芳烯或芳炔的氧化,酰氯、氰基的水解等。通常地,由廉价易得甲基芳烃出发直接氧化制备芳香酸,最符合工业化生产的需求。目前最常见的苯甲酸工业生产方法有甲苯的液相空气氧化法,邻苯二甲酸酐脱羧法、甲苯氯化水解等,但该工艺普遍存在着能耗较大,催化剂难以分离,设备腐蚀污染严重等问题。例如:传统的烃类氧化方法主要是采用高锰酸钾、硝酸等强氧化剂,这样的结果将导致产生大量含无机盐的废水及固废,增加了工业生产成本及对环境的破坏。而甲苯液相氧化通常伴有高温高压的操作条件,能耗较高,且大部分的催化体系以醋酸作为反应溶剂,对设备腐蚀性强。化学工作者们对苄位氧化体系进行了不断的优化,例如2016年,robert wolf等人使用核黄素四乙酸脂和非血红素络合物的混合物有效催化烷基苯氧化为酮和羧酸类衍生物(angew.chem.int.ed.2016,55,427-430)。此外,陆文军等人以过硫酸钾为氧化剂,在吡啶的催化下有效地实现了甲基芳烃氧化生成苯甲酸及其衍生物,但该体系需要使用过量的化学氧化剂,且反应温度较高(synthesis2017,49,4007-4016)。govindasamysekar等人开发了一种联萘稳定的pt纳米离子催化剂,实现了甲基芳烃的选择性氧化,该催化剂重复使用活性无明显降低,但该催化剂结构复杂,生成成本较高(appl.catal.b.environ.2019,250,325-336)。虽然取得了一系列的进展,但依旧难以解决重金属参与、催化剂昂贵,需要化学当量的氧化剂等一系列问题,随着全球环境的不断恶化,对绿色催化氧化的需求日益增高。
4.光催化氧化反应是一种新兴的绿色氧化工艺,该法反应条件温和,在常温常压下便可进行,反应操作安全环保。光诱导反应的引发离不开光催化剂。目前常见的光催化剂主要有钌、钯、铷、铱等过渡金属,tio2、zno、v2o5等无机金属氧化物,金属修饰的各种负载催化剂以及各种有机染料等。但现有的传统光催化剂一般都价格昂贵、成本较高、易造成重金属残留,不利于工业化生产。
5.因此,寻求一种无金属参与,且光催化剂廉价易得的氧化体系显得尤为重要。
技术实现要素:
6.针对上述问题,本发明的目的在于提供一种操作简单、催化剂廉价易得、方法绿色的无金属光催化氧化制备芳香酸的方法。
7.为达到上述目的,提出以下技术方案:
8.一种无金属光催化氧化制备芳香酸的方法,其特征在于,包括如下步骤:将如式(ⅰ)所示的化合物、光催化剂、添加剂加入到溶剂中,曝露在空气或氧气中,在光源照射下于25-60℃搅拌反应,待反应结束后,反应液经后处理得到如式(ⅱ)所示的芳香酸化合物,其反应方程式如下:
[0009][0010]
其中,ar为苯环、呋喃基、噻吩基、萘基或二苯酮,ar基团上的h被r1单取代,取代基r1为烷基、取代羟基、醛基或取代烷基,ar基团上的h被r2取代或不取代,取代时r2为单取代或多取代,n=1~2,n取整数,取代基r2为烷基、烷氧基、卤素、三氟甲基、芳基、取代芳基或取代酚羟基;
[0011]
光催化剂的结构如式(iii)所示,式中,苯环上的h被取代基r取代或不取代,取代时,r为卤素、甲基、烷氧基、三氟甲氧基、硝基或乙酰基,
[0012][0013]
优选地,取代基r1为-ch3、-ch2oh、-cho、-ch2cl或-ch2och3,取代基r2为甲基、甲氧基、氯、氟、三氟甲基、苯环、三氟甲基苯基或乙酰基取代酚羟基。
[0014]
优选地,所述的溶剂为乙腈、二氯甲烷、1,2-二氯乙烷、乙酸乙酯或丙酮。
[0015]
优选地,所述的添加剂为盐酸、硫酸、溴化氢氯化钠、氯化钾、四丁基氯化铵和三氟乙酸中的一种或多种的混合物。
[0016]
优选地,所述的光源为蓝光、白光或紫光,优选为紫光。
[0017]
优选地,反应温度为50-60℃。
[0018]
优选地,如式(ⅰ)所示的化合物、催化剂和添加剂的物质的量比为1:0.1-0.5:0.2-1,优选为1:0.1-0.2:0.4-0.5。
[0019]
优选地,反应时间为6-48小时。
[0020]
优选地,后处理的过程为:反应液就加入饱和食盐水淬灭,再用乙酸乙酯萃取,分离有机层,用无水硫酸钠干燥并减压浓缩,最后用石油醚/乙酸乙酯或二氯甲烷/甲醇在硅胶柱上纯化。
[0021]
本发明通过在光照条件下,以氮杂环作为光催化剂,革除了使用稀有金属等昂贵催化剂存在的问题,降低了生产成本。其反应操作简单,反应条件温和,在常温常压下,使用空气中的氧气作为氧化剂,进一步节约了成本,适于工业化推广。此外,本发明还利用该光催化剂体系实现了阿司匹林和联苯利平的合成,进一步证明该体系在合成天然产物,药物分子等领域具有广泛的应用潜力。
具体实施方式
[0022]
下面结合实施例对本发明做进一步地说明,但本发明的保护范围并不仅限于此。
[0023]
实施例1苯甲酸
[0024][0025]
在20ml的反应瓶中,加入化合物甲苯(46mg,0.5mmol),6-溴苯并噻唑(21mg,0.1mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,30℃下搅拌反应24小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
a)所示的目标产物苯甲酸,收率为76%,hplc纯度为98.6%。1h nmr(400mhz,dmso-d6)δ12.98(brs,1h),7.99
–
7.92(m,2h),7.62(tt,1h),7.50(t,j=7.6hz,2h).;
13
c nmr(100mhz,dmso-d6)δ167.78,133.33,131.19,129.72,129.02.
[0026]
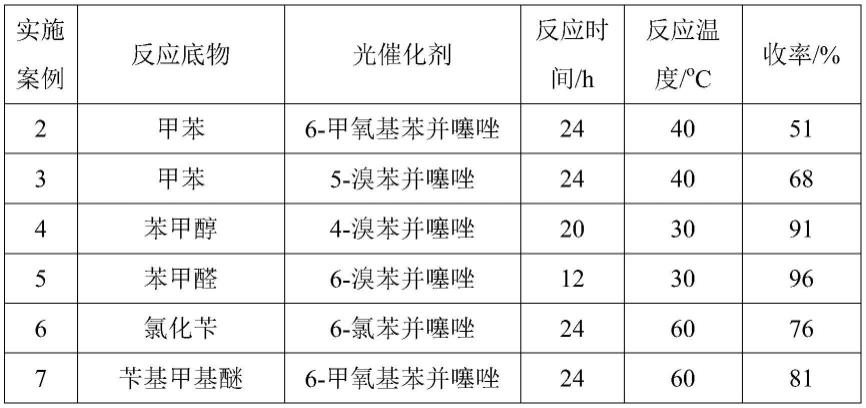
实施例2-7
[0027]
实施例2-7采用与实施例1同样的方法,反应底物均为0.5mmol,添加剂均为浓盐酸(36wt%),底物、光催化剂和添加剂的投料比均为1:0.1:0.5,混合物曝露在空气中在25w的紫光下照射反应,且反应产物均为苯甲酸,反应情况列于表1中。
[0028]
表1实施例2-7的具体反应条件
[0029][0030]
实施例8 4-甲基苯甲酸
[0031][0032]
在20ml的反应瓶中,加入4-甲基甲苯(53mg,0.5mmol),6-氯苯并噻唑(17mg,0.1mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入丙酮(2ml),将混合物曝露在空气中在25w的紫光下照射,30℃下搅拌反应24小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
b)所示的目标产物4-甲基苯甲酸,收率为86%,hplc纯度为97.8%。1h nmr (400mhz,dmso-d6)δ12.77(brs,1h),7.84(d,j=8.2hz,2h),7.29(d,j=8.0hz,2h),2.36(s,3h);
13
c nmr(100mhz,dmso-d6)δ167.76,143.45,129.78,129.55,128.49,21.56.
[0033]
实施例9 4-氯苯甲酸
[0034][0035]
在20ml的反应瓶中,加入4-氯甲苯(63mg,0.5mmol),4-甲氧基苯并噻唑(16mg,0.1mmol),浓盐酸(36wt%,20mg,0.2mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,30℃下搅拌反应20小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
c)所示的目标产物4-氯苯甲酸,收率为71%,hplc纯度为98.6%。1h nmr(400mhz,dmso-d6)δ13.20(brs,1h),7.94(d,j=8.5hz,2h),7.55(d,j=8.6hz,2h);
13
c nmr(100mhz,dmso-d6)δ166.92,138.26,131.58,130.06,129.17.
[0036]
实施例10 4-氟苯甲酸
[0037][0038]
在20ml的反应瓶中,加入4-氟甲苯(55mg,0.5mmol),5-溴苯并噻唑(21mg,0.1mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入乙腈(2ml),将混合物与连有氧气球的三通相连,并抽真空,充入氧气(1atm),在25w的白光下照射,55℃下搅拌反应24小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
d)所示的目标产物4-氟苯甲酸,收率为70%,hplc纯度为98.1%。
[0039]1h nmr (400mhz,dmso-d6)δ13.08(brs,1h),8.00(dd,j=8.8,5.6hz,2h),7.31(t,j=8.9hz,2h);
13
c nmr(100mhz,dmso-d6)δ165.36(d,j=250.4hz),132.55(d,j=9.5hz),127.78(d,j=2.7hz),116.05(d,j=21.9hz).
[0040]
实施例11 4-甲氧基苯甲酸
[0041][0042]
在20ml的反应瓶中,加入4-甲氧基甲苯(62mg,0.5mmol),5-氟苯并噻唑(15mg,0.1mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入二氯甲烷(2ml),将混合物曝露在空气中在25w的紫光下照射,30℃下搅拌反应18小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
e)所示的目标产物4-甲氧基苯甲酸,收率为91%,hplc纯度为99.1%。
[0043]1h nmr(400mhz,dmso-d6)δ12.66(brs,1h),7.94
–
7.87(m,2h),7.04
–
6.99(m,2h),3.82(s,3h);
13
c nmr(100mhz,dmso-d6)δ167.48,163.28,131.80,123.39,114.25,55.86.
[0044]
实施例12 4-苯基苯甲酸
[0045][0046]
在20ml的反应瓶中,加入4-苯基甲苯(84mg,0.5mmol),苯并噻唑(26mg,0.2mmol),浓盐酸(36wt%,30mg,0.3mmol),向混合物中加入1,2-二氯乙烷(2ml),将混合物曝露在空气中在25w的紫光下照射,40℃下搅拌反应20小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
f)所示的目标产物4-苯基苯甲酸,收率为98%,hplc纯度为98.7%。
[0047]1h nmr(400mhz,dmso-d6)δ13.00(s,1h)8.07
–
8.01(m,2h),7.82
–
7.78(m,2h),7.75
–
7.71(m,2h),7.53
–
7.47(m,2h),7.45
–
7.39(m,1h);
13
c nmr(100mhz,dmso-d6)δ167.6,144.8,139.5,130.4,130.1,129.5,128.7,127.4,127.3.
[0048]
实施例13 4-三氟甲基苯甲酸
[0049][0050]
在20ml的反应瓶中,加入4-三氟甲基甲苯(80mg,0.5mmol),4-甲基苯并噻唑(15mg,0.1mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的蓝光下照射,60℃下搅拌反应30小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
g)所示的目标产物4-三氟甲基苯甲酸,收率为53%,hplc纯度为97.4%。
[0051]1h nmr(400mhz,dmso-d6)δ13.50(s,1h),8.13(d,j=8.0hz,2h),7.85(d,j=8.2hz,2h);
13
c nmr(100mhz,dmso-d6)δ166.65,135.01(d,j=1.5hz),132.93(q,j=31.9hz),130.53,124.24(q,j=273.2hz).
[0052]
实施例14糠酸
[0053][0054]
在20ml的反应瓶中,加入2-甲基呋喃(41mg,0.5mmol),6-硝基苯并噻唑(18mg,0.1mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,25℃下搅拌反应6小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
h)所示的目标产物糠酸,收率为56%,hplc纯度为99.1%。
[0055]1h nmr (400mhz,dmso-d6)δ13.06(s,1h),7.91(dd,j=1.8,0.8hz,1h),7.21(dd,j=3.6,0.8hz,1h),6.65(dd,j=3.6,1.6hz,1h);
13
c nmr(100mhz,dmso-d6)δ159.7,147.5,
145.4,118.1,112.5.
[0056]
实施例15噻吩-2-甲酸
[0057][0058]
在20ml的反应瓶中,加入2-甲基噻吩(49mg,0.5mmol),5-羧酸乙酯苯并噻唑(10mg,0.05mmol),浓盐酸(36wt%,15mg,0.15mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的蓝光下照射,25℃下搅拌反应20小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
i)所示的目标产物噻吩-2-甲酸,收率为67%,hplc纯度为98.4%。
[0059]1h nmr(400mhz,dmso-d6)δ13.05(brs,1h),7.88(d,j=5.0hz,1h),7.74(dd,j=3.7,1.3hz,1h),7.18(dd,j=4.9,3.8hz,1h);
13
c nmr(100mhz,dmso)δ163.4,135.1,133.7,133.6,128.7.
[0060]
实施例16 2,4-二氯苯甲酸
[0061][0062]
在20ml的反应瓶中,加入2,4-二氯甲苯(80mg,0.5mmol),6-溴苯并噻唑(11mg,0.05mmol),浓硫酸(98.3wt%,10mg,0.1mmol)和氯化钠(12mg,0.2mmol),向混合物中加入乙腈(2ml)和水(0.5ml),将混合物曝露在空气中在25w的紫光下照射,60℃下搅拌反应30小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
j)所示的目标产物2,4-二氯苯甲酸,收率为64%,hplc纯度为98.1%。
[0063]1h nmr(400mhz,dmso-d6)δ13.60(brs,1h),7.83(d,j=8.4hz,1h),7.73(d,j=1.9hz,1h),7.53(dd,j=8.4,2.1hz,1h);
13
c nmr(101mhz,dmso-d6)δ166.30,137.01,133.51,132.85,130.68,130.52,127.97.
[0064]
实施例17 1-萘甲酸
[0065][0066]
在20ml的反应瓶中,加入1-甲基萘(71mg,0.5mmol),6-溴苯并噻唑(21mg,0.1mmol),溴化氢(68.85wt%,59mg,0.5mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,40℃下搅拌反应20小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
k)所示的目标产物1-萘甲酸,收率为93%,hplc纯度
为97.2%。1h nmr(400mhz,dmso-d6)δ13.16(s,1h),8.87(d,j=8.6hz,1h),8.21
–
8.13(m,2h),8.03(d,j=8.1hz,1h),7.70
–
7.53(m,3h);
13
c nmr(101mhz,dmso-d6)δ169.1,133.9,133.4,131.1,130.3,129.1,128.2,128.0,126.6,126.0,125.3.
[0067]
实施例18 4-苯甲酰苯甲酸
[0068][0069]
在20ml的反应瓶中,加入4-甲基二苯甲酮(98mg,0.5mmol),6-溴苯并噻唑(11mg,0.05mmol),三氟乙酸(23mg,0.2mmol)和四丁基氯化铵(56mg,0.2mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,60℃下搅拌反应24小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
l)所示的目标产物4-苯甲酰苯甲酸,收率为79%,hplc纯度为97.6%。
[0070]1h nmr(600mhz,dmso-d6)δ13.36(s,1h),8.10(d,j=8.0hz,2h),7.82(d,j=8.2hz,2h),7.76(d,j=7.6hz,2h),7.70(t,j=7.4hz,1h),7.57(t,j=7.6hz,2h);
[0071]
13
c nmr(151mhz,dmso-d6)δ195.8,167.1,141.0,137.0,134.5,133.6,130.2,130.1,129.9,129.1.
[0072]
实施例19阿司匹林
[0073][0074]
在20ml的反应瓶中,加入乙酸邻甲苯酯(75mg,0.5mmol),6-溴苯并噻唑(11mg,0.05mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,30℃下搅拌反应24小时,反应液再加入饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
m)所示的目标产物苯甲酸,收率为56%,hplc纯度为98.1%。1h nmr (600mhz,dmso-d6)δ13.07(brs,1h),7.93(dd,j=7.8,1.8hz,1h),7.64(td,j=7.8,1.2hz,1h),7.38(td,j=7.8,1.2hz,1h),7.20(dd,j=7.8,1.2hz,1h)2.25(s,3h);
13
c nmr(151mhz,dmso-d6)δ169.6,166.1,150.6,134.3,131.8,126.5,124.5,124.2,21.3.
[0075]
实施例20联苯利平
[0076][0077]
在20ml的反应瓶中,加入2-甲基-4'-(三氟甲基)-1,1'-联苯(118mg,0.5mmol),6-溴苯并噻唑(11mg,0.05mmol),浓盐酸(36wt%,25mg,0.25mmol),向混合物中加入乙腈(2ml),将混合物曝露在空气中在25w的紫光下照射,50℃下搅拌反应24小时,反应液再加入
饱和食盐水洗涤,将混合物用乙酸乙酯(3*10ml)萃取,合并的有机相用无水na2so4干燥并减压浓缩,石油醚/乙酸乙酯柱层析分离纯化,得到如式(
ⅱ‑
n)所示的目标产物苯甲酸,收率为63%,hplc纯度为98.8%。
[0078]1h nmr(400mhz,dmso-d6)δ12.88(brs,1h),7.84(dd,j=7.7,1.2hz,1h),7.77(d,j=8.1hz,2h),7.63(td,j=7.5,1.4hz,1h),7.57
–
7.50(m,3h),7.41(dd,j=7.6,1.0hz,1h);
13
c nmr(100mhz,dmso-d6)δ169.3,145.8,140.5,132.2,131.7,131.0,130.0,129.6,128.5,128.1(q,j=31.7hz),125.3(q,j=3.8hz),124.9(q,j=271.9hz)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1