一种抑制牛CD44基因表达的shRNA序列及应用
一种抑制牛cd44基因表达的shrna序列及应用
技术领域
1.本发明涉及抑制牛cd44基因表达的shrna序列及其用途,尤其是公开一种抑制牛cd44基因表达的shrna序列及应用,属于生物医药技术领域。
技术背景
2.牛的cd44基因定位于第15号染色体中,含有17个外显子和,cd44分子的转录序列存在多种剪接形式,目前,牛的cd44可能存在有9个转录本。牛骨髓间充质干细胞研究发现细胞表明抗原存在cd44,目前cd44在牛的干细胞和胚胎研究较多,通过诱导骨髓间充质干细胞成功分化为成骨细胞,脂肪细胞,肝和胰岛样细胞,表明cd44作为细胞表面抗原可能对细胞分化存在调控作用。
3.短发夹rna(short hairpin rna,shrna)是一种基于rna干扰(rna interference,rnai)原理,将小干扰rna(smallinterference,sirna)在细胞或者体内转录表达出来,抑制或降解特定基因mrna或抑制mrna翻译的一种有效方法,从而达到抑制基因表达的方法,被广泛应用于医药研发和农林科技等多个领域。采用事先在体外构建的慢病毒shrna载体,然后通过慢病毒介导转染到细胞内,不但使shrna有效应用的细胞种类增加,甚至可以发挥长期阻断基因表达的作用。
技术实现要素:
4.本发明公开一种抑制牛cd44基因表达的shrna序列及应用,涉及一种有效的抑制牛cd44基因的表达的shrna,即cd44 lv-shrna 592;通过慢病毒载体构建和慢病毒包装技术,进一步提高载体转入细胞和活体动物的效率以及shrna载体表达和发挥作用的周期,提高了shrna抑制基因表达的效果。
5.本发明的目的在于公开的一种抑制牛cd44基因表达的cd44 lv-shrna 592序列,是提供有效抑制牛cd44基因mrna的shrna分子序列,cd44 lv-shrna592序列,其基因序列如seq id:no.1所示:5’gcctttgaaggaccaattaccttcaagagaggtaattggtccttcaaaggc3’,其中,ttcaagaga为颈环序列;本发明的第二目的是提供上述shrna抑制牛cd44基因表达的shrna构建于慢病毒载体上,插入shrna的dna双链,其中:cd44 lv-shrna 592正义链序列为:5’gatccgcctttgaaggaccaattaccttcaagagaggtaattggtccttcaaaggctttttg3’:cd44 lv-shrna 592反义序列为:5’aattcaaaaaagcctttgaaggaccaattacctctcttgaaggtaattggtccttcaaaggc3’。
6.本发明第三目的是提供了上述牛cd44基因的shrna慢病毒载体转入细胞或体内抑制cd44表达的rna干扰序列,有效抑制牛cd44表达,抑制牛cd44基因的shrna分子序列在制备抑制牛cd44基因表达方面的应用。
7.本发明第四目的是将所述抑制牛cd44基因表达的shrna构建于慢病毒载体上,转入细胞或活体动物能有效抑制牛cd44基因在mrna及蛋白水平的表达,适用于调控细胞和体内cd44表达基因方面的应用。同时,在提高牛肉质性状和抗病能力的分子育种和转基因动物制备过程中具有应用前景。
8.本发明的积极效果在于:提供了一种有效的抑制牛cd44基因的表达的shrna:cd44 lv-shrna 592;通过慢病毒载体构建和慢病毒包装技术,进一步提高载体转入细胞和活体动物的效率以及shrna载体表达和发挥作用的周期,提高了shrna抑制基因表达的效果。在细胞和活体中降低cd44表达水平,以及今后解析牛cd44基因作用机理提供有效手段,同时,在牛的分子育种和转基因动物制备过程中,具有重要的应用前景和经济价值。
附图说明
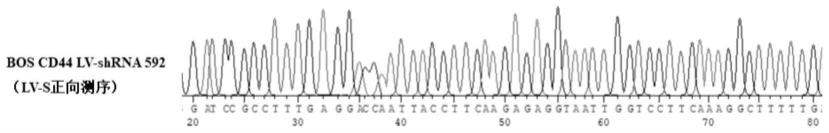
9.图1 为本发明牛cd44基因shrna慢病毒载体插入序列;图2 为本发明慢病毒感染后48 h牛前体脂肪细胞中绿色荧光蛋白表达;图3 为本发明cd44基因mrna的相对表达水平;图4 为本发明牛脂肪细胞中甘油三酯含量;其中,(1)cd44抑制后牛前体脂肪细胞甘油三酯含量;(2)cd44抑制后牛前体脂肪细胞内胆固醇含量;(3)cd44抑制后牛脂肪细胞甘油三酯含量;(4)cd44抑制后牛脂肪细胞胆固醇含量。
具体实施方式
10.通过以下实施例进一步举例描述本发明,并不以任何方式限制本发明,在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动或改变都将落入本发明的权利要求范围之内。
11.实施例1shrna的设计与载体构建根据genbank数据库公布的牛cd44基因的mrna序列(http://www .ncbi .nlm .nih .gov/genbank),序列号为nm_174013.3。同时根据shrna序列的设计原则,选择了靶序列,以确保载体的有效性,靶序列为:5
’ꢀ
gcctttgaaggaccaattacc 3’;根据上述对应靶序列的位置,将shrna分别命名为 cd44 lv-shrna 592;其基因序列如seq id:no.1所示:5’gcctttgaaggaccaattaccttcaagagaggtaattggtccttcaaaggc3’,其中,ttcaagaga为颈环序列;根据慢病毒载体的多克隆位点,在设计的shrna序列分别添加了酶切位点的粘性末端序列,退火dna oligo序列分别:cd44 lv-shrna 592 s(上游):5’gatccgcctttgaaggaccaattaccttcaagagaggtaattggtccttcaaaggctttttg3’;cd44 lv-shrna 592 as(下游):5’aattcaaaaaagcctttgaaggaccaattacctctcttgaaggtaattggtccttcaaaggc 3’;字体加粗表示粘性末端序列,下划线表示颈环序列。
12.所有dna oligo由生工生物合成。
13.为进一步获得带有内切酶粘性末端的双链dna,将合成的dna oligo分别退火,将合成的oligo用oligoannealing buffer溶解成100 μm,互补单链各取10 μl与退火buffer和ddh2o混合,定容至100 μl。然后将oligo混合物在水浴锅中95℃加热5 min,然后水浴锅开盖置室温中自然冷却至室温,形成双链oligo片段。取退火产物用于后续的连接反应,剩余退火产物-20℃保存,备用;连接反应体系:退火的双链oligo(10 mm)1
ꢀµ
l、线性化的干扰载体(40 ng/
µ
l) 3
ꢀµ
l、10
×
t4 dna ligase buffer 2
ꢀµ
l、t4 dna ligase 1
ꢀµ
l、dd h2o 补至20
ꢀµ
l,于25℃连接30 min。
14.转化和质粒提取:1. 取感受态细胞(-80℃保存)于冰上,待溶解后加入10
ꢀµ
l连接液,轻轻旋转以混匀内容物,在冰中放置30 min;2. 将管放到预加温到42℃的恒温水浴锅中热激90 s;3. 快速将管转移到冰浴中,使细胞冷却2~3 min;4. 每管加900
ꢀµ
l lb培养液,然后将管转移到37℃摇床上,温育1 h使细菌复苏;5. 取恰当量的转化菌液涂布于lb琼脂平板上(含氨苄青霉素);6. 倒置平皿,于恒温培养箱中37℃培养,16 h;7. 挑取阳性单克隆菌于lb液体培养基(含氨苄青霉素)中扩大培养后,送至生工生物测序,鉴定阳性克隆序列;8. 阳性菌液扩大培养,使用无内毒素质粒提取试剂盒提取shrna质粒,-20℃保存,备用;sanger测序结果显示,通过上述步骤和方法,成功构建了含有目标序列的cd44的慢病毒shrna干扰载体,目标序列的测序结果截图如图1。
15.实验例1cd44慢病毒shrna载体包装和牛前体脂肪细胞感染一、shrna载体慢病毒包装1. 预先将293t细胞接种到6孔板;2. 采用dmem含10% fbs培养基培养细胞;3. 第二天,镜下检查细胞。细胞融合度应大致为80~90%,分布均匀;4. 转染前1 h,取出细胞板,跟换新鲜细胞培养基;5. 取无菌的1.5 ml离心管,加入300 μlopti-mem培养基,将转染试剂(16 μl)分别与shrna质粒(2 μg)和包装载体(pmdl、vsvg、prsv-rev各2 μg),轻轻混匀,室温孵育15 min;6. 将每个转染混合物分别滴加到6孔板中;7. 培养箱中过夜,18 h更换20% fbs dmem培养基;8. 转染后48 h观察所转染质粒带有gfp荧光,并拍照;9. 将细胞至于培养箱继续培养24 h,收集所有的上清;10. 500 g离心10 min,除去脱落的细胞和大的细胞碎片;11. 0.22 μm pvdf过滤病毒上清液。-80℃保存,备用。
16.二、慢病毒介导的shrna转染牛前体脂肪细胞:
1. 预先将牛前体细胞接种到6孔板;2. 采用含有10% fbs的dmem/f12培养基培养细胞;3. 第二天,镜下检查细胞。细胞融合度应大致为80-90%,分布均匀;将包装好的慢病毒液分别加入到6孔板中;4. 转染24 h后更换新鲜培养基;5. 转染后48 h后,荧光显微镜观察,拍照;6. 一部分病毒感染48 h后的牛前体脂肪细胞,收集1
×
107个细胞用于细胞代谢组学检测分析,收集1
×
106个细胞提取总rna用于转录组测序分析进一步精准分析cd44基因对于牛前体脂肪细胞分化过程中对基因表达调控和代谢产物的影响;7. 另一部分感染后48 h细胞更换诱导培养基,诱导培养48 h(诱导后2 d),更换维持培养基 3 d更换一次维持培养基;8.诱导10 d后,收集细胞,提取细胞总rna、甘油三酯、胆固醇和蛋白质,用于后续检测分析;三、检测分析293t细胞转染后24 h、48 h,绿色荧光蛋白(gfp)表达水平较高,显微镜观察结果如图2;前体脂肪细胞慢病毒感染48 h后,细胞形态完好,未见死细胞,存活率达到98%以上,细胞中gfp荧光蛋白表达情况如图2。
17.实验例2shrna慢病毒载体对牛cd44基因mrna表达水平的抑制作用实时荧光定量pcr检测基因mrna的表达将上述构建成功的shrna干扰载体通过慢病毒介导转入牛前体脂肪细胞内,分别收集慢病毒感染后48 h的牛前体脂肪细胞,采用试剂盒提取细胞总rna,反转录合成cdna,根据ncbi网站上提供的候选基因的mrna序列(cd44:nm_174013.3):上游引物:5
’‑ꢀ
cctcggataccagagactacg
ꢀ‑3’
;下游引物:5
’‑ꢀ
cacaccttctcctactgttgac
ꢀ‑3’
;内参引物为β-actin引物:上游引物:5
’‑
agagcaagagaggcatcc-3’;下游引物:5
’‑
tcgttgtagaaggtgtggt-3’;定量反应体系分别为rt2sybr master mix 5 μl,cdna 1 μl,上游引物/下游引物各0.2 μl,ddh2o补足至10 μl;反应条件:利用常规两步法进行扩增,95℃ 5 min;95℃ 30 s,60℃ 60 s,40个循环;72℃延伸10 min。每个样品设置3个重复,在定量扩增参数后增设溶解曲线程序:95 ℃ 15 s,60 ℃ 20 s,95 ℃ 15 s。荧光定量pcr的反应体系如表3。采用2
△
ct(
△
ct=ct目的基因-ct内参基因)计算基因mrna的相对表达水平,利用graphpad prism 6.0软件中的独立样本单因素方差分析,检验对结果进行统计分析。
18.慢病毒shrna干扰载体感染后前体脂肪细胞通过荧光定量pcr检测细胞中cd44表达水平结果显示,bos cd44 lv-shrna 592的干扰效率为63.36%,与对照组空载体相比差异显著(p《0.05)(图3)。表明慢病毒介导的bos cd44 lv-shrna 592载体应用牛前体脂肪细胞中能够有效的抑制cd44的mrna。
19.实验例3
shrna抑制cd44基因mrna表达水平对牛前体脂肪细胞中甘油三酯和胆固醇含量的影响牛前体脂肪细胞甘油三酯和胆固醇检测将上述有效的shrna重组慢病毒和对照shrna的慢病毒颗粒转染牛前体脂肪细胞,在cd44表达水平降低的前提下,使用甘油三酸酯试剂盒,根据说明书检测总甘油三酸酯含量。牛前体脂肪细胞转染48 h后和诱导10 d后,分别采用4℃ pbs清洗2次,0.25%的胰蛋白酶消化细胞,1000 r/min离心收集细胞。将裂解物在70
°
c水浴10 min,然后以2000 rpm离心。检测试剂r1和检测试剂r2以4∶1的比例混合。用酶标仪在550 nm处测定吸光度。利用bca蛋白检测试剂盒,试验步骤参考说明书标准操作流程,检测同一样品中蛋白质的浓度,使用多功能酶标仪检测562 nm波长下吸光度值,最终以每mg蛋白含量校正甘油三酯和胆固醇含量。
20.甘油三酯和胆固醇检测结果显示,cd44敲降后,前体脂肪细胞诱导10 d后,shrna-cd44-592组细胞内甘油三酯检测结果显著增加(p《0.05),高于对照15 μmol/mg(图4(1)、(2));胆固醇检测结果显示,cd44敲降shrna-cd44-592组的胆固醇含量显著高于对照组(p《0.05)(图4(3)、(4))。提示cd44基因表达水平下调,可显著增加脂肪细胞中甘油三酯和胆固醇的含量,促进细胞内脂肪合成和脂滴的形成。以上结果证明shrna-cd44-592能有效降低cd44基因的表达水平,进而证明了cd44基因对于调控脂肪细胞的分化和细胞内甘油三酯含量的作用。
21.结论:鉴定和开发应用功能基因提高牛的生产、繁殖和抗病能力,是牛分子育种领域的热点和发展趋势。但是,目前研究cd44基因在牛细胞和体内的作用过程中,尚无高效和稳定抑制cd44表达方面的有效手段。通过开发高效和稳定表达的shrna慢病毒载体抑制cd44的表达,可通过抑制cd44基因表达探讨其对其下游基因表达的调控作用,在基因功能研究过程中,对进一步解析其对免疫反应、脂肪代谢、胰岛素抵抗和干细胞分化等过程的影响及其作用机理提供有效手段,同时,在牛的分子育种和转基因动物制备过程中,提供新的思路和方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1