一种定型内胚层细胞来源的间充质干细胞及其分化方法和应用
1.本发明涉及间充质干细胞技术领域,具体而言,涉及一种定型内胚层细胞来源的间充质干细胞及其分化方法和应用。
背景技术:
2.目前以化学药物、生物药物、手术治疗为支柱的传统疗法仍无法解决许多疾病问题,而以干细胞技术为核心的再生医学正逐渐应用于临床,并显示出巨大潜力。相比于其他种类的干细胞,间充质干细胞(mscs)具有低免疫原性(即主要组织相容性复合物mhc i在mscs中低表达,mhc ii在mscs中无表达)的特征,因而mscs更适合同种异体应用,已成为细胞治疗的理想候选物。
3.间充质干细胞(mscs)具有用于组织工程和再生医学的多种治疗潜力,它不仅可直接分化成组织特异性细胞以修复伤口而且可通过释放抗炎细胞因子、抗凋亡因子和生长因子的旁分泌形式来刺激组织修复,可用于治疗多种疾病,包括炎症性疾病和自身免疫性疾病。
4.此外,目前现有文献中记载,mscs可以治疗呼吸道疾病、消化道疾病、肝脏疾病、胰脏炎、结直肠炎等疾病。
5.尽管mscs在治疗呼吸道和消化道疾病方面取得了积极结果,许多临床试验也已证明mscs治疗是安全有效的,但这些研究的结果和结论仍存在很大差异。最合理的解释是:1)mscs供体来源过于广泛,传统意义上,间充质干细胞来源于人体组织,主要来源包括骨髓和脂肪,也可从脐带血、胎盘、羊膜、牙髓等组织分离获得mscs,从胚胎发育角度看,骨髓、脂肪、牙髓、脐带、胎盘、羊膜等来源于中胚层、外胚层或滋养层,而使用中胚层、外胚层或滋养层来源的mscs并不一定适合内胚层(呼吸道器官和消化道器官的祖细胞)相关疾病;2)不同供体来源的mscs的培养方案也存在较大差异。因此,对于产生用于治疗的均质且胚层匹配的mscs则显得至关重要。
6.鉴于此,特提出本发明。
技术实现要素:
7.本发明的目的在于提供一种定型内胚层细胞来源的间充质干细胞及其分化方法和应用。
8.本发明是这样实现的:
9.第一方面,本发明提供一种定型内胚层细胞来源的间充质干细胞的分化方法,其包括:
10.第一分化阶段:在含有wnt通路激活剂和activin a的第一分化培养基中培养1-2天诱导人多能干细胞向中内胚层细胞分化;
11.第二分化阶段:在不含wnt通路激活剂且含有activin a的第二分化培养基中培养
2-8天诱导形成定型内胚层细胞(de);
12.第三分化阶段:在msc生成培养基中培养2-4天诱导所述定型内胚层细胞获得中肠细胞、后肠细胞及前肠细胞的命运;
13.第四分化阶段:继续在msc生成培养基中培养8-14天诱导生成含有间充质干细胞的细胞群体;
14.第五分化阶段:进行消化传代2-3次,即得定型内胚层细胞来源的间充质干细胞(de-mscs)。
15.第二方面,本发明提供一种定型内胚层细胞来源的间充质干细胞,其采用如前述实施方式任一项所述的经人多能干细胞生成定型内胚层细胞来源的间充质干细胞的方法分化获得。
16.第三方面,本发明提供如前述实施方式所述的定型内胚层细胞来源的间充质干细胞在制备治疗肠道相关疾病的药物中的应用。
17.第四方面,本发明提供一种间充质干细胞分化细胞,其是由如前述实施方式所述的定型内胚层细胞来源的间充质干细胞体外分化而成;
18.优选地,所述间充质干细胞所分化得到的细胞包括脂肪细胞、软骨细胞和成骨细胞中的至少一种。
19.第五方面,本发明提供一种诱导人多能干细胞生成定型内胚层细胞来源的间充质干细胞的试剂盒,其包括实现如前述实施方式所述的定型内胚层细胞来源的间充质干细胞的分化方法的试剂。
20.本发明具有以下有益效果:
21.本技术提供的定型内胚层细胞来源的间充质干细胞的分化方法采用成分清晰的培养基诱导hpsc分化成定型内胚层细胞(de)和定型内胚层细胞特异性来源的间充质干细胞(de-mscs)。更为重要的是,通过不同的诱导方式可以使这些细胞获得中肠、后肠及前肠细胞命运。经前肠细胞命运途径获得的de-mscs类似于人体肺、肝脏及胰腺来源的mscs,适用于治疗以covid-19、肝硬化、胰腺炎等为代表的体肺、肝脏及胰相关疾病;而经中肠/后肠细胞命运途径获得的de-mscs类似于人体小肠及大肠来源的mscs,适用于治疗以结肠炎、克罗恩氏病为代表的肠道相关疾病。本技术提供了一种高效制备经人多能干细胞衍生的定型内胚层来源的间充质干细胞的体外分化方法。且这些de-mscs能够在体外刺激的条件下分泌抗炎因子,进一步地,这些经腹腔注射的de-mscs具有治疗结肠炎小鼠的能力。
附图说明
22.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
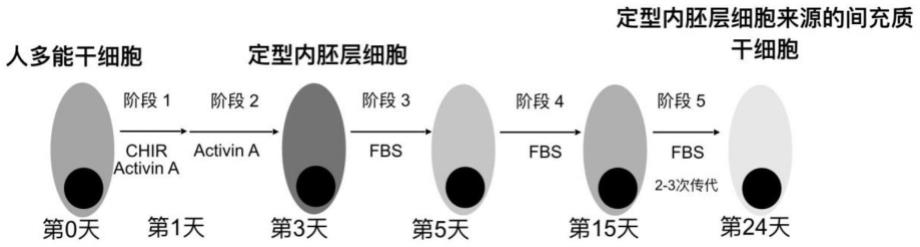
23.图1为实施例1提供的定型内胚层细胞来源的间充质干细胞(de-mscs)的分化方案;
24.图2为实施例1中从第0天到第24天,细胞形态(上图)随时间进程的变化和定型内胚层细胞标志物sox17(下图)的表达随时间进程的变化;
25.图3为实施例1中sox17 mrna和间充质干细胞特征性基因cd44、cd73、cd105 mrna表达水平随时间进程的变化;
26.图4为实施例1中第24天时间充质干细胞标志物cd44、cd73、cd105、cd45阳性细胞百分比;
27.图5为实施例1中定型内胚层细胞标志物sox17阳性细胞百分比以及间充质干细胞标志物cd44、cd73和cd105阳性细胞百分比;
28.图6为实施例1中定型内胚层细胞来源的间充质干细胞(de-mscs)的细胞总数随时间进程的变化;
29.图7为实施例1中定型内胚层细胞来源的间充质干细胞(de-mscs)进一步分化为脂肪细胞(可被油红o染料染成红色)、软骨细胞(可被alcian蓝染料染成蓝色)、骨细胞(可被von kossa染料染成黑色);
30.图8为实施例2提供的定型内胚层细胞来源的间充质干细胞(de-mscs)的分化方案示意图;
31.图9为实施例2中纯化的sox17阳性de细胞(仅选取表达强度最高的前48%的de细胞,并将纯化得到的细胞返回到msc生成条件下诱导其进一步形成de-mscs);
32.图10为实施例2中第15天和第24天的细胞形态;
33.图11为实施例2中第24天时cd44、cd73、cd105阳性细胞百分比;
34.图12为实施例3提供的定型内胚层细胞来源的间充质干细胞(de-mscs)的分化方案示意图;
35.图13为实施例3中rt-qpcr分析以测试chir99021、sb431542、xav939及其组合对第15天的cd44、cd73、cd105 mrna表达水平的影响;
36.图14为实施例3中de-mscs(fbs)、de-mscs(chir)、de-mscs(chir/sb)在第24天时的细胞形态;
37.图15为实施例3中de-mscs(fbs)、de-mscs(chir)、de-mscs(chir/sb)在第24天时cd44、cd73、cd105、pdgfrβ、cd45阳性细胞百分比;
38.图16为实施例4中经人诱导多能干细胞nl-1和人胚胎干细胞h1,定型内胚层细胞来源的间充质干细胞(de-mscs)在第24天时的细胞形态;
39.图17为实施例4中经人诱导多能干细胞nl-1和人胚胎干细胞h1,定型内胚层细胞来源的间充质干细胞(de-mscs)在第24天时的cd44、cd105阳性细胞百分比;
40.图18为实施例5中健康组小鼠、dss+pbs组小鼠、dss+pbs+de-mscs(fbs)组小鼠、dss+pbs+de-mscs(chir)组小鼠、dss+pbs+de-mscs(chir/sb)组小鼠和dss+pbs+uc-mscs组小鼠从第0天到第14天的体重变化;
41.图19为实施例5中健康组小鼠、dss+pbs组小鼠、dss+pbs+de-mscs(fbs)组小鼠、dss+pbs+de-mscs(chir)组小鼠、dss+pbs+de-mscs(chir/sb)组小鼠和dss+pbs+uc-mscs组小鼠在第14天时的结肠长度;
42.图20为实施例5中健康组小鼠、dss+pbs组小鼠、dss+pbs+de-mscs(fbs)组小鼠、dss+pbs+de-mscs(chir)组小鼠、dss+pbs+de-mscs(chir/sb)组小鼠和dss+pbs+uc-mscs组小鼠在第14天时的结肠图像。
具体实施方式
43.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
44.本发明提供一种定型内胚层细胞来源的间充质干细胞的分化方法,其包括:将人多能干细胞诱导分化为定型内胚层细胞(de),将定型内胚层细胞诱导分化为间充质干细胞(mscs),经人多能干细胞的定型内胚层细胞来源的间充质干细胞统称为de-mscs。
45.具体来说,本技术提供的分化方法包括如下步骤:
46.s1、对人多能干细胞进行培养并传代,待细胞长至30-60%时开始分化。
47.在e8培养基中培养人多能干细胞,每天更换新鲜e8培养基,当细胞密度达到70-80%时进行传代。传代时先用dpbs-edta对人多能干细胞进行洗涤2-3次,然后在室温下孵育4-10分钟,抽吸dpbs-edta,并添加含有5μm rock抑制剂的干性维持培养基,重悬细胞后,以1:5-1:7的密度传代,加入预先包被matrigel的孔板,细胞贴壁1天后更换新鲜的e8培养基继续培养,待细胞长至30-60%时开始分化。
48.其中,e8培养基的成分包括:dmem/f12(为基础培养基,商购自thermofisher,货号11330-032)、l-抗坏血酸-2-磷酸镁60-70mg/l、亚硒酸钠10-15μg/l、转铁蛋白8-12μg/ml、胰岛素8-12μg/ml、fgf2 90-110ng/ml、tgfβ1-2ng/ml。
49.人多能干细胞包括人胚胎干细胞和人诱导多能干细胞中的至少一种;优选地,人胚胎干细胞包括人胚胎干细胞h1或人胚胎干细胞h9;人诱导多能干细胞包括人诱导多能干细胞nl-1。
50.本技术中的人胚胎干细胞h1和人胚胎干细胞h9均购自wicell research institute,inc.(麦迪逊,威斯康星州,美国,http://www.wicell.org),人诱导多能干细胞nl-1为本实验室保藏的细胞系(hpscreg编号为crmi003-a)。
51.s2、分化阶段。
52.(1)第一分化阶段。
53.采用含有wnt通路激活剂和activin a的第一分化培养基中培养1-2天诱导人多能干细胞向中内胚层分化。
54.wnt通路激活剂包括chir99021、chir99021-hcl、wnt3a配体、wnt5a配体和bio中的至少一种;chir99021或chir99021-hcl的处理浓度为1-5μm。
55.激活素(activins)activin a是转化生长因子(tgf)β家族的一种分泌蛋白,可控制胚胎轴发育为有功能的前肠源性组织,调解多种细胞的生长和分化。同时它还被广泛用于干细胞研究,用来诱导胚胎干细胞分化形成内胚层细胞。
56.本技术中,通过wnt通路激活剂和activin a联合使用,可以发挥更显著的向中内胚层细胞分化的诱导作用。
57.本文中的“第一分化培养基”的基础组分同现有的常规的用于诱导干细胞分化的培养基的组分,“采用含有wnt通路激活剂和activin a的第一分化培养基”可以理解为在现有的第一分化培养基的基础组分上,添加了wnt通路激活剂和activin a。也即是,本技术中,第一分化培养基是由基础组分加入wnt通路激活剂和所述activin a获得的。其中,wnt
通路激活剂的添加量为1-5μm,activin a的添加量为10-100ng/ml。
58.具体来说,基础组分包括dmem/f12、l-抗坏血酸-2-磷酸镁60-70mg/l、亚硒酸钠10-15μg/l、转铁蛋白8-12μg/ml、chemical defined lipid concentrate 1
×
以及青链霉素1%。
59.培养1-2天,即在分化的第0天开始计算培养时间,本文中的“第0天”是指诱导分化的起始点,即0-24小时,培养1-2天可以理解为在分化开始后的0-48小时内的任意时间采用含有wnt通路激活剂和activin a的第一分化培养基进行培养,优选地,分化培养时间为1天。
60.具体地,本技术中,采用的分化培养基中含有wnt通路激活剂和activin a的时间可以为第1-2天中的任意时间,具体可以为第0天、0.5天、1天、1.5天、2天中的任意时间点或任意时间段。需要说明的是,当采用含有特定试剂的分化培养基进行培养的时间为时间段时,可以选择性在该时间段中进行数次培养基的替换以使得分化培养基中含有特定试剂,比如1-2天的时间段可以选择每天、每10小时或20小时更换新的培养基,以使得诱导分化的过程更加的稳定有效,后续相似情况同此理解,不再赘述。
61.(2)第二分化阶段。
62.在不含wnt通路激活剂且含有activin a的第二分化培养基中培养2-8天诱导形成定型内胚层细胞。
63.本技术在第二分化阶段去除wnt通路激活剂,仅在基础组分中添加activin a作为第二分化培养基进行培养,此时,可以进一步诱导形成定型内胚层细胞(de)。一般情况下,activin a(10-100ng/ml)处理两天即可得到高纯度的定型内胚层细胞(de),但延长activin a(10-100ng/ml)处理时间至4天、6天和8天同样可以得到高纯度的定型内胚层细胞(de),其后仍可按照后续步骤得到de-mscs。因此,本技术中第二分化阶段可以培养2-8天,优选为2天。
64.具体来说,基础组分包括dmem/f12(为基础培养基,商购自thermofisher,货号11330-032)、l-抗坏血酸-2-磷酸镁(作用浓度60-70mg/l)、亚硒酸钠(作用浓度10-15μg/l)、转铁蛋白(作用浓度8-12μg/ml)、chemical defined lipid concentrate(化学成分确定的脂质浓缩物,商购自thermofisher,货号11905031)1
×
以及青链霉素(作用浓度1%)。
65.优选地,在分化获得定型内胚层细胞(de)后,还包括采用流式细胞分选技术来纯化定型内胚层细胞(de)。纯化de包括:通过细胞消化液收获细胞,并用细胞中和液进行中和,细胞经洗涤后重悬,通过流式细胞仪进行纯化。
66.(3)第三分化阶段。
67.在msc生成培养基中培养2-4天诱导所述定型内胚层细胞获得中肠细胞、后肠细胞及前肠细胞的命运。其中,中肠细胞以表达生物标志物pdx1为特征、后肠细胞以表达生物标志物cdx2为特征,前肠细胞以表达生物标志物sox2为特征。
68.在第三分化阶段的msc生成培养基中可以加入细胞信号通路调节剂,本技术中,细胞信号通路调节剂包括wnt通路激活剂、wnt通路抑制剂和tgf通路抑制剂中的至少一种。
69.其中,wnt通路激活剂包括chir99021、chir99021-hcl、wnt3a配体、wnt5a配体和bio中的至少一种;wnt通路激活剂的处理浓度为1-5μm;wnt通路抑制剂包括xav939、iwp2和iwr-1中的至少一种,wnt通路抑制剂的处理浓度为1-10μm;tgf通路抑制剂包括sb431542、
repsox、sd-208、gw788388、a-77-01和a-83-01中的一种;tgf通路抑制剂的处理浓度为1-10μm。
70.msc生成培养基不含血清时的成分包括αmem、l-抗坏血酸-2-磷酸镁60-70mg/l、亚硒酸钠10-15μg/l、胰岛素8-12μg/ml、fgf2 90-110ng/ml、b-27tmsupplement 1
×
、glutamaxtmsupplement 1
×
、neaa 1
×
以及青链霉素1%;或者,msc生成培养基含血清时的成分包括αmem、fbs 10%-20%、l-抗坏血酸-2-磷酸镁60-70mg/l、亚硒酸钠10-15μg/l、胰岛素8-12μg/ml、fgf2 90-110ng/ml、b-27tmsupplement 1
×
、glutamaxtm supplement 1
×
、neaa 1
×
以及青链霉素1%。
71.(4)第四分化阶段
72.继续在msc生成培养基中培养8-10天诱导生成含有间充质干细胞的细胞群体;在第四分化阶段,只使用msc生成培养基培养细胞,不需要添加细胞信号通路调节剂,每两天换液一次,诱导生成含有间充质干细胞的细胞群体。
73.(5)第五分化阶段
74.使用胰蛋白酶的消化液进行常规消化传代,在传代2-3次后,即得定型内胚层细胞来源的间充质干细胞(de-mscs)。
75.采用上述分化方法获得的定型内胚层细胞来源的间充质干细胞(de-mscs)的基因表达谱与内胚层器官基因表达谱系相似;且这些de-mscs能够在体外刺激的条件下分泌抗炎因子,进一步地,这些经腹腔注射的de-mscs具有治疗小鼠结肠炎的潜力,可广泛应用于制备治疗肠道相关疾病的药物中,具体来说,肠道相关疾病包括但不限于结肠炎、呼吸道疾病和消化道炎性疾病。
76.对应的,本技术还提供了一种诱导人多能干细胞生成定型内胚层细胞来源的间充质干细胞的试剂盒,其包括实现上述定型内胚层细胞来源的间充质干细胞的分化方法的试剂。
77.此外,本技术还提供了一种间充质干细胞分化细胞,其是由上述定型内胚层细胞来源的间充质干细胞体外分化而成;间充质干细胞分化细胞包括脂肪细胞、软骨细胞和成骨细胞中的至少一种。
78.以下实施例中所使用的材料及试剂来源于:
79.chir99021(ct99021)hcl,全称为wnt通路激活剂,商购自selleckchem,货号s2924;
80.activin a,全称为一种转化生长因子超家族成员,商购自r&d systems,货号338-ac-500/cf;
81.tgfβ,全称为转化生长因子β,商购自r&d systems,货号240-b-500;
82.fgf2,全称为成纤维细胞生长因子2,商购自peprotech,货号100-18c:
83.xav939,全称为wnt通路抑制剂,商购自selleckchem,货号s1180;
84.sb432542,全称为tgf通路抑制剂,商购自selleckchem,货号s1067;
85.dmem/f12为基础培养基,商购自thermofisher,货号11330-032;
86.chemical defined lipid concentrate为化学成分确定的脂质浓缩物,商购自thermofisher,货号11905031;
87.αmem为基础培养基,商购自thermofisher,货号12571063;
supplement 1
×
、glutamax
tm supplement 1
×
、mem non-essential amino acids solution 1
×
以及青链霉素1%。
103.msc生成培养基(不含血清)的成分包括:αmem、l-抗坏血酸-2-磷酸镁64mg/l、亚硒酸钠13.6μg/l、转铁蛋白10μg/ml、胰岛素10μg/ml、fgf2 100ng/ml、b-27
tm supplement 1
×
、glutamax
tm supplement 1
×
、mem non-essential amino acids solution 1
×
以及青链霉素1%。
104.将实施例1制备获得的定型内胚层细胞来源的间充质干细胞进行检测,检测方法如下:
105.qpcr采用荧光定量pcr检测仪(商购自thermofisher,型号quantstudio7)进行测量,用rnaiso-plus(商购自takara,货号108-95-2)提取总mrna,并使用高容量cdna逆转录试剂盒(商购自applied biosystems,货号4368813)进行从mrna到cdna的逆转录。使用sybr premix ex taq(商购自takara,货号rr420)和quantstudio-7系统进行实时定量pcr。通过2^(-δct)方法计算扩增的核苷酸片段的相对量。将表达水平相对于管家基因tbp进行标准化,并与未分化的人胚胎干细胞进行比较。
106.免疫荧光采用免疫荧光分析仪(商购自thermofisher,型号evos cell imaging system fl)进行测量,细胞在室温下用4%多聚甲醛固定20分钟,用1
×
pbs冲洗(每次5分钟,3次),用0.5%triton x-100破膜20分钟,再用1倍量的pbs冲洗(每次5分钟,3次)。细胞核在室温下用hoechst33342(商购自abnova,货号u0334)染色20分钟。然后将细胞用1
×
pbs漂洗(每次5分钟,3次),在4℃下与抗体孵育过夜,用1
×
pbs漂洗,与荧光二抗孵育2小时,最后用1倍量的pbs漂洗后进行成像。
107.流式细胞术采用流式细胞仪(商购自bd,型号bd c6)进行测量,通过tryple(37℃,5分钟)收获细胞,并用5%fbs进行中和。用具有1%bsa的dpbs洗涤后,抗体孵育,洗涤后,将细胞重悬于dpbs中,通过bd c6进行分析。
108.本实施例提供的分化方案请参阅图1,检测结果请参阅图2-图7。
109.从图2可以看出在第3天和第5天,定型内胚层特异性蛋白sox17高表达,表示经过分化的第一和第二阶段,高纯度的定型内胚层细胞已经被得到。在第24天可以观察到梭形细胞,它们的sox17呈阴性,表示这些定型内胚层细胞已经离开了原来的细胞命运,进而分化成了具有间充质干细胞形态(梭形)的细胞。
110.从图3可以中第3、5、10、15天、第18天(第1次传代,p1)、第21天(第2次传代,p2)、第24(第3次传代,p3)的sox17 mrna表达水平的逐渐降低,以及间充质干细胞特征性基因cd44、cd73、cd105mrna表达水平的逐渐升高(三次重复实验,*p《0.05)的结果可以看出定型内胚层细胞已经离开了原来的细胞命运,进而分化成了具有间充质干细胞基因特征(cd44、cd73、cd105)的细胞。
111.从图4可以看出经定型内胚层细胞来源的间充质干细胞能够高表达间充质干细胞特征阳性生物标志物(cd44、cd73、cd105),同时不表达间充质干细胞特征阴性生物标志物(cd45)(三次重复实验,*p《0.05)。
112.从图5可以看出,在第0、3、5、10、15、18(p1)、21(p2)、24(p3)天sox17阳性细胞百分比逐渐降低,而第18(p1)、21(p2)、24(p3)天cd44、cd73和cd105阳性细胞百分比逐渐升高(三次重复实验,*p《0.05)。
113.图6代表体外经定型内胚层细胞生成的间充质干细胞具有体外增殖能力。
114.图7代表体外经定型内胚层细胞生成的间充质干细胞具有体外继续分化为脂肪细胞、软骨细胞、成骨细胞的能力。
115.综合图2-图7,可以看出,在分化的第一和第二阶段,高纯度定型内胚层细胞可以经本实施例的方法获得。在继续经过第三、四、五阶段后,经定型内胚层细胞生成的间充质干细胞可以经本实施例的方法获得,并且,这些间充质干细胞满足国际干细胞协会(isct标准,2006)对间充质干细标准的要求。
116.实施例2
117.本实施例提供了一种定型内胚层细胞(de)来源的间充质干细胞的分化方法,其相较于实施例1而言,增加了采用了流式细胞分选技术来纯化定型内胚层细胞的步骤,进而可以获得更高纯度的定型内胚层细胞(sox17阳性细胞百分比》95%)。
118.具体实现如下:在e8培养基中培养人胚胎干细胞h9(sox17-gfp报告细胞系),每天更换新鲜培养基,当细胞密度达到70-80%时进行传代。首先用dpbs-edta洗涤2次,然后在室温下孵育5分钟,第3次抽吸dpbs-edta,并添加含有rock抑制剂5μm的e8培养基。重悬细胞后,以1:6的密度传代,加入预先包被matrigel的孔板。细胞贴壁1天后换e8培养基继续培养。待细胞长至30-60%时开始分化,第一天加入含chir99021-hcl 5μm和activin a 100ng/ml的第一分化培养基。分化第2天至第3天,去除chir99021,但维持activin a以诱导形成定型内胚层细胞。在第3天,采用流式细胞分选技术来纯化定型内胚层细胞。将纯化后的定型内胚层细胞培养在msc生成培养基(第3-5天);在分化第5天至第15天,更换新鲜的msc生成培养基,每两天换液一次,诱导生成含有间充质干细胞的细胞群体;在第15天后,使用基于胰蛋白酶的消化液传代,一般情况下,经2-3次传代后,可得到符合间充质干细胞标准(isct标准,2006)的定型内胚层细胞来源的间充质干细胞(de-mscs)。
119.将实施例2制备获得的定型内胚层细胞来源的间充质干细胞进行检测,检测方法如下:
120.流式细胞分选术采用流式细胞仪(商购自bd,型号bd arir ii)进行纯化,通过tryple(37℃,5分钟)收获细胞,并用5%bsa进行中和。用具有1%bsa的dpbs洗涤后,将细胞重悬于dpbs中,通过bd arir ii进行纯化,然后将纯化后的细胞继续放于培养基中继续分化。
121.流式细胞术采用流式细胞仪(商购自bd,型号bd c6)进行测量,通过tryple(37℃,5分钟)收获细胞,并用5%fbs进行中和。用具有1%bsa的dpbs洗涤后,抗体孵育,洗涤后,将细胞重悬于dpbs中,通过bd c6进行分析。
122.本实施例提供的分化方案请参阅图8,检测结果请参阅图9-图11。
123.从图8可以看出,本实施例在第3天对纯化后的sox17阳性定型内胚层细胞继续进行后续阶段的分化培养,从图9和图10可以看出,第15天的细胞形态较为复杂,表示此时的细胞种类较多;经过2-3次传代后,在第24天时,细胞形态归为均一,是一种间充质干细胞典型的梭形细胞形态,提示间充质干细胞的形成。从图11可以看出,经纯化后的定型内胚层细胞来源的间充质干细胞能够高表达间充质干细胞特征阳性生物标志物(cd44、cd73、cd105)(三次重复实验,*p《0.05)。
124.综合图9-图11,可以看出,纯化后的(sox17阳性细胞百分比》95%)定型内胚层细
胞可以经本实施例的方法获得。在继续经过第三、四、五阶段后,经纯定型内胚层细胞生成的间充质干细胞(de-mscs)可以经本方法获得,并且,这些间充质干细胞满足国际干细胞协会(isct标准,2006)对间充质干细标准的要求。
125.实施例3
126.本实施例提供了一种定型内胚层细胞(de)来源的间充质干细胞的分化方法,其相较于实施例2而言,增加了在得到定型内胚层细胞后继续调节细胞信号通路有助于生成间充质干细胞。
127.具体实现如下:在e8培养基中培养人胚胎干细胞h9(sox17-gfp报告细胞系),每天更换新鲜培养基,当细胞密度达到70-80%时进行传代。首先用dpbs-edta洗涤2次,然后在室温下孵育5分钟,第3次抽吸dpbs-edta,并添加含有rock抑制剂5μm的e8培养基。重悬细胞后,以1:6的密度传代,加入预先包被matrigel的孔板。细胞贴壁1天后换e8培养基继续培养。待细胞长至30-60%时开始分化,第一天加入含chir99021-hcl 5μm和activin a 100ng/ml的第一分化培养基。分化第2天至第3天,去除chir99021,但维持activin a以诱导形成定型内胚层细胞。在第3天,采用流式细胞分选技术来纯化定型内胚层细胞。将定型内胚层细胞培养在msc生成培养基(第3-5天),并加入wnt通路激活剂包括chir99021(5μm)、wnt通路激活剂包括chir99021(5μm)/tgf通路抑制剂sb431542(10μm)获得中肠/后肠命运;在分化第5天至第15天,更换新鲜的msc生成培养基,每两天换液一次,诱导生成含有间充质干细胞的细胞群体;在第15天后,使用基于胰蛋白酶的消化液传代,一般情况下,经2-3次传代后,可得到符合间充质干细胞标准(isct标准,2006)的定型内胚层细胞来源的间充质干细胞(de-mscs)。
128.将实施例3制备获得的定型内胚层细胞来源的间充质干细胞进行检测,检测方法如下:
129.qpcr采用荧光定量pcr检测仪(型号为赛默飞quantstudio7)进行测量,用rnaiso-plus(takara,货号108-95-2)提取总mrna,并使用高容量cdna逆转录试剂盒(applied biosystems,货号4368813)进行从mrna到cdna的逆转录。使用sybr premix ex taq(takara,货号rr420)和quantstudio-7系统(applied biosystems)进行实时定量pcr。通过2^(-δct)方法计算扩增的核苷酸片段的相对量。将表达水平相对于管家基因tbp进行标准化,并与未分化的胚胎干细胞进行比较。
130.流式细胞术采用流式细胞仪(型号为:bd c6)进行测量,通过tryple(37℃,5min)收获细胞,并用5%fbs中和。用具有1%bsa的dpbs洗涤后,抗体孵育,洗涤后,将细胞重悬于dpbs中,通过bd c6进行分析。
131.本实施例提供的分化方案请参阅图12,检测结果请参阅图13-图15。
132.从图12可以看出,本实施例提供了在第3-5天中激活wnt通路并抑制tgf通路的方案,图13代表qpcr分析以测试chir99021、sb431542、xav939及其组合在第15天对cd44、cd73、cd105 mrna表达水平的影响。从图14可以看出,经过2-3次传代后,在第24天时,细胞形态归为均一,是一种梭形的细胞形态,提示间充质干细胞的形成。
133.从图15可以看出,de-mscs(fbs)表示de仅在fbs存在的条件下进行处理,de-mscs(chir)表示de在fbs存在的条件下用chir99021额外处理2天;de-mscs(chir/sb)表示de在fbs存在的条件下用chir99021和sb431542额外处理2天。在第24天时均为间充质干细胞阳
性标志物cd44、cd73、cd105、pdgfrβ阳性,间充质干细胞阴性标志物cd45阴性。
134.结合图13-图15,可以看出,在得到定型内胚层细胞后,继续激活wnt通路并抑制tgf通路有助于生成定型内胚层细胞来源的间充质干细胞,并且这些间充质干细胞满足国际干细胞协会(isct标准,2006)对间充质干细标准的要求。
135.实施例4
136.本实施例提供了一种定型内胚层细胞(de)来源的间充质干细胞的分化方法,经人胚胎干细胞系h1和人诱导多能干细胞系nl-1,同样能够经定型内胚层得到间充质干细胞。
137.具体实现如下:在e8培养基中培养人胚胎干细胞系h1和人诱导多能干细胞系nl-1,每天更换新鲜培养基,当细胞密度达到70-80%时进行传代。首先用dpbs-edta(商购自cell system,货号4z0-610)洗涤2次,然后在室温下孵育5分钟,第3次抽吸dpbs-edta,并添加含有rock抑制剂5μm的matrigel的孔板。细胞贴壁1天后换e8培养基继续培养。待细胞长至30-60%时开始分化,第一天加入含chir99021-hcl 5μm和activin a 100ng/ml的第一分化培养基。分化第2天至第3天,去除chir99021,但维持activin a以诱导形成定型内胚层细胞。在第3天,采用流式细胞分选技术来纯化定型内胚层细胞。将定型内胚层细胞培养在msc生成培养基(第3-5天);在分化第5天至第15天,更换新鲜的msc生成培养基,每两天换液一次,诱导生成含有间充质干细胞的细胞群体;在第15天后,使用基于胰蛋白酶的消化液传代,一般情况下,经2-3次传代后,可得到符合间充质干细胞标准(isct标准,2006)的定型内胚层细胞来源的间充质干细胞(de-mscs)。
138.流式细胞术采用流式细胞仪(商购自bd,型号bd c6)进行测量,通过tryple(37℃,5min)收获细胞,并用5%fbs进行中和。用具有1%bsa的dpbs洗涤后,抗体孵育,洗涤后,将细胞重悬于dpbs中,通过bd c6进行分析。
139.图16代表经nl-1和h1,定型内胚层细胞来源的间充质干细胞在第24天时的细胞形态,均呈梭形,显示具有间充质干细胞特征。
140.图17代表经nl-1和h1,定型内胚层细胞来源的间充质干细胞在第24天时均为间充质干细胞生物标志物(cd44和cd105)阳性。
141.图16和图17的结果显示,经人胚胎干细胞系h1和人诱导多能干细胞系nl-1,同样能够经定型内胚层得到间充质干细胞。
142.实施例5
143.定型内胚层来源的间充质干细胞具有治疗溃疡性结肠炎的潜能。
144.定型内胚层来源的间充质干细胞的分化方法同上,在得到de-mscs(fbs、fbs chir和fbs chir/sb条件下)后进行动物实验,以检测de-mscs治疗溃疡性结肠炎的潜能。具体方法如下:在饮用水中给予小鼠2%葡聚糖硫酸钠(dss)(商购自mp biomedical,分子量36,000-50,000),持续6天以构建结肠炎模型。在dss开始后的第3天和第4天,对治疗组内每只小鼠腹膜内注射5
×
106de-mscs(在fbs、fbs chir和fbs chir/sb条件下)或人uc-msc或等体积的pbs。从第0天到第14天每天测量小鼠的体重。在第14天,通过co2窒息对这些小鼠实施安乐死。尸检后,从每只小鼠身上解剖得到结肠并测量其长度。
145.从图18可以看出,相比于未注射间充质干细胞的小鼠,注射间充质干细胞组的小鼠体重恢复更快,表示小鼠结肠炎疾病状况恢复得更快。从图19和图20可以看出,相比于未注射间充质干细胞的小鼠,注射间充质干细胞组的小鼠的平均结肠长度显著更长。
146.综上所述,本技术提供的定型内胚层细胞来源的间充质干细胞的分化方法采用成分清晰的方法诱导人多能干细胞分化成定型内胚层细胞(de)和定型内胚层细胞(de)特异性的间充质干细胞(de-mscs)。更为重要的是,使用wnt通路激活剂、wnt通路抑制剂和tgf通路抑制剂联合使用短时间处理定型内胚层细胞(de)将有助于这些细胞获得中肠细胞、后肠细胞和前肠细胞命运;以上经人多能干细胞的定型内胚层细胞来源的间充质干细胞统称为de-mscs。经中肠/后肠细胞命运途径获得的de-mscs类似于人体小肠及大肠来源的mscs,适用于治疗以结肠炎、克罗恩氏病为代表的消化道相关疾病。本技术提供了一种高效制备经人多能干细胞衍生的定型内胚层来源的间充质干细胞的体外分化方法。且这些de-mscs能够在体外刺激的条件下分泌抗炎因子,进一步地,这些经腹腔注射的de-mscs具有治疗小鼠结肠炎的潜力。
147.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1