一种安那格列汀的制备方法与流程
1.本发明属于化学药物合成技术领域,具体涉及一种抗糖尿病药物安那拉格列汀的制备方法。
背景技术:
2.二肽基肽酶-4(dipeptidyl peptidase 4,dpp-4)是抗ii型糖尿病的新靶点之一,其抑制剂的研发已经成为当今抗糖尿病药物研究的热点。dpp-4抑制剂通过抑制dpp-4 降解glp-1的作用,从而提高内源性胰高血糖素样肽-1(glucagon-like peptide-1,glp-1)和葡萄糖依赖性促胰岛素释放多肽(glucose-dependent insulinotropic peptide, gip)的水平,以达到降糖效果。此外,dpp-4抑制剂还可纠正α细胞功能异常引起的胰高血糖素不适当分泌,进而调节血糖平衡,有效地防止低血糖的发生。传统抗糖尿病药物的不良反应以及glp-1类似物注射的不便性,使dpp-4抑制剂具有口服便利性等优点。
3.安那拉格列汀(anagliptin),又名阿拉格列汀、安奈格列汀,是由日本株式会社三和化学研究所开发,2012年11月获批上市的治疗ii型糖尿病药物,商品名为“suiny”。安那拉格列汀是一种高选择性二肽基肽酶-iv(dpp-4)抑制剂,ic
50
值为3.8nm。它通过选择性、持续性抑制dpp-4增强胰高血糖素样肽(glp-1)和肠抑胃肽(gip)的活性而发挥降血糖的作用。阿拉格列汀可能单用或与其它降糖药联合应用,其作用机制独特,具有不产生低血糖、不引起体重增加、安全且耐受性好等优势。因此,对糖尿病药物dpp-4抑制剂相关品种的中间体及原料药合成工艺研究将具有潜在的市场价值和社会效益。
4.安那拉格列汀英文名为:n-[2-[[2-[(2s)-2-cyanopyrrolidin-1-yl]-2-oxo-ethyl]amino]-2
‑ꢀ
methylpropyl]-2-methylpyrazolo[1,5-a]pyrimidine-6-carboxamide,cas:739366-20-2。该药物分子含有(2s)-n-乙酰基-2-氰基四氢吡咯啶、1,2-二氨基-2-甲基丙烷及甲基-吡唑并 [1,5-a]嘧啶-6-羧酸核心片段,其结构式如下:
[0005][0006]
目前文献及公开专利路线综合起来,主要有以下几种:
[0007]
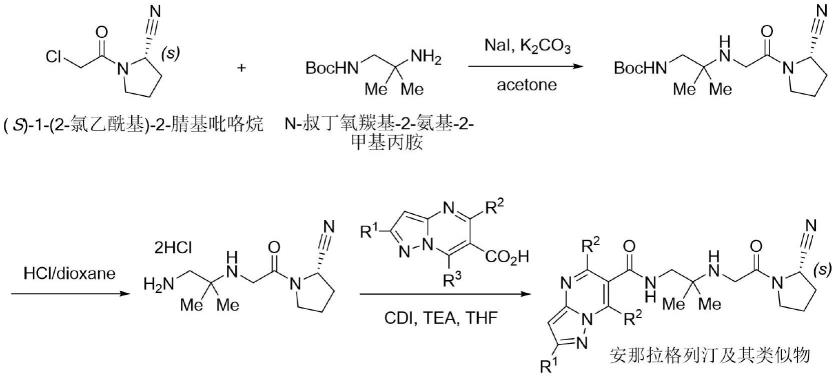
有文献(bioorg.med.chem.2011,19,7221.)及相关专利wo2014034626a1 (cn10452030a)报道了对安那拉格列汀及其类似物的合成。2-氨基-2-甲基丙胺先用 boc2o单边保护、经与(s)-1-(2-氯乙酰基)-2-腈基吡咯烷发生缩合反应、再脱除boc保护基、最后与带取代基的吡唑并[1,5-a]嘧啶-6-羧酸在缩合条件下(cdi/tea)反应即可制备安那拉格列汀(r1=me,r2=r3=h)及其类似物。2014年,文献(org.process res. dev.,2016,20,940.)进一步研究优化了安那拉格列汀原料药的合成工艺,具体合成路线如下:
[0008][0009]
wo2015150887a等专利公开了先将2-甲基吡唑并[1,5-a]嘧啶-6-羧酸与1,2-二氨基
ꢀ‑
2-甲基丙烷缩合,再与1-(二苯基亚甲基)氨基-2-氨基-2-甲基丙烷发生取代反应即得到安那拉格列汀,合成路线如下:
[0010][0011]
2015年,济南百诺(cn104693065b)提出了一种制备中间体1-(二苯基亚甲基) 氨基-2-氨基-2-甲基丙烷的新方法。该中间体先和(s)-1-(2-氯乙酰基)-2-腈基吡咯烷在碱性条件下发生亲核反应,再在酸性条件下发生亚胺的水解反应脱除二苯基亚甲基保护基得到中间体(s)-1-((1-amino-2-methylpropan-2-yl)glycyl)pyrrolidine-2-carbonitrile,最后与吡唑并[1,5-a]嘧啶-6-羧酸发生缩合反应制备安那拉格列汀,合成路线如下:
[0012][0013]
另外,wo2014147640公开了使用l-脯氨酰胺为起始原料,先制备得到(s)-1-(2
‑ꢀ
氯乙酰基)吡咯烷-2-羧酰胺中间体,再与n-叔丁氧羰基-2-氨基-2-甲基丙胺反应,最后脱
除保护基后,再与2-甲基吡唑并[1,5-a]嘧啶-6-羧酸缩合的方法。由于酰胺化合物的溶解性普遍较差,使用l-脯氨酰胺为起始原料,在制备过程中相关中间体的分离纯化也较为困难。wo2016193988a1,cn104974160以及cn104974159也报道了制备2-甲基吡唑并[1,5-a]嘧啶-6-羧酸活化酯的方法,避免缩合反应过程中使用昂贵的缩合试剂。
[0014]
综上所述,已公开资料中大多是采用(s)-1-(2-氯乙酰基)-2-腈基吡咯烷为关键中间体,在后续与氨基片段的sn2取代反应、脱除基保护基(boc)以及与吡唑并[1,5-a]嘧啶-6-羧酸的缩合反应过程中,由于氰基在酸、碱条件下的不稳定性质,导致酰胺杂质生成以及氰基手性中心发生外消旋化等问题。本发明提供一种制备安那拉格列汀的方法,旨在规避目前制备安那拉格列的专利壁垒和解决现有合成路线中氰基易水解产生杂质及手性中心的外消旋化等问题。
技术实现要素:
[0015]
针对现有技术的不足,本发明的目的在于提供一种安那拉格列汀的制备方法。本发明中,通过采用更稳定的n-(2-氯乙酰基)-l-脯氨酸酯式(i)为起始物料,依次通过sn2取代反应、脱除氨基保护基、缩合反应、氰基化反应步骤制备那拉格列汀。该路线具有原料试剂方便易得、路线简洁、反应条件相对温和、产品质量稳定的特点。
[0016]
为达到此发明的目的,本发明采用以下技术方案:
[0017]
本发明中以l-脯氨酸为原料制备得到的n-(2-氯乙酰基)-l-脯氨酸酯式(i)为起始物料,先与胺基片段式(ii)发生sn2取代反应,再与吡唑并嘧啶羧酸片段式(vi) 进行缩合反应制备得到式(vi)的化合物。最后将羧基甲酯/苄酯在一定条件下转化为腈基吡咯即可制备安那格列汀式(vii)。该合成工艺采用了线性合成策略,先将各个分子片段进行线性连接,最后阶段引入氰基;避免了氰基官能团在反应过程中对酸、碱稳定性较差引起的各种问题。
[0018]
本发明中所述的脯氨酸酯式(i)的结构式为,所述二胺式(ii)的结构为,所述式(iii)的结构为,所述式(iv)的结构为,所述式(v)的结构式为,所述式(vi)的结构为,其中r1选自h、甲基、乙基、苄基、取代苄基中的一种。x选自氯、溴、碘、oms、ots中的一种。r2选自叔丁氧羰基(boc)、苄氧羰基 (cbz)、芴甲氧羰基(fmoc)中的一种。
[0019]
本发明提供一种安那拉格列汀式(vii)的制备方法,包括以下反应步骤:
[0020]
(1)亲核取代(sn2)反应:在碱性条件下,n-(2-氯乙酰基)-l-脯氨酸酯式(i) 为起始片段,先与胺基片段式(ii)在碱性条件下发生亲和取代得到中间体化合物式 (iii)。
[0021][0022]
所述的碱为有机碱或无机碱中的一种,所述的有机碱为甲醇钠、乙醇钠、叔丁醇钠、吡啶、三乙胺、二异丙基乙胺或dbu,所述的无机碱为nah、naoh、koh、nahco3、 na2co3、k2co3、csf、cs2co3和k3po4中的一种;所述的碱的用量为化合物式(i) 的1.0—3.0倍摩尔当量。反应中所使用的溶剂有thf,h2o,二氧六环中的一种或多种。
[0023]
(2)脱保护基(r2)反应
[0024][0025]
化合物式(iii)在一定条件下脱除r2保护基,包括酸性条件下脱出boc保护基(r2=boc);或者催化氢化条件下脱除cbz保护基(r2=cbz);或者在碱性条件下脱除fmoc 保护基,生成式(iv)的化合物或其盐酸盐、甲磺酸盐、对家苯磺酸盐形式,优选的盐为化合物式(iv)的盐酸盐。
[0026]
(3)化合物式(iv)与吡唑并嘧啶羧酸片段式(v)进行缩合反应制备得到式(vi) 的化合物。
[0027][0028]
缩合条件为常规对羧酸的酰胺化反应,所述的缩合剂选自二环己基碳二亚胺 (dcc)、n-(3-二甲氨基丙基)-ν
’‑
乙基碳二亚胺及其盐酸盐(edci)、ν,ν
’‑
羰基二咪唑(cdi),但不局限于使用缩合剂进行缩合。
[0029]
嘧啶羧酸式(v)和化合物式(iv)的缩合反应所采用的温度为0℃至室温下完成,适当加热可加速反应的进行;缩合反应所使用的有机溶剂为现有的缩合反应中常用的溶剂,较佳的为n,n-二甲基甲酰胺、二氯甲烷、乙腈、四氢呋喃、二甲亚砜、二氧六环中的一种或多种;缩合反应中使用的碱为常用的有机碱或无机碱,如吡啶、 nahco3、kf、khco3、k2co3、na2co3、三乙胺和i-pr2net中的一种或多种;所述的碱的用量为化合物式(iv)的2.0-5.0倍摩尔当量。
[0030]
(4)氰基化反应:化合物式(vi)中的羧酸酯(-co2r1)转化成氰基(-cn)即可制备得到安那拉格列汀式(vii)。
[0031][0032]
化合物式(vi)中的羧酸酯(-co2r1)转化成氰基(-cn)即可制备得到安那拉格列汀式(vii),其特征在于,方法为:将化合物式(vi)依次脱除保护基,再接入活化酯/酰胺化或不经过脱除酯基保护基直接酰胺化,最后发生脱水反应转化成氰基。
[0033]
所述脱除酯基保护基的方法包括使用碱性水解条件或者催化氢化;
[0034]
所述活化试剂包括dcc、dic、edci、cdi、n-羟基琥珀酰亚胺、1-羟基苯并三唑(hobt)、6-氯-1-羟基苯并三唑、1-羟基-7-偶氮苯并三氮唑(hoat)、nmm/clco2bui、 clco2et、clco2pr以及hatu、hbtu等碳鎓盐中的一种或多种组合;
[0035]
所述羧基缩合活化酯反应中使用的碱包括nmm、dipea、tea、tba,py,优选为nmm;
[0036]
所述酰胺化反应的氨化试剂包括nh4hco3、(nh4)2co3、nh4oac、nh4cl、氨水、氨;
[0037]
所述脱水反应包括使用(cf3co)2o、(cf3so2)2o、pocl3、socl2、n-(三乙胺基硫酰)氨基甲酸甲酯、n-甲基-n-三甲基硅基三氟乙酰胺等试剂,优选为(cf3co)2o。
[0038]
本发明的有益效果:该合成工艺采用了线性合成策略,以l-脯氨酸酯为起始原料,先将各个分子片段进性连接,最后转化引入氰基;避免了氰基在反应过程中对酸、碱稳定性较差引起的各种问题。该路线具有原料试剂方便易得、路线简洁、反应条件相对温和、产品质量稳定以及易于商业化生产的特点。
具体实施方式
[0039]
通过下面的实施例可以更具体的理解本发明,在本领域内的技术人员对本发明所做的简单更换和改进等均属于本发明所保护的技术方案之内,举例说明而不是限制本发明的范围。
[0040]
实施例1:n-(2-氯乙酰基)-l-脯氨酸甲酯的合成
[0041][0042]
将l-脯氨酸(12.0g,104mmol)溶于150ml无水甲醇的溶液冷却至0℃左右,向其中缓慢滴加氯化亚砜(18.0g,151.2mmol),反应混合物缓慢升温至室温下继续搅拌反应6小时。减压蒸馏脱除溶剂,真空抽干即得l-pro-ome-hcl粗品为无色透明油状物。取以上粗品(8.0g,43mmol)溶于150ml无水二氯甲烷中,冷却至0℃左右,向其中加入三乙胺(12ml,86mmol),再滴加氯乙酰氯(3.72g,47mmol),反应混合物置于室温下继续反应6小时至原料转化完全。加入100ml水淬灭反应,混合物分液,水相再用二氯甲烷萃取二次。有机相合并经水洗、无水硫酸钠干燥、浓缩、残留物经硅胶柱层析纯化得n-(2-氯乙酰基)-l-脯氨酸甲酯(7.85g,28mmol)为无色油状物。
[0043]
实施例2:化合物式(iii)(r1=me,r2=cbz)的合成
[0044][0045]
将n-(2-氯乙酰基)-l-脯氨酸甲酯(23.0g,112mmol)、n-cbz-2-氨基-2-甲基丙氨 (24.5g,112mmol)、粉末状k2co3(18.5g,134mmol)、nai(5.0g)与300ml丙酮的混合物置于室温下(25℃-30℃)搅拌反应4小时左右至原料转化完全。加入水使固体完全溶解,减压浓缩整除大部分丙酮,加入乙酸乙酯和水分液,水相经乙酸乙酯萃取三次,合并有机相经无水硫酸钠干燥。有机相经浓缩析出大量固体,加入庚烷洗一次,过滤所得固体经真空干燥即得式(iii)的化合物(36.0g,83%)。1h nmr(400mhz, cd3od)δ7.28-6.80(m,5h),4.93(s,2h),4.72(m,1h),3.55(s,3h),3.64-3.40(m,2h), 3.28(m,2h),3.14-3.07(m,2h),2.20-2.13(m,4h),1.04(s,6h)。
[0046]
实施例3:化合物式(iv)(r1=me)的合成
[0047][0048]
化合物式iv(32.0g,81.7mmol)溶于的150ml无水甲醇溶液,加入5%pd/c(200 mg),在1atm h2条件下催化氢化。反应液过滤,滤液浓缩析出固体,固体用经庚烷洗涤后真空干燥即得式iv的化合物(19.0g,90%)为白色固体。1h nmr(400mhz, cd3od)δ4.91-4.88(m,1h),4.27-4.17(m,2h),3.81-3.75(m,1h),3.66-3.60(m,1h), 3.54(s,3h),3.46-3.39(m,2h),2.35-2.18(m,4h),1.54(s,6h)。
[0049]
实施例4:化合物式(vi)(r1=me)的合成
[0050][0051]
将2-甲基吡唑并[1,5-a]嘧啶-6-羧酸(23.0g,130mmol)溶于250ml无水二氯甲烷中,向其中加入1,1-二羰基二咪唑(25.0g,154mmol),室温下搅拌反应3小时左右至反应进行完全。向以上反应液中,加入式iv的化合物(33.5g,130mmol)溶于100ml 无水二氯甲烷的溶液,混合物至于室温下搅拌10-12小时至反应进行完全。加入水淬灭反应,静置分液,水相经二氯甲烷萃取2次,合并有机相干燥、浓缩,所得粗产品用乙酸乙酯共蒸馏浓缩1-2次,固体过滤,干燥即为式(vi)的化合物(50.0g,92%)为白色固体。hplc purity:98.5%,chiral purity by hplc:100%。
[0052]
实施例5:安那拉格列汀式(vii)的制备
[0053][0054]
将式(vi)(r1=me)的化合物(15.0g,36.0mmol)溶于100ml无水甲醇中,向其中加
入7n nh3/meoh(10.0ml)溶液。混合物加热至60℃左右反应直至原料转化完全。减压浓缩整除溶剂,所得固体经真空干燥。将所得粗产物溶于120ml无水二氯甲烷中,混合物冷却至-78℃下,滴加三乙胺(5.6ml,42.8mmol),大约30分钟后,缓慢滴加tfaa(6.0ml,42.8mmol)。反应混合物自然升温至25-30℃下继续搅拌反应2小时至反应完全。加入冰水淬灭反应,分液,有机相用二氯甲烷萃取2次,合并有机相依次经水洗、无水硫酸钠干燥、过滤、滤液浓缩,所得残留物经柱层析纯化即得安那拉格列汀(vii)(11.8g,85%)为白色固体。hplc purity:99.4%,chiral purity byhplc:99.9%。1h nmr(400mhz,d
6-dmso)δ9.42(s,1h),8.82(s,1h),8.46(s,1h), 6.60(s,1h),4.73(m,4h),3.63-3.40(m,5h),3.27-3.25(m,2h),2.43(s,3h),2.14-2.00(m, 4h),1.04(s,6h)。
[0055]
实施例6:安那拉格列汀式(vii)的制备
[0056][0057]
将式(vi)(r1=bn)的化合物(24.0g,28.2mol)溶于150ml无水甲醇中,向其中加入5%pd/c(200mg),在1atm h2下,常压催化氢化。待反应完毕,过滤,滤液减压浓缩,所得中间体真空干燥。中间体粗品溶于120ml无水二氯甲烷中,冷却至-10 ℃左右,加入三乙胺(4.7ml),缓慢滴加clco2et(3.7g,34.1mmol),反应月1小时左右,向其中加入nh4hco3(27g),混合物置于室温下继续搅拌反应2小时。冷却至
ꢀ‑
10℃,向其中加入三聚氯氰(2.0g)溶于10ml的dmf溶液。混合物置于室温下继续搅拌反应2小时转化完全。反应混合物加入冰水淬灭,用二氯甲烷萃取两次,合并有机相经过无水硫酸钠干燥,有机相过滤,浓缩,残留物用硅胶柱层析纯化即制备得到安那拉格列汀(vii)(14.0g,75%)为白色固体。hplc purity:98.9%,chiral purity byhplc:99.9%。
[0058]
实施例7:安那拉格列汀式(vii)的制备
[0059][0060]
将式(vi)(r1=me)的化合物(12.0g,28.8mmol)溶于60ml无水甲醇中,向其中加入7nnh3/meoh(8.0ml)溶液。混合物加热至60℃左右反应直至原料转化完全。减压浓缩蒸出溶剂,所得固体经真空干燥。将所得粗产物溶于60ml无水四氢呋喃中,混合物冷却至-10℃下,加入三乙胺(6.5ml),再缓慢滴加tf2o(9.5g,33.7 mmol),反应混合物自然升温至25-30℃下继续搅拌反应2小时至反应完全。加入冰水淬灭反应,分液,有机相用二氯甲烷萃取2次,合并有机相依次经水洗、无水硫酸钠干燥、过滤、滤液浓缩,所得残留物经柱层析纯化即得安那拉格列汀(9.0g,82%) 为白色固体。hplc purity:99.4%,chiral purity by hplc:99.9%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1