一种成年鸡卵原干细胞的体外分离培养方法及其应用
本发明涉及干细胞培养,具体涉及一种成年鸡卵原干细胞的体外分离培养方法及其应用。
背景技术:
1、女性的生殖衰老与卵巢功能的丧失密切相关,卵母细胞数量和质量的减少是女性生殖衰老的标志性特征。现已有大量研究支持雌性生殖系干细胞(即为卵原干细胞(oscs))仍然具有再生潜力,其在出生后的卵巢中支持卵母细胞的更新(germline stem cells andfollicular renewal in the postnatal mammalian ovary.nature;location andcharacterization of female germline stem cells(fgscs)in juvenile porcineovary.cell proliferation),这为治疗女性不孕症以及减缓卵巢老化开辟了新的有效途径。
2、生殖是一切生命体的基本特征之一,物种的延续必须依赖于生殖,而生殖细胞是直接执行该生物学功能的细胞。传统发育学观点认为,雌性动物的成年卵巢内不存在卵原干细胞(on regenerating the ovary and generating controversy.cell)。随着分子生物学发展,2009年吴际教授团队首次从新生和成年的小鼠卵巢内分离出卵原干细胞并对其生物学特性进行表征(production of offspring from a germline stem cell linederived from neonatal ovaries.nature cell biology),从而证实在成年哺乳动物卵巢中存在卵原干细胞。并利用卵原干细胞成功构建基因修饰动物模型,后通过在小鼠卵巢内追踪移植后的卵原干细胞的发育情况,发现长期培养的卵原干细胞在移植到受体的卵巢后,仍保持了其产生功能性卵母细胞和可育后代的能力。此后,研究人员在人、猪、羊、牛和兔等的卵巢组织中,都发现了卵原干细胞的标志性基因和蛋白的表达,同时这些卵巢生殖干细胞能够在体外培养条件下形成克隆并保持正常核型(in vitro differentiation ofhuman oocyte-like cells from oogonial stem cells:single-cell isolation andmolecular characterization.human reproduction;characteristics of femalegermline stem cells from porcine ovaries at sexual maturity.celltransplantation;further characterization of adult sheep ovarian stem cellsand their involvement in neo-oogenesis and follicle assembly.journal ofovarian research;bovine ovarian stem cells differentiate into germ cells andoocyte-like structures after culture in vitro.reproduction in domesticanimals;detection,characterization,and spontaneous differentiation in vitroof very small embryoniclike putative stem cells in adult mammalian ovary.stemcells and development)。这些结果表明在哺乳动物中已经成功建立了较完善的卵原干细胞体外分离培养系统,并且可支撑其分化成为功能性的卵母细胞,为不孕不育及相关疾病诊治和生育力保存提供技术平台和理论依据,也为卵原干细胞的临床应用奠定基础。
3、按传统发育学观点,鸡出生后原始卵泡库和卵母细胞的数目也已经固定不再增加(actions of anti-müllerian hormone on the ovarian transcriptome to inhibitprimordial to primary follicle transition.reproduction)。但随着生物技术的高速发展,在物种进化中占重要地位的鸟类,畜禽中重要的经济动物鸡,是否跟以上报道的哺乳动物一样,成年卵巢中依然存在着少量卵原干细胞,以及这种细胞该如何进行分离纯化,体外扩繁和功能鉴定,目前尚无任何相关报道。
技术实现思路
1、针对上述现有技术,本发明的目的是提供一种鸡卵原干细胞的体外分离培养方法及其应用。本发明开创性的从成年鸡卵巢中体外分离培养得到鸡卵原干细胞,能够为延长鸡的产蛋周期、提高鸡的繁殖性能提供新的思路的途径。
2、为实现上述目的,本发明采用如下技术方案:
3、本发明的第一方面,提供一种鸡卵原干细胞的体外分离培养方法,包括以下步骤:
4、(1)将成年鸡卵巢的皮质部分破碎成组织团块,用包含双抗的pbs缓冲液漂洗,静置后得到下层的组织团;用0.25%胰酶消化处理组织团,将消化处理后的组织团用磁珠活化细胞分选缓冲液进行重悬,加入一抗,孵育10-20min;然后再加入anti-mouse igm二抗磁珠,共孵育20-30min;用磁珠活化细胞分选缓冲液进行洗脱,即去除未结合磁珠的阴性细胞,洗脱步骤至少重复3次,收集包含目的细胞的洗脱液。将最后的与磁珠结合的目的细胞使用基础培养液重悬,平铺在鸡胚成纤维细胞饲养层上进行培养。
5、(2)将包含目的细胞的洗脱液依次进行原代培养、传代培养,即体外分离培养得到鸡卵原干细胞。
6、优选的,步骤(1)中,所述包含双抗的pbs缓冲液中含有的双抗为1xantibiotic-antimycotic(抗生-抗真菌剂)。
7、优选的,步骤(1)中,所述一抗为阶段特异性胚胎抗原-1(ssea-1)。
8、优选的,步骤(1)中,所述磁珠活化细胞分选缓冲液为1%(体积分数)胎牛血清和2mm edta的d-pbs缓冲液。
9、优选的,步骤(2)中,所述原代培养是以鸡胚成纤维细胞作为饲养层;以包含体积分数为2.5%鸡血清、体积分数为7.5%胎牛血清、1.2mm丙酮酸钠、1xantibiotic-antimycotic、1x glutamax、1x embryomax nucleosides、0.1mmβ-巯基乙醇、1x neaa、1xb-27supplement、6ng/ml hfgfb和25ng/ml human activin a的ko-dmem培养基为鸡卵原干细胞基础培养液。
10、优选的,步骤(2)中,原代培养的条件为:39℃、5%co2。
11、优选的,步骤(2)中,所述传代培养是将处于对数生长期的鸡卵原干细胞克隆吸出,用胰酶消化处理,分散成单细胞或若干小细胞团后接种至新的鸡胚成纤维细胞饲养层上继续培养。
12、本发明的第二方面,提供上述体外分离培养方法得到的鸡卵原干细胞。
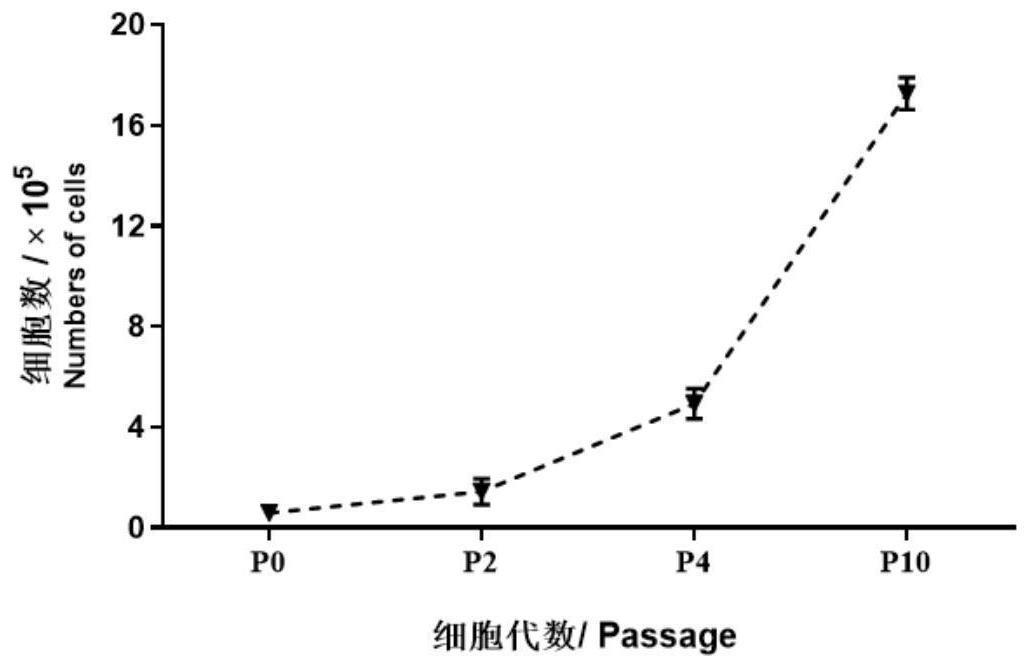
13、本发明的第三方面,提供上述鸡卵原干细胞在如下(1)或(2)中的应用:
14、(1)延长鸡的产蛋周期;
15、(2)提高鸡的繁殖性能。
16、本发明的有益效果:
17、(1)鸡是一种重要经济动物,如何开发保护我国优秀种质遗传资源是禽类生产中的迫切问题。本发明开发了一种在体外纯化分离且稳定扩繁鸡卵原干细胞的培养系统,通过本体系培养的鸡卵原干细胞可进行传代扩繁,且保有稳定的生殖干细胞特性、增殖能力和定向迁移能力,而不丧失种系能力。保持卵母细胞样细胞的分化潜能对于鸡优秀种质资源的获得、保种和改良具有重要的意义。
18、(2)本发明提供的卵原干细胞的体外分离方法,适用于禽类动物成年卵巢的卵原干细胞的分离培养。同时,鸟类的生殖细胞(包括原始生殖细胞和卵原干细胞等)与其他物种的生殖细胞有较大区别,含有脂质和糖类成分较多,其他物种的生殖细胞培养技术流程无法在鸟类生殖细胞中应用,迫切需要开发和优化鸟类特别是鸡的卵原干细胞的分离培养标准化流程。此外,存在于成年卵巢中的卵原干细胞细胞数量占比极其少,且鸡的成年卵巢中细胞组分较为复杂,除了卵原干细胞和卵母细胞以外,还有大量的其他体细胞,如颗粒细胞,膜细胞和基底层细胞等。因此,卵原干细胞的体内生存环境决定了其分离培养条件极为困难,环境的改变也意味着胚胎生殖干细胞的分离培养条件无法用于成年鸡卵巢的卵原干细胞。本发明所介绍的细胞分离纯化培养技术,是首次高效应用在成年鸡的卵原干细胞中,分离培养的鸡卵原干细胞长期稳定培养条件下会形成典型的胚胎干细胞样细胞克隆团。
19、(3)本培养体系可显著促进鸡卵原干细胞的体外增殖效率,经长期传代实验统计平均4天左右细胞数量可扩繁一倍。同时经鉴定传代后的卵原干细胞依然保有干细胞和生殖细胞特性,其呈现ssea-1和ddx4双阳性,且保留有干性基因ssea-3、sox2和nanog表达,以及生殖标记基因prdm1和dazl等的表达,将体外长期培养的卵原干细胞重新导入发育2.5天的鸡胚血管中,卵原干细胞可以定植归巢至早期性腺中,具备生殖干细胞的迁移特性和发育为卵母细胞的潜力。
20、(4)卵原干细胞是一种极有应用前景的遗传资源,本发明提供的卵原干细胞培养方法,便于对鸡卵原干细胞进行体外深入研究,有望在畜牧生产中为深入挖掘母鸡产蛋性能和延长母鸡产蛋周期等养殖育种中的瓶颈问题服务。
- 还没有人留言评论。精彩留言会获得点赞!