一种脂肪细胞分化相关遗传元件及其在检测牛脂肪细胞分化中的应用
1.本发明属于分子遗传学技术领域,具体涉及一种利用lncrna420遗传修饰元件检测肉牛脂肪细胞分化的方法。
背景技术:
2.脂肪细胞分化和脂质代谢是一个复杂的生物过程,包括多个基因和转录因子的共同调控。牛肉品质受多种因素影响,很多肉质性状都与脂肪沉积相关。脂肪是人体储存和供应能量的重要物质,所以对脂肪细胞分化机制的研究对肉牛的生长过程及脂肪沉积代谢过程的研究都具有极其重要的价值。
3.长链非编码rna(lncrna)构成一类功能性的非编码rna,它们是长度超过200个核苷酸的转录本,没有蛋白质编码潜能。lncrna不仅可以在转录水平上受到调控,而且可以在转录后水平上得到调控。实验研究表明,lncrna可以参与脂肪细胞的生长与发育,增殖和分化,以及能量代谢过程,从而影响脂质代谢的相关途径,并在许多其它生物过程中发挥重要作用。而在脂肪细胞分化和脂肪沉积、代谢过程中,更多的lncrna以及它们的作用还需进一步挖掘。
4.肌内脂肪分化和沉积是影响牛肉品质和肉牛选育重要的目标性状,其形成的生物学机制非常复杂,涉及多基因遗传互作及遗传修饰元件等表观调控方式。因此揭示lncrna在肉牛脂肪细胞分化及肌内脂肪沉积代谢过程中的分子调控作用对肉牛品种选育有着重要作用,可为挖掘新的肉质性状候选基因和调控元件提供技术依据。
技术实现要素:
5.本发明首次发现lncrna420的表达与牛脂肪细胞分化相关,在牛的不同部位脂肪组织中,lncrna420的表达水平不同,并随着牛前体脂肪细胞分化程度的增加,lncrna420的表达水平不断降低,通过检测lncrna420的可以鉴定不同部位脂肪组织中脂肪细胞的分化程度,当增量表达lncrna420的表达水平时可以抑制脂肪细胞的分化,为牛脂肪沉积和脂质代谢的研究提供新的方法。由此完成本发明。
6.本发明提供一种脂肪细胞分化相关遗传元件,其特征在于:所述遗传元件为lncrna420,核苷酸序列为seq id no.1所示。
7.进而提供含有所述的遗传元件重组载体。
8.还提供含有所述的遗传元件重组细胞。
9.本发明还提供所述的遗传元件在调控牛脂肪细胞生长发育或分化中的应用。具体地,在牛前体脂肪细胞中增量表达所述的遗传元件。更具体地,在原代牛前体脂肪细胞中通过构建增量表达载体增强所述的遗传元件的拷贝数,以抑制牛前体脂肪细胞分化和/或脂质代谢。
10.本发明也提供一种检测牛脂肪细胞是否分化的试剂,其特征在于,通过核酸扩增
技术检测所述的遗传元件的表达水平。具体地,核酸扩增技术采用的上游引物序列为seq id no.2,下游引物序列为seq id no.3。尤其是用于肉牛脂肪细胞分化的检测。
11.本发明还提供一种检测牛脂肪细胞是否分化的方法,其特征在于,通过检测牛脂肪细胞中的所述遗传元件的表达水平,如果表达量增加则表示牛脂肪细胞已经分化为成熟脂肪细胞。优选地,通过所述的试剂进行检测,尤其是用于肉牛脂肪细胞分化的检测。
附图说明
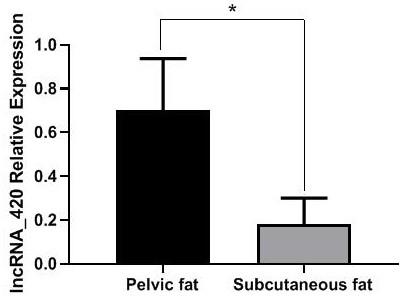
12.图1为lncrna420在不同部位脂肪组织中的表达水平。
13.图2为lncrna420在牛前体脂肪细胞和成熟脂肪细胞中的表达情况。
14.图3为油红o方法检测lncrna420对牛前体脂肪细胞分化的影响。
15.图4为rt-qpcr检测分化相关基因的表达变化的结果。
具体实施方式
16.通过以下实施例进一步举例描述本发明,并不以任何方式限制本发明,在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动或改变都将落入本发明的权利要求范围之内。
17.实施例1、lncrna420的获取本发明涉及的lncrna420为前期进行肉牛脂肪全转录组测序筛查的与脂肪细胞分化相关的候选lncrna。
18.样品:分别收集1月龄肉用公牛的脂肪组织,用锡纸包好后迅速投入液氮中,置于-80
°
c保存。
19.试剂:trizol total rna提取液购自天根生化科技有限公司(北京);cdna第一链合成试剂盒购自takara(日本);2
×
taq master mix购自takara(日本)。
20.1)总rna的提取从-80
°
c冰箱中取组织块,加入液氮研磨,称取研磨后的粉末1g,加入1ml trizol。每个ep管中加入提前预冷好的三氯甲烷200μl,剧烈震荡20-30s,室温下孵育10min,4℃离心(12000g,15min)。离心后的液体分为3层(上层为无色透明状液体,为rna;中层为白色絮状物,为dna;下层为粉色油状液体,为蛋白质),小心吸取上清液450μl至新的1.5ml ep管中,加入等体积提前预冷的异丙醇,上下轻柔振荡混匀,室温沉淀15min后,4℃离心(12000g,15min)。弃掉上清,加入1ml提前预冷的75%乙醇depc溶液,吹打混匀后,4℃离心(7500g,5min)。在超净台中,小心吸取少量残留的液体,打开上盖放置2-3min,以充分去除残留溶液,白色沉淀即为rna。待沉淀变成半透明状时,向沉淀中加入20-50μldepc水,用移液枪吹打至沉淀完全溶解后进行rna质量和浓度的检测。琼脂糖凝胶电泳方法检测rna样品纯度、使用nanodrop 2000 spectrophotometer检测rna样品浓度、完整性和是否有基因组dna或蛋白质污染等。剩余的rna于-80℃冰箱保存。
21.2)反转录第一步去除总rna中的基因组dna,1μg rna和去除基因组试剂总体积为10μl,室温条件下5min;第二步将总rna反转录成cdna,上述混合液、缓冲buffer以及反转录酶等总体积为20μl,37℃反应15min,85℃反应5s,于-20℃保存。
22.3)pcr扩增根据lncrna420的dna序列(seq id no.1),通过primer 6软件设计lncrna420扩增引物,具体如下:lncrna420的上游引物为gtgcttttgacttagggattgc;下游引物为aaccagggcgttgataacag。反应体系如下:c 10μl,lncrna420特异性扩增上、下游引物0.5μl,cdna4μl,ddh2o补足到20μl。pcr扩增条件为:预变性95
°
c持续5min;95
°
c持续30 s,60
°
c持续30 s和72
°
c持续20 s的40个循环。pcr扩增后进行琼脂糖凝胶电泳,分析所得3862bp基因片段大小。
23.实施例2、lncrna420的空间表达特性样品:分别收集一月龄荷斯坦公牛用于采集不同部位脂肪组织,用锡纸包好后迅速投入液氮中,置于-80
°
c保存。
24.试剂:trizol total rna提取液购自天根生化科技有限公司(北京);cdna第一链合成试剂盒购自takara(日本);实时荧光定量试剂盒购自roche(德国)。
25.根据lncrna420的dna序列(seq id no.1),通过primer 6软件设计lncrna420定量引物,具体如下:lncrna420的上游引物:5
’‑
gtgcttttgacttagggattgc-3’(seq id no.2)下游引物:5
’‑
aaccagggcgttgataacag-3’(seq id no.3)β-actin的上游引物:5
’‑
gcaggtcatcaccatcgg-3’(seq id no.4)下游引物:5
’‑
ccgtgttggcgtagaggt-3’(seq id no.5)按照实施例1中的方法对各组样品提取总rna和反转录,在进行荧光定量pcr。
26.荧光定量pcr反应总体积为10μl,其中2
×
faststart universal sybr green master (rox)为5.0μl,上下游引物各0.2μl,cdna为1.0μl,水3.6μl,pcr扩增条件为:95
°
c 持续5min;95
°
c持续30 s,60
°
c持续30 s和72
°
c持续20 s的40个循环。每个样品技术重复3次,应用2-δδct
法分析结果。
27.结果如图1所示,lncrna420在牛腹部脂肪中的表达量高于在皮下脂肪中的表达量,预示lncrna420与不同位置的脂肪沉积差异有关,同样这也证明了lncrna具有时空表达特异性,在不同组织中的表达水平存在差异。
28.实施例3、lncrna420的时序表达特性样品:利用酶消化法从一月龄犊牛的腹部脂肪组织分离原代前体脂肪细胞,之后诱导分化前体脂肪细胞,最后分别收集牛的前体脂肪细胞和分化后的成熟脂肪细胞。
29.试剂:trizol total rna提取液购自天根生化科技有限公司(北京);cdna第一链合成试剂盒购自takara(日本);实时荧光定量试剂盒购自roche(德国);dmem/f12培养基、双抗(青霉素和链霉素)、胎牛血清购自hyclone公司(美国)。
30.按照实施例1中的方法对各组样品提取总rna和反转录,按照实施例2中的方法进行荧光定量pcr。
31.结果如图2所示,lncrna420在前体脂肪细胞中的表达显著高于在成熟脂肪细胞中的表达,预示lncrna420与调控前体脂肪细胞分化相关,随着前体脂肪细胞分化水平的增高,lncrna的表达水平下降。
32.实施例4、lncrna420在牛前体脂肪细胞分化过程中的作用细胞:牛前体脂肪细胞试剂:限制性内切酶miuⅰ和notⅰ购自neb,4%多聚甲醛,油红o染料,脂质体3000转染试剂。
33.1)lncrna420增量表达载体效率验证在pbi-cmv3质粒的miuⅰ和notⅰ位点之间插入lncrna420片段,以构建pbi-cmv3-lncrna420增量表达载体质粒。将牛前体脂肪细胞接种6孔板,当细胞密度达到70%左右时进行转染,按每孔150μl opti、3μg质粒、80μl脂质体3000的体系配置成复合体,室温静置15min后加入到细胞中,6h后更换培养基,48h收集细胞;按照实施例1中的方法对各组样品提取总rna和反转录,按照实施例2中的方法进行荧光定量pcr检测lncrna420的表达。
34.pbi-cmv3-lncrna420转染组中lncrna420的表达量显著高于对照组(p《0.05),表达水平约为对照组的70余倍,表明增量表达载体可以显著提高lncrna420的表达。
35.2)lncrna420增量表达后对牛前体脂肪细胞内脂滴的影响将细胞接种12孔板后,当细胞密度达到70%左右时进行转染,转染48h后去除培养基后,用pbs轻轻漂洗两次。然后在37
°
c多聚甲醛中固定40min。固定完后,用pbs洗去多聚甲醛。在室温下用现配的油红o工作液染色60min。染色完毕后,用pbs洗去浮色,避光下用苏木精染色5min。在1h内在显微镜下观察细胞。用60%异丙醇将每组的染料提取出来,用酶标仪检测每组的吸光值。
36.结果如图3所示,油红o染色结果显示pbi-cmv3-lncrna-420转染组中细胞内脂滴小且数量少,而对照组中细胞内脂滴较大且数量较多。用酶标仪测定每组的od值,pbi-cmv3-lncrna-420转染组的od值低于对照组的od值。
37.3)lncrna420增量表达后对牛前体脂肪细胞分化的影响将牛前体脂肪细胞接种6孔板,当细胞密度达到70%左右时进行转染,48h收集细胞;按照实施例1中的方法对各组样品提取总rna和反转录,按照实施例2中的方法进行荧光定量pcr检测分化相关基因dlk1、atgl、hsl、lpl、fasn和ppar-γ的变化。
38.根据ncbi数据库公布的分化相关基因dlk1(nm_174037.2)、atgl(nm_001046005.2)、hsl(nm_001080220.1)、lpl(nm_001075120.1)、fasn(nm_001012669.1)和ppar-γ(nm_181024.2)的mrna序列,通过primer 6软件设计定量引物,具体如下:dlk1的上游引物:5
’‑
tctgtgcggtctgttcttatctt-3
’ꢀ
(seq id no.6)下游引物:5
’‑
aaccagggcgttgataacag-3
’ꢀ
(seq id no.7)atgl的上游引物:5
’‑ꢀ
atggtgccctacactctg-3
’ꢀ
(seq id no.8)下游引物:5
’‑ꢀ
tgtctgctccttcatcca
ꢀ‑3’ꢀ
(seq id no.9)hsl的上游引物:5
’‑ꢀ
ggtaattgccgacttccta-3
’ꢀ
(seq id no.10)下游引物:5
’‑ꢀ
cgagatggtgactgtgag
ꢀ‑3’ꢀ
(seq id no.11)lpl的上游引物:5
’‑ꢀ
ccgcagacaggattacag
ꢀ‑3’ꢀ
(seq id no.12)下游引物:5
’‑ꢀ
acagttagccacagattcg
ꢀ‑3’ꢀ
(seq id no.13)fasn的上游引物:5
’‑ꢀ
gtttgacgcttccttcttcg
ꢀ‑3’ꢀ
(seq id no.14)下游引物:5
’‑ꢀ
acaatggcctcgtaggtgac
ꢀ‑3’ꢀ
(seq id no.15)ppar-γ的上游引物:5
’‑ꢀ
aaagcgtcagggttccactat
ꢀ‑3’ꢀ
(seq id no.16)
下游引物:5
’‑ꢀ
atctccgctaacagcttctcc
ꢀ‑3’ꢀ
(seq id no.17)结果如图4所示,当细胞中lncrna420表达增多后前脂肪细胞标志基因dlk1表达水平升高,与脂代谢分解相关的基因如atgl、lpl、hsl的表达量显著上调,与脂肪合成相关的基因fasn的表达量下调,与脂质摄取相关的脂蛋白激酶ppar-γ表达量显著下降(p《0.05)。这些都表明lncrna是抑制细胞分化的,并且是通过促进脂代谢分解来抑制分化的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1