臭椿叶中甾体类化合物的制备及应用
1.本发明属于医药技术领域,具体涉及一种从植物臭椿叶中制备甾体类化合物的方法及这类化合物在抗肿瘤方面的应用。
背景技术:
2.臭椿(ailanthus altissima(mill.)swingle)为苦木科(simaroubaceae)臭椿属(ailanthusdesf.)植物,广泛分布于我国陕西省、甘肃省、四川省、云南省等地。其根皮入药具有清热燥湿、收涩固肠的功效,主治赤白久痢、肠风下血、带下血崩、梦遗滑精等症。现代化学与药理学研究表明,臭椿中含有苦味素、甾体、香豆素、生物碱、木质素等成分,具有抗癌、抗病毒、抗炎、抗氧化等多种活性。
3.我国癌症数据评估:据2015年中国居民主要疾病死亡汇率及死因构成报告显示,因癌症死亡人数达到1643.5万(占比26.4%),位居第一位。据权威机构发布的《2020-2026年中国肿瘤治疗精准医疗行业市场分析预测及投资价值咨询报告》显示:2018年全球新增癌症患者达1810万人,因癌症死亡人数为960万人。我国是人口大国,也是癌症高发国家,2018年我国新发病例数380.4万例,占全球癌症新发病人数的20%以上,肺癌、胃癌、结直肠癌、肝癌、女性乳腺癌是我国主要的常见恶性肿瘤,约占全部新发病例的77%。其中,我国肝癌发病和死亡人数约占全球一半,肝癌位居我国恶性肿瘤致死率第2~3位,5年生存率仅为14.1%。中国人群的肝癌存在生存率低、死亡率高的情况,如何有效降低肝癌相关负担仍是中国公共卫生和慢性病防控领域亟待解决的重大问题。目前,超过60%的抗癌药物来自天然产物,天然产物为化疗药物的发现提供了重要来源,为维护人类健康做出了巨大贡献。因此,在天然产物中寻找具有抗癌潜力的药物具有重要意义。
技术实现要素:
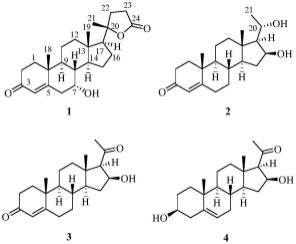
4.本发明的目的是提供4种从苦木科臭椿属植物臭椿(ailanthus altissima(mill.)swingle) 叶中分离得到的甾体类化合物,结构如下所示:
1.46 (3h,s),1.20(3h,s),0.87(3h,s);剩余质子信号均为脂肪族碳上的质子信号且化学位移均在 3以内。依据上述信号推测化合物1可能为甾体类化合物。
13
c nmr中共给出24个碳信号,包括α,β不饱和酮碳基片段中的3个碳信号:δ
c 198.9,167.5,127.1;一个酯羰基信号:δ
c 177.6;两个连氧碳信号:δ
c 88.4,68.4;三个甲基碳信号:26.8,17.2,13.2;剩余碳信号均为脂肪族碳。根据hmbc谱与1h-1
h cosy中的相关信号表明化合物1具有甾体四环骨架。对数据的进一步分析发现,δ
c 198.9(c-3),127.1(c-4)与167.5(c-5)低场区信号以及h-4与c
‑ꢀ
2,c-6和c-10;h-1与c-3之间的hmbc相关表明,α,β-不饱和羰基连接在a环上。hmbc 谱中h-21与c-17,c-20,c-22,h-22与c-24,h-23与c-20的相关信号与c-20(δ
c 88.7)的去屏蔽信号证实该化合物的17位侧链为五元内酯环。此外h-7与c-5,c-9,c-14间的hmbc相关信号证明该化合物的7位被羟基取代。化合物1的相对构型可通过noesy谱进行确定。 h-7/h-18,h-18/h-8,h-8/h-19间的noe相关信号证明h-7,8以及18,19-ch3均为β-构型; h-9/h-14,h-14/h-17间的noe相关信号证明h-9,14,17均为α-构型。对于21-ch3而言,由于其处于17侧链上而c-17与c-20间为可自由旋转的碳碳单键,无法通过noesy谱确定其相对构型。因此结合生源以及文献报道的数据将其暂定为β-构型。化合物的绝对构型是通过比较计算和实测ecd确定的。化合物实测ecd曲线与计算的7r,8s,9s,10r,13s,14s,17s, 20s构型ecd曲线能够较好的吻合,因此确定化合物的绝对构型为7r,8s,9s,10r,13s,14s, 17s,20s,并命名为chouchunsteride a。
19.chouchunsteride b(2):白色粉末,uv(meoh)λ
max
(logε):240.5 nm(0.10);高分辨质谱hresims给出准分子离子峰[m+na]
+
(m/z):355.2246(calcd forc
21h32
nao3:355.2244),结合1h nmr以及
13
c nmr核磁共振谱得出分子式为c
21h32
o3,计算不饱和度为6。1h nmr高场区仅观察到一个烯烃质子信号:δ
h 5.73(1h,br s);此外还观察到两个连氧碳上的质子信号:δ
h 4.50(1h,ddd,j=7.8,5.7,2.2hz),4.14(1h,dd,j=9.8,6.0hz);以及三个甲基信号:δ
h 1.31(3h,d,j=6.0hz),1.19(3h,s),0.92(3h,s);剩余质子信号均为脂肪族碳上的质子信号且化学位移均在3以内。依据上述信号推测化合物2可能为甾体类化合物。
13
c nmr中共给出21个碳信号,包括α,β不饱和酮碳基片段中的3个碳信号:δ
c 199.7, 171.2,124.1;两个连氧碳信号:δ
c 73.1,66.7;三个甲基碳信号:23.8,17.5,14.2;剩余碳信号均为脂肪族碳。根据hsqc谱对该化合物的碳氢数据进行了全归属。依据hmbc谱中h-4与c-2,c-6,c-10,h-18与c-1,c-5,c-9,c-10间的相关信号以及1h-1
h cosy谱中h-1/h
‑ꢀ
2间的相关信号可确定a环具有一个α,β不饱和酮碳基片段并通过c-5,c-10与b环相连。 hmbc谱中h-8与c-6,c-10,c-11,c-13,c-15的相关信号以及1h-1
h cosy谱中h-6/h-7, h-7/h-8,h-8/h-9,h-9/h-11,h-11/h-12,h-8/h-14的相关信号证明化合物2的b环以及c 环均为6元环且b、c环通过c-8,c-9相连。h-19与c-12,c-13,c-14,c-17,h-16与c-13, h-20/c-13,16,17,h-21/c-17间的hmbc相关证明d环为五元环,且17位具有一个2-羟基
ꢀ‑
乙基片段。化合物2的相对构型是通过noesy确定的,而20位羟基处于柔性链中,由于碳碳单键可进行自由旋转而无法利用空间相关谱如noesy或roesy谱进行确定。而20位的间位17位也存在一个仲醇羟基,构成了1,3-二羟基片段,符合制备丙叉衍生物的基本要求,因此可通过制备丙叉衍生物的方法确定20位羟基相对构型。根据该化合物丙叉产物2a的 noesy光谱中,h-9/h-14、h-14/h-16、h-14/h-17存在noesy相关以及h-8/h
3-18、h-8/h3‑ꢀ
19、h
3-19/h-20的noesy相关确定h-9、h-14、h-16和h-17的为α-构型,而h-8、h
3-18、 h
3-19和h-20的相
对构型为β-构型,通过对比实测和计算ecd谱图确定了化合物的绝对构型为8s,9s,10r,13s,14s,16s,17s,20s,并命名为chouchunsteride b。
[0020]
化合物1,2与2的缩醛化产物2a的核磁数据归属如表1所示。
[0021]
表1化合物1,2,2a的1h(600mhz)和
13
c(150mhz)在cdcl3中的nmr数据
[0022][0023][0024]
chouchunsteride c(3):白色粉末,uv(meoh)λ
max
(logε):240.5 nm(0.20);高分辨质谱hresims给出准分子离子峰[m+na]
+
(m/z):353.2088(calcd forc
21h30
nao3:353.2087),结合1h nmr以及
13
c nmr核磁共振谱得出分子式为c
21h30
o3,计算不饱和度为7。1h nmr高场区仅观察到一个烯烃质子信号:δ
h 5.74(1h,d,j=1.7hz);此外还观察到一个连氧碳上的质子信号:δ
h 4.59(1h,ddd,j=7.5,6.5,4.3hz),以及三个甲基信号:δ
h 2.22(3h,s),1.21(3h,s),1.01(3h,s);剩余质子信号均为脂肪族碳上的质子信号且化学位移均在3以内。依据上述信号推测化合物3可能为甾体类化合物。
13
c nmr中共给出21 个碳信号,包括α,β不饱和酮碳基片段中的3个碳信号:δ
c 199.5,170.8,124.2;一个酮碳基信号:δ
c 213.1;一个连氧碳信号:δ
c 72.3;三个甲基碳信号:32.7,17.5,14.9;剩余碳信号均为脂肪族碳。依据hmbc谱以及1h-1
h cosy中的相关信号,化合物3可能具有与化合物 2相似的平面结构。对数据的进一步分析发现化合物3可能为化合物2的20位羟基被氧化为酮碳基的产物。hmbc谱中h-21/c-17,20,h-16/c-20的相关信号也证明该化合物的20位为酮碳基。化合物3为母核含有21个碳原子的甾体衍生物,母核中的手性中心通常较
为固定。但17位侧链可能有α或者β两种构型,此外16位也少见有羟基取代的报道。noesy谱中,依据h-16/h-14,h-14/h-17间的相关信号确定17位侧链为少见的β构型,16位羟基为β构型。化合物的绝对构型是通过比较计算和实测ecd确定的。化合物实测ecd曲线与计算的 8s,9s,10r,13s,14s,16s,17r构型ecd曲线能够较好的吻合,因此确定化合物的绝对构型为 8s,9s,10r,13s,14s,16s,17r,并命名为chouchunsteride c。
[0025]
chouchunsteride d(4):白色粉末(甲醇),uv(meoh)λ
max
(logε): 202.0nm(0.51);高分辨质谱hresims给出准分子离子峰[m+h]
+
(m/z):333.2416(calcd forc
21h33
o3:333.2424),结合1h nmr以及
13
c nmr核磁共振谱得出分子式为c
21h32
o3,计算不饱和度为6。1h nmr高场区仅观察到一个烯烃质子信号:δ
h 5.35(1h,dd,j=5.3,2.6hz);此外还观察到两个连氧碳上的质子信号:δ
h 4.58(1h,ddd,j=7.1,6.8,4.5hz),3.52(1h,m)以及三个甲基信号:δ
h 2.22(3h,s),1.03(3h,s),0.97(3h,s);剩余质子信号均为脂肪族碳上的质子信号且化学位移均在3以内。依据上述信号推测化合物4可能为甾体类化合物。
13
c nmr 中共给出21个碳信号,包括一个酮碳基信号:δ
c 213.3;一对双键碳信号:δ
c 140.8,121.2;两个连氧碳信号:δ
c 72.3,71.7;三个甲基碳信号:32.6,19.4,14.6;剩余碳信号均为脂肪族碳。根据hsqc谱对该化合物的碳氢数据进行了全归属。依据hmbc谱以及1h-1
h cosy中的相关信号,化合物4可能具有与化合物4相似的平面结构。对数据的进一步分析发现化合物4可能具有孕甾烷特征的5,6位双键,a环的3位不存在α,β不饱和酮碳基片段,而被羟基取代。hmbc谱中h-6/c-4,h-18/c-1,5,9,10以及1h-1
h cosy谱中h-1/h-2,h-2/h-3,h
‑ꢀ
3/h-4的相关信号证实了上述观点。通过noesy谱并结合生源可确定化合物4的相对构型。其3位碳的化学位移为71.7,与文献中报道的同类化合物3位化学位移基本一致,因此确定 3位羟基为β构型。通过对比实测和计算ecd谱图确定了化合物的绝对构型为3s,8s,9s,10r, 13s,14s,16s,17r,并命名为chouchunsteride d。
[0026]
化合物3,4的核磁数据归属如表2所示。
[0027]
表2化合物3,4的1h(600mhz)和
13
c(150mhz)在cdcl3中的nmr数据
[0028][0029]
对本发明所述的四个甾体类化合物对肿瘤细胞hep3b和hepg2的细胞毒活性及作用机制进行了考察,体外细胞实验结果表明化合物1对hepg2细胞具有显著的细胞毒活性,ic
50
值为4.03μm。因此本发明所述的甾体类化合物具有进一步开发治疗肺癌药物的前景。
[0030]
一种药物组合物,包含所述从臭椿叶中分离得到的甾体类化合物中任一种或多种或其药学上可接受的盐,以及药学上可接受的辅料和载体。
[0031]
一种臭椿叶提取物,包含所述四种甾体类化合物中任一种或多种。
[0032]
本发明还提供所述从臭椿叶中分离得到的甾体类化合物或所述药物组合物或所述臭椿叶提取物在制备抗肿瘤药物中的应用。
[0033]
本发明的优点在于,所述化合物均为立体构型确定的光学纯化合物,同时其抗癌活性强,具有进一步开发的价值。
附图说明
[0034]
图1化合物1的uv谱;
[0035]
图2化合物1的hresims谱;
[0036]
图3化合物1的1h nmr谱(600mhz,cdcl3);
[0037]
图4化合物1的
13
c nmr谱(150mhz,cdcl3);
[0038]
图5化合物1的hsqc谱(600mhz,cdcl3);
[0039]
图6化合物1的hmbc谱(600mhz,cdcl3);
[0040]
图7化合物1的1h-1
h cosy谱00mhz,cdcl3);
[0041]
图8化合物1的noesy谱(600mhz,cdcl3);
[0042]
图9化合物1的dept谱(600mhz,cdcl3);
[0043]
图10化合物1的ecd谱;
[0044]
图11化合物2的uv谱;
[0045]
图12化合物2的hresims谱;
[0046]
图13化合物2的1h nmr谱(600mhz,cdcl3);
[0047]
图14化合物2的
13
c nmr谱(150mhz,cdcl3);
[0048]
图15化合物2的hsqc谱(600mhz,cdcl3);
[0049]
图16化合物2的hmbc谱(600mhz,cdcl3);
[0050]
图17化合物2的1h-1
h cosy谱(600mhz,cdcl3);
[0051]
图18化合物2的noesy谱(600mhz,cdcl3);
[0052]
图19化合物2的ecd谱;
[0053]
图20化合物2a的1h nmr谱(600mhz,cdcl3);
[0054]
图21化合物2a的
13
c nmr谱(150mhz,cdcl3);
[0055]
图22化合物2a的hsqc谱(600mhz,cdcl3);
[0056]
图23化合物2a的hmbc谱(600mhz,cdcl3);
[0057]
图24化合物2a的noesy谱(600mhz,cdcl3);
[0058]
图25化合物3的uv谱;
[0059]
图26化合物3的hresims谱;
[0060]
图27化合物3的1h nmr谱(600mhz,cdcl3);
[0061]
图28化合物3的
13
c nmr谱(150mhz,cdcl3);
[0062]
图29化合物3的hsqc谱(600mhz,cdcl3);
[0063]
图30化合物3的hmbc谱(600mhz,cdcl3);
[0064]
图31化合物3的1h-1
h cosy谱(600mhz,cdcl3);
[0065]
图32化合物3的noesy谱(600mhz,cdcl3);
[0066]
图33化合物3的ecd谱;
[0067]
图34化合物4的uv谱;
[0068]
图35化合物4的hresims谱;
[0069]
图36化合物4的1h nmr谱(600mhz,cdcl3);
[0070]
图37化合物4的
13
c nmr谱(150mhz,cdcl3);
[0071]
图38化合物4的hsqc谱(600mhz,cdcl3);
[0072]
图39化合物4的hmbc谱(600mhz,cdcl3);
[0073]
图40化合物4的1h-1
h cosy谱(600mhz,cdcl3);
[0074]
图41化合物4的noesy谱(600mhz,cdcl3);
[0075]
图42化合物4的ecd谱;
[0076]
图43化合物1-4的实测ecd与计算ecd谱。
具体实施方式
[0077]
下面所列实施例有助于本领域技术人员更好地理解本发明,但不以任何方式限制本发明。
[0078]
实施例1
[0079]
臭椿叶中甾体类化合物1-4的制备方法,具体操作如下:
[0080]
(1)取干燥的臭椿叶50kg,以75%工业乙醇回流提取3次,每次3小时。浓缩提取液得乙醇粗提物4000g,浸膏采用二氯甲烷及正丁醇萃取。
[0081]
(2)将上述萃取液合并浓缩得浸膏(2500g),所得浸膏经硅胶柱色谱,以二氯甲烷-甲醇 100:1-1:1(v/v)进行梯度洗脱,共收集到5个流分a-e。
[0082]
(3)流分c(72g)经hp-20柱色谱以乙醇-水系统20%,40%,60%,80%,90%梯度洗脱,得到了3个流分c1、c2、c3。
[0083]
(4)将流分c3进一步经ods柱色谱以甲醇-水系统20:80-90:10(v/v)梯度洗脱得到了4 个流分c
.3.1-c
3.4
。
[0084]
(5)将流分c
3.2
(6g)经硅胶柱色谱以二氯甲烷-甲醇系统50:1-1:1(v/v)进行梯度洗脱,得流分c
3.2.1-c
3.2.8
。
[0085]
(6)将流分c
3.2.2
经制备及半制备hplc以乙腈-水(50:50,v/v,2.5ml/min)纯化得到化合物1(6mg)。流分c
3.2.3
经以乙腈-水(43:57,v/v,2.5ml/min)纯化得到化合物2(5mg)、化合物3(7.2mg)、化合物4(3mg)。
[0086]
实施例2
[0087]
所述臭椿叶中甾体类化合物1-4在体外对癌细胞hep3b、hepg2的抗肿瘤活性考察。
[0088]
利用mtt法,考察化合物1-4对肿瘤细胞hep3b和hepg2的细胞毒活性实验。将细胞放置于96孔板中,用培养液静置培养12小时,使用不同浓度的化合物处理hep3b和hepg2 细胞,并用索拉非尼做阳性对照组。作用72小时后,加入20μl mtt试剂并在37℃放置4 小时,用酶标仪在490nm波长下对不同浓度处理的细胞进行检测。结果表明,化合物1对 hepg2细胞有显著的细胞毒活性,ic
50
值为4.03μm,化合物2与化合物4显示出较好的细胞毒活性,对hep3b细胞的ic
50
值分别为47.08μm和31.51μm(表3)。
[0089]
表3细胞毒活性
[0090][0091]
细胞毒性用3次实验的平均值
±
sd表示;以索拉非尼为阳性对照。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1