一种抑制番茄果实成熟的基因SlWRKY71及其调控方法
一种抑制番茄果实成熟的基因slwrky71及其调控方法
技术领域
1.本发明属于生物工程技术领域,涉及一种抑制番茄果实成熟的基因slwrky71及其调控方法,特别涉及一种wrky家族的转录因子slwrky71,该基因在负调控番茄果实成熟中的应用。
背景技术:
2.番茄(学名:solanum lycopersicum),即西红柿,是管状花目、茄科、番茄属的一种一年生或多年生草本植物。番茄原产南美洲,中国南北方广泛栽培。番茄的果实营养丰富,具特殊风味。番茄果实成熟是植物特有的生理特性,对种子的传播和植物的繁殖具有重要作用。番茄(solanum lycopersicum)作为一种经典的呼吸跃变型果实模型,在果实成熟和衰老方面得到了广泛的研究。寻找新的参与调控果实成熟的功能基因,依然是园艺领域的重要目标,有助于提高农作物的商业价值。
3.wrky是植物中一个独特的转录因子家族,具有一个或两个保守的氨基酸序列 wrkygqk 和一个锌指结构基序。并始终与下游基因启动子的(t)(t)tgca(c/t)元件(w-box)结合,从而参与植物信号传递、乙烯生物合成、非生物胁迫响应和成熟衰老过程。例如,slwrky31和slwrky23在番茄果实的破色期和红熟期均有高表达,这代表wrky转录因子(tfs)可以调控番茄果实的成熟和衰老。slwrky35通过直接激活番茄中的sldxs1来增强类胡萝卜素的积。这些都表明wrky转录因子在以自己独特的方式调控植物生长和果实成熟衰老。
4.虽然番茄的栽培面积不断扩增,但在许多地区番茄的消费过程还是受到运输、贮藏、出售等因素的限制。8-9月为番茄成熟的高峰期,在此期间番茄供过于求,出售缓慢,导致很多番茄发霉、腐烂,影响番茄的质量,这不仅造成资源浪费,还给广大生产者带来经济上的损失,而选育早熟的番茄品种可以减少上述损失。早熟番茄的生长周期短,着色进程快,果实成熟提前,可以提早上市,这不仅可以提高番茄的商品性,还可以提高种植户的经济效益,调节淡季市场供应。
5.crispr/cas系统由两部分构成:成簇规律间隔短回文重复序列(crispr)和crispr相关蛋白(cas)。该系统发挥作用需要sgrna(small guide rna)和基因序列上的pam结构(5
′‑
ngg)指引cas蛋白发挥核酸内切酶作用。目前已知的cas蛋白种类繁多,目前应用最广的cas9属于ⅱ型系统:cas9与sgrna结合形成复合体,构象发生改变,在sgrna的引导下,该复合体能够识别基因序列上的pam位点并锚定到靶位点。在cas蛋白核酸内切酶的作用下,靶位点产生精确的双链断裂,启动细胞的自我修复机制。在通过非同源末端连接或同源重组途径进行修饰的过程中,对靶基因进行遗传修饰。
技术实现要素:
6.本发明的目的在于提供一种抑制番茄果实成熟的基因slwrky71及其调控方法,为实现上述目的及其他相关目的,本发明提供的技术方案是:一种抑制番茄果实
成熟的基因slwrky71,所述基因的核苷酸序列如seq no.1所示。
7.为实现上述目的及其他相关目的,本发明提供的技术方案是:一种抑制番茄果实成熟的调控方法,包括下列步骤:步骤1:将靶点一正向引物-f1、靶点一反向引物-r1、靶点二正向引物-f2和靶点二反向引物-r2用无菌ddh2o混合稀释至浓度为1μm,然后置于pcr仪中,88-92℃条件下处理25-35 s,然后移至室温冷却,完成靶点引物退火,得到靶点接头引物混合物;靶点一正向引物-f1:5
’‑
gtcacaatggcagcagccaagaaa-3’;靶点一反向引物-r1:5
’‑
aaactttcttggctgctgccattg-3’;靶点二正向引物-f2:5
’‑
gtcaggatgcactactccctctct-3’;靶点二反向引物-r2:5
’‑
aaacagagagggagtagtgcatcc-3’;步骤2:配制包含步骤1中靶点接头引物混合物的酶切连接反应液,利用边切边连法,使靶点接头与grna表达盒连接,扩增grna表达盒;步骤3:以步骤2得到的产物为模板,进行第一轮pcr扩增;步骤4:以步骤3得到的第一轮pcr扩增产物为模板,进行第二轮pcr扩增,扩增完成后估测产物浓度;步骤5:把步骤4得到的2个二轮pcr产物等量混合,用dna产物纯化试剂盒纯化后取2 μl纯化产物进行琼脂糖凝胶电泳,检查产物纯化效果,浓度不低于5ng/μl即可进行下一步;步骤6:利用边切边连法进行grna表达盒与cas9质粒的连接;步骤7:连接完成后取步骤6连接产物通过化学热激法转化大肠杆菌dh5α,提取质粒,测序检测;步骤8:将crispr/cas9-slwrky71质粒转化eha105农杆菌感受态细胞;步骤9:将含有crispr/cas9-slwrky71质粒的eha105农杆菌侵染番茄子叶并获得转基因阳性苗wrky71。
8.步骤10:以番茄cdna为模板,根据mrna的序列分别设计两轮引物;第一轮引物无酶切位点,第二轮的上游引物需从起始密码子或起始密码子前面几个碱基开始,下游引物必须从终止密码子开始,二轮引物需引入酶切位点;以上游引物-f和下游引物-r进行pcr扩增,pcr扩增产物纯化后,得到目的基因片段;第一轮正向引物-f1:5
’‑
atgggtgatgaactaagagatttg-3’;第一轮反向引物-r1:5
’‑ꢀ
tcatggttcttgtttaagattaaa-3’;第二轮正向引物-f2:5
’‑ꢀ
gagaacacgggggactctagaatgggtgatgaactaagagatttgtact-3’;第二轮反向引物-r2:5
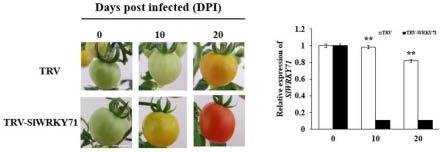
’‑ꢀ
cttgtaatcggtaccctcgagtggttcttgtttaagattaaacatagaagg-3’;步骤11:用限制性内切酶bamhi和限制性内切酶xhoi对载体pbi121进行双酶切,酶切产物纯化后,得到线性pbi121载体;步骤12:目的基因片段和线性pbi121载体进行重组,得到wrky71-pbi121质粒;步骤13:将wrky71-pbi121质粒转化eha105农杆菌感受态细胞;步骤14:含有wrky71-pbi121质粒的eha105农杆菌侵染番茄子叶并获得转基因阳
性苗slwrky71-oe。
9.优选的技术方案为:步骤2中,所述酶切连接反应液为:1μl的10
×
cutsmart buffer,20ng的pylgrna-atu#质粒,0.5μl的接头引物混合物,0.4 μl的bsai,0.1 μl的t4 dna ligase,0.4 μl的t4 dna ligase buffer,ddh2o补足至10 μl;pcr扩增参数为:37℃,5 min;20℃,5 min;5个循环。
10.优选的技术方案为:步骤3包括2个pcr扩增反应,第一个第一轮pcr扩增为50 μl反应体系:1 μl的边切边连产物,4 μl的引物对u-f/rn,1μl的dntps,1 μl的super-fidelity dna polymerase,10 μl的5
×
super-fidelity dna polymerase buffer,33μl的ddh2o;pcr条件:95℃,1 min;95℃,10s;60℃,15s;72℃,15s;25个循环;72℃,10 min;4℃,∞;第二个第一轮pcr扩增为50μl反应体系:1 μl的边切边连产物,4 μl的引物对fn/grna-r,1μl的dntps,1 μl的super-fidelity dna polymerase,10μl的5
×
super-fidelity dna polymerase buffer,33μl的ddh2o;pcr条件:95℃,1 min;95℃,10s;60℃,15s;72℃,15s;25个循环;72℃,10 min;4℃,∞;u-f:5
’‑
ctccgttttacctgtggaatcg-3’;grna-r:5
’‑
cggaggaaaattccatccac-3’;rn代表第一轮反向引物-r1和第二轮反向引物-r2;fn代表第一轮正向引物-f1和第二轮正向引物-f2。
11.优选的技术方案为:预先将位置特异引物对混合成10
×
工作液,每种1.5 μm:pt1=1.5 μlb1’+1.5 μlb2+7 μlddh2o,pt2l=1.5 μlb2’+1.5 μlbl+7 μlddh2o;靶点一反应体系为:一轮pcr扩增的2个靶点一pcr反应产物各1 μl,3 μl引物组合工作液pt1,0.6 μl的dntps,0.6 μl的super-fidelity dna polymerase,6μl的5
×
super-fidelity dna polymerase buffer,17.8 μl的ddh2o;靶点二反应体系为:一轮pcr扩增的2个靶点二pcr反应产物各1 μl,3 μl引物组合工作液pt2l,0.6 μl的dntps,0.6 μl的super-fidelity dna polymerase,6 μl的5
×
super-fidelity dna polymerase buffer,17.8 μl的ddh2o混匀后置于pcr仪中;pcr反应条件为:95℃,1min;95℃,10s,60℃, 15s,72℃,15 s,18个循环;72℃,10min;4℃,∞。
12.b1’:5
’‑
ttcagaggtctctctcgactagtggaatcggcagcaaagg-3’;b2:agcgtgggtctcgtcagggtccatccactccaagctc;b2’:ttcagaggtctctctgacactggaatcggcagcaaagg;bl:agcgtgggtctcgaccgacgcgtccatccactccaagctc。
13.优选的技术方案为:步骤6中,取二轮纯化产物20-70 ng,加入80-100ng未切割的pylcrispr/cas9-dn质粒,10
×
cutsmart buffer 1.5μl,bsai内切酶0.5 μl,用ddh2o补足体积至15 μl。混匀后置于pcr仪中37℃反应10 min进行pylcrispr/cas9-dn质粒酶切。向酶切后的反应体系中补加0.4 μl 10
×
t4dna ligase buffer和0.1 μl t4 dna ligase。再次混匀后置于pcr仪中,反应条件为37℃ 2 min,10℃ 3 min,20℃ 5 min,13个循环;37℃ 2 min;4℃ ∞。
14.优选的技术方案为:步骤7中,取步骤7得到的1 μl连接产物加入到100
µ
l大肠杆菌dh5α感受态细胞中,冰上静置30 min,42℃热激45 s,冰浴2-3 min;在离心管中加入700
ꢀµ
l的lb液体培养基,置于37℃,200 rpm摇床中振荡培养60 min;培养得到的菌液5000 rpm离
心2 min,弃上清600
ꢀµ
l,吸取剩余菌液均匀涂布于含有卡那霉素的lb固体培养基(每100 ml lb固体培养基加500ul 10 mg/ml卡那霉素)上,37℃倒置培养16 h;挑取单克隆菌落,于10
ꢀµ
l无菌水中吹吸混匀,取2
ꢀµ
l菌液进行菌落鉴定,菌落pcr体系为25 μl:2 μl菌液、10 μm双元载体上的引物对sp-dl/sp-r各1μl、2
×
rapid taq master mix 12.5μl、ddh2o 8.5 μl,混匀后置于pcr仪中。pcr条件为:预变性95℃ 3min;变性95℃ 15s,退火55℃ 1min,延伸72℃ 45 s,32个循环;彻底延伸72℃ 5min;4℃ ∞。待反应结束后,在琼脂糖凝胶上检测pcr产物条带大小是否符合理论值,将条带大小正确的剩余菌液转移至4 ml含有卡那霉素的lb液体培养基中,37℃/200 rpm摇床中振荡培养16 h,质粒小提试剂盒提取质粒并跑琼脂糖凝胶验证质粒提取是否成功,将提取出的质粒送往生工公司进一步测序鉴定。
15.优选的技术方案为:步骤8中,取100 μl农杆菌感受态细胞eha105,在冰浴中使其融化,加入1μl测序正确的cas9质粒,用手轻轻拨打离心管底部,混匀,依次在冰上静置5 min、液氮5 min、37℃水浴5 min、冰浴5 min;加入700 μl无抗生素的lb液体培养基,于28℃振荡培养2-3 h;6000 rpm 离心1 min收菌,留取100 μl左右上清,吹打混匀重悬菌体,涂布于lb-kana/rif固体培养基上,倒置放于28℃培养箱培养2-3天。
16.优选的技术方案为:步骤9中,挑取步骤9中构建好的cas9载体的农杆菌单菌落于3 ml含kana和rif的lb液体培养基中,200 rpm,28℃培养12-16 h后取300
ꢀµ
l于20 ml含kana和rif的lb液体培养基中,200 rpm,28℃震荡培养6-7 h,用分光光度计检测菌液od
600
至0.5-0.6。5000 rpm室温离心10 min收集菌体,菌体用无菌水稀释至od
600
=0.1-0.2,现配现用。将番茄子叶和茎段黑暗预培养2 d后浸泡于稀释好的农杆菌侵染液中,震荡,侵染5 min后倒掉侵染液,用枪头吸掉多余侵染液,将子叶和茎段再经过含不同植物激素的培养基上分别发芽、芽伸长、生根的过程,将生根的外植体转移至营养土中进行后续测序鉴定,进而得到转化的番茄植株。随后通过设计靶点上下游引物,提取转基因番茄植株dna,进行pcr扩增,并进行测序鉴定,分析slcas基因是否发生编辑。
17.优选的技术方案为:步骤10中,pcr扩增体系为50 μl:番茄cdna 2μl、上游引物-f和下游引物-r各2μl、5
×
高保真dna聚合酶缓冲液10μl、高保真dna聚合酶1μl、脱氧核糖核苷三磷酸dntp混合物1μl、双蒸水补至50 μl。
18.优选的技术方案为:步骤10中,一轮pcr总反应体系为50μl,其中含有4μl 模板(为番茄提取rna后反转录得到的cdna),1μl正向引物f1,1μl反向引物r1,4μl dntp,5μl pcrsit,1μl pfu酶,10μl 5
×
pfu buffer,24μl 无菌ddh2o。二轮pcr与一轮pcr体系相同,只是用一轮pcr产物作为模版,将引物对换成f2与r2。pcr扩增参数为:95℃预变性 5min,95℃变性 20s,55℃退火 20s,72℃ 延伸1min25s,38个循环,72℃延伸5min,4℃保存。二轮产物使用普通dna纯化试剂盒进行纯化回收。
19.优选的技术方案为:步骤11中,酶切总体系为50μl,其中含有20μl pbi121载体质粒/二轮纯化产物,2μl xhoi,2μl bamhi,5μl cut smart buffer,21μl无菌ddh2o。pbi121载体37℃酶切4h,纯化产物37℃酶切过夜。使用dna胶回收试剂盒将得到的酶切产物分别进行切胶纯化。
20.优选的技术方案为:步骤12中,目的基因片段和线性pbi121载体用一步克隆试剂盒clonexpress
ⅱꢀ
one step cloning kit进行重组,重组条件为:37℃连接30 min,结束后置于冰上保存;取步骤1得到的pcr扩增产物加入到100
µ
l大肠杆菌dh5α感受态细胞中,冰上
0.2,即得含有wrky71-pbi121质粒的eha105农杆菌侵染液。
25.由于上述技术方案运用,本发明与现有技术相比具有的优点是:1、本发明通过从番茄中得到slwrky71基因完整的编码序列,设计靶点,将靶点连接到载体cripsr-cas9上,利用农杆菌侵染法转化植物,获得基因编辑植株,对基因编辑植株进行了分析。
26.2、本发明通过从番茄中得到slwrky71基因完整的编码序列,扩增mrna序列,将片段连接到载体pbi121上,利用农杆菌侵染法转化植物,获得转基因植株,对转基因植株进行了分析。
27.综合以上两种植株的结果,表明该基因能够抑制番茄果实成熟。
附图说明
28.图1为ck和瞬时转化slwrky71的番茄果实的成熟时间及slwrky71的表达量。
29.图2为ck和瞬时转化slwrky71的番茄果实中总叶绿素,胡萝卜素和番茄红素含量。
30.图3为ck和病毒诱导的slwrky71当代沉默的番茄果实的成熟时间及slwrky71的表达量。
31.图4为ck和病毒诱导的slwrky71当代沉默的番茄果实中总叶绿素,胡萝卜素和番茄红素含量。
32.图5为cripsr-cas9-slwrky71质粒的测序鉴定图,黄色部分为靶点序列,绿色部分为grna表达盒序列,表明基因编辑载体构建成功。
33.图6为slwrky71基因编辑植株的靶点鉴定图,表明slwrky71基因成功突变。
34.图7为wt和slwrky71基因编辑植株的番茄果实成熟时间。
35.图8为wt和slwrky71基因编辑植株的番茄果实中总叶绿素,胡萝卜素和番茄红素含量。
36.图9为wt和slwrky71基因编辑植株的番茄果实中叶绿素降解,类胡萝卜素合成相关基因表达量。
37.图10为wt和slwrky71高表达植株的番茄果实成熟时间。
具体实施方式
38.以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,请参阅图1-10,须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,提供以下实施例以便更好地理解本发明,而非限制本发明,以下实施例中的实验方法如无特殊说明,均为常规方法,下述实施例中所用的实验材料如无特殊说明,均为常规生化试剂商店购买所得,实施例1:一种抑制番茄果实成熟的基因slwrky71及其调控方法一种抑制番茄果实成熟的基因slwrky71,所述基因的核苷酸序列如seq no.1所示。
buffer,20ng的pylgrna-atu#质粒,0.5μl的接头引物混合物,0.4 μl的bsai,0.1 μl的t4 dna ligase,0.4 μl的t4 dna ligase buffer,ddh2o补足至10 μl;pcr扩增参数为:37℃,5 min;20℃,5 min;5个循环。
42.优选的实施方式为:步骤3包括2个pcr扩增反应,第一个第一轮pcr扩增为50 μl反应体系:1 μl的边切边连产物,4 μl的引物对u-f/rn,1μl的dntps,1 μl的super-fidelity dna polymerase,10 μl的5
×
super-fidelity dna polymerase buffer,33μl的ddh2o;pcr条件:95℃,1 min;95℃,10s;60℃,15s;72℃,15s;25个循环;72℃,10 min;4℃,∞;第二个第一轮pcr扩增为50μl反应体系:1 μl的边切边连产物,4 μl的引物对fn/grna-r,1μl的dntps,1 μl的super-fidelity dna polymerase,10μl的5
×
super-fidelity dna polymerase buffer,33μl的ddh2o;pcr条件:95℃,1 min;95℃,10s;60℃,15s;72℃,15s;25个循环;72℃,10 min;4℃,∞;u-f:5
’‑
ctccgttttacctgtggaatcg-3’;grna-r:5
’‑
cggaggaaaattccatccac-3’;rn代表第一轮反向引物-r1和第二轮反向引物-r2;fn代表第一轮正向引物-f1和第二轮正向引物-f2。
43.优选的技术方案为:预先将位置特异引物对混合成10
×
工作液,每种1.5 μm:pt1=1.5 μlb1’+1.5 μlb2+7 μlddh2o,pt2l=1.5 μlb2’+1.5 μlbl+7 μlddh2o;靶点一反应体系为:一轮pcr扩增的2个靶点一pcr反应产物各1 μl,3 μl引物组合工作液pt1,0.6 μl的dntps,0.6 μl的super-fidelity dna polymerase,6μl的5
×
super-fidelity dna polymerase buffer,17.8 μl的ddh2o;靶点二反应体系为:一轮pcr扩增的2个靶点二pcr反应产物各1 μl,3 μl引物组合工作液pt2l,0.6 μl的dntps,0.6 μl的super-fidelity dna polymerase,6 μl的5
×
super-fidelity dna polymerase buffer,17.8 μl的ddh2o混匀后置于pcr仪中;pcr反应条件为:95℃,1min;95℃,10s,60℃, 15s,72℃,15 s,18个循环;72℃,10min;4℃,∞。
44.b1’:5
’‑
ttcagaggtctctctcgactagtggaatcggcagcaaagg-3’;b2:agcgtgggtctcgtcagggtccatccactccaagctc;b2’:ttcagaggtctctctgacactggaatcggcagcaaagg;bl:agcgtgggtctcgaccgacgcgtccatccactccaagctc。
45.优选的实施方式为:步骤6中,取二轮纯化产物20-70 ng,加入80-100ng未切割的pylcrispr/cas9-dn质粒,10
×
cutsmart buffer 1.5μl,bsai内切酶0.5 μl,用ddh2o补足体积至15 μl。混匀后置于pcr仪中37℃反应10 min进行pylcrispr/cas9-dn质粒酶切。向酶切后的反应体系中补加0.4 μl 10
×
t4dna ligase buffer和0.1 μl t4 dna ligase。再次混匀后置于pcr仪中,反应条件为37℃ 2 min,10℃ 3 min,20℃ 5 min,13个循环;37℃ 2 min;4℃ ∞。
46.优选的实施方式为:步骤7中,取步骤7得到的1 μl连接产物加入到100
µ
l大肠杆菌dh5α感受态细胞中,冰上静置30 min,42℃热激45 s,冰浴2-3 min;在离心管中加入700
ꢀµ
l的lb液体培养基,置于37℃,200 rpm摇床中振荡培养60 min;培养得到的菌液5000 rpm离心2 min,弃上清600
ꢀµ
l,吸取剩余菌液均匀涂布于含有卡那霉素的lb固体培养基(每100 ml lb固体培养基加500ul 10 mg/ml卡那霉素)上,37℃倒置培养16 h;挑取单克隆菌落,于
10
ꢀµ
l无菌水中吹吸混匀,取2
ꢀµ
l菌液进行菌落鉴定,菌落pcr体系为25 μl:2 μl菌液、10 μm双元载体上的引物对sp-dl/sp-r各1μl、2
×
rapid taq master mix 12.5μl、ddh2o 8.5 μl,混匀后置于pcr仪中。pcr条件为:预变性95℃ 3min;变性95℃ 15s,退火55℃ 1min,延伸72℃ 45 s,32个循环;彻底延伸72℃ 5min;4℃ ∞。待反应结束后,在琼脂糖凝胶上检测pcr产物条带大小是否符合理论值,将条带大小正确的剩余菌液转移至4 ml含有卡那霉素的lb液体培养基中,37℃/200 rpm摇床中振荡培养16 h,质粒小提试剂盒提取质粒并跑琼脂糖凝胶验证质粒提取是否成功,将提取出的质粒送往生工公司进一步测序鉴定。
47.优选的实施方式为:步骤8中,取100 μl农杆菌感受态细胞eha105,在冰浴中使其融化,加入1μl测序正确的cas9质粒,用手轻轻拨打离心管底部,混匀,依次在冰上静置5 min、液氮5 min、37℃水浴5 min、冰浴5 min;加入700 μl无抗生素的lb液体培养基,于28℃振荡培养2-3 h;6000 rpm 离心1 min收菌,留取100 μl左右上清,吹打混匀重悬菌体,涂布于lb-kana/rif固体培养基上,倒置放于28℃培养箱培养2-3天。
48.优选的实施方式为:步骤9中,挑取步骤9中构建好的cas9载体的农杆菌单菌落于3 ml含kana和rif的lb液体培养基中,200 rpm,28℃培养12-16 h后取300
ꢀµ
l于20 ml含kana和rif的lb液体培养基中,200 rpm,28℃震荡培养6-7 h,用分光光度计检测菌液od
600
至0.5-0.6。5000 rpm室温离心10 min收集菌体,菌体用无菌水稀释至od
600
=0.1-0.2,现配现用。将番茄子叶和茎段黑暗预培养2 d后浸泡于稀释好的农杆菌侵染液中,震荡,侵染5 min后倒掉侵染液,用枪头吸掉多余侵染液,将子叶和茎段再经过含不同植物激素的培养基上分别发芽、芽伸长、生根的过程,将生根的外植体转移至营养土中进行后续测序鉴定,进而得到转化的番茄植株。随后通过设计靶点上下游引物,提取转基因番茄植株dna,进行pcr扩增,并进行测序鉴定,分析slcas基因是否发生编辑。
49.优选的实施方式为:步骤10中,pcr扩增体系为50 μl:番茄cdna 2μl、上游引物-f和下游引物-r各2μl、5
×
高保真dna聚合酶缓冲液10μl、高保真dna聚合酶1μl、脱氧核糖核苷三磷酸dntp混合物1μl、双蒸水补至50 μl。
50.优选的实施方式为:步骤10中,一轮pcr总反应体系为50μl,其中含有4μl 模板(为番茄提取rna后反转录得到的cdna),1μl正向引物f1,1μl反向引物r1,4μl dntp,5μl pcrsit,1μl pfu酶,10μl 5
×
pfu buffer,24μl 无菌ddh2o。二轮pcr与一轮pcr体系相同,只是用一轮pcr产物作为模版,将引物对换成f2与r2。pcr扩增参数为:95℃预变性 5min,95℃变性 20s,55℃退火 20s,72℃ 延伸1min25s,38个循环,72℃延伸5min,4℃保存。二轮产物使用普通dna纯化试剂盒进行纯化回收。
51.优选的实施方式为:步骤11中,酶切总体系为50μl,其中含有20μl pbi121载体质粒/二轮纯化产物,2μl xhoi,2μl bamhi,5μl cut smart buffer,21μl无菌ddh2o。pbi121载体37℃酶切4h,纯化产物37℃酶切过夜。使用dna胶回收试剂盒将得到的酶切产物分别进行切胶纯化。
52.优选的实施方式为:步骤12中,目的基因片段和线性pbi121载体用一步克隆试剂盒clonexpress
ⅱꢀ
one step cloning kit进行重组,重组条件为:37℃连接30 min,结束后置于冰上保存;取步骤1得到的pcr扩增产物加入到100
µ
l大肠杆菌dh5α感受态细胞中,冰上静置30 min,42℃热激45s,冰浴2-3 min;在离心管中加入700
µ
l的lb液体培养基,置于37℃,150 rpm摇床中振荡培养45 min;培养得到的菌液4000rpm离心2min,弃上清200
µ
l,吸取
剩余菌液均匀涂布于含有卡那霉素的固体培养基(每100 ml固体lb加 500 ul 10 mg/ml 卡那霉素)上,37℃倒置培养16h;挑取单克隆菌落,于10
µ
l无菌水中吹吸混匀,取2
µ
l菌液进行菌落鉴定。挑取6个阳性克隆测序。
53.优选的实施方式为:步骤13中,进行菌落鉴定时,菌落pcr体系为25
µ
l:2
µ
l菌液、1
µ
l正向引物f2、1
µ
l反向引物r2、12.5
µ
l的2
×
taq聚合酶混合体系、8.5
µ
l双蒸水,冰上混匀;pcr参数为:95℃预变性3min;95℃变性15s;55℃退火15s,72℃延伸2min15s,35个循环;72℃延伸5min;4℃保存,待反应结束后,产物经琼脂糖凝胶电泳,检测条带大小是否符合结果,将条带位置正确的单克隆扩大培养,即在菌液中加入lb液体培养基5 ml,并加入25
µ
l 的浓度为10mg/ml卡那霉素后混匀,37℃,200 rpm摇床中振荡培养12-16h,然后提取菌液中的质粒,并将提取的质粒于-20℃保存。在pbi121载体上wrky71基因片段的两端设计引物进行测序。
54.优选的实施方式为:步骤13中, 将容纳有冰水混合状态的eha105农杆菌感受态细胞的试管插入冰中,然后加入1μl的wrky71-pbi121质粒,拨打管底混匀,依次于冰上静置5分钟、液氮5分钟、37℃水浴5分钟、冰浴5分钟;然后接种于700ml液体lb培养基,置于37℃,150rpm摇床中振荡培养2-3h;5000rpm离心1min,留取100ul左右上清轻轻吹打重悬菌液涂布于含卡那霉素和利福平的lb平板(每100 ml固体lb加500ul 10 mg/ml 卡那霉素和500ul 10 mg/ml 利福平上,倒置放于28度培养箱培养2~3天。有菌落长出后,用枪头随机挑取若干单克隆菌落,溶于10μl的无菌水中制成菌液,取2
µ
l菌液进行菌落鉴定;向条带位置鉴定正确的菌液中加5ml的lb液体培养基、10
µ
l的浓度为10mg/ml利福平,25μl的浓度为10的mg/ml卡那霉素,置于37℃摇床,200 rpm振荡培养过夜,得到含有wrky71-pbi121质粒的eha105农杆菌。
55.优选的实施方式为:步骤14中,将番茄种子用次氯酸钠和酒精清洗消毒以后,播种在生根培养基t0上,暗培养5-7天等待发芽后拿到光照下培养。待芽长成两片子叶时即可准备剪叶子,将番茄子叶剪成小正方形,一片子叶可剪成两半,以及茎剪成小段,将叶和茎摆在预培养基t1上。将预培养2 d后的外植体浸泡于含有wrky71-pbi121质粒的eha105农杆菌侵染液中,震荡,侵染5min后倒掉侵染液,用枪头吸掉多余侵染液,将外植体重新放回预培养基t1上,暗培养2天后,转至芽诱导培养基t
21
上,使用卡那霉素进行筛选,背面朝下,25℃,16h光照培养7 d后,转入新的芽诱导培养基t
21
上继代培养;此后每隔2周更换新的芽诱导培养基t
21
继代培养,待外植体发芽2-3cm时,转入芽伸长培养基t
22
中,培养3-4周,每两周更换新的芽伸长培养基t
22
,当芽伸长至4-5cm时,剪去根部的愈伤组织,转入生根培养基t3中,培养3-4周,得到生根的小苗;将生根的小苗转入土盆内,使幼苗生长3-7 d,结束后,将番茄小苗转移至土培室内,16 h光照正常生长,得到转基因阳性苗。
56.优选的实施方式为:步骤14中,侵染液的配置:挑取含有wrky71-pbi121质粒的eha105农杆菌单菌落于3ml的lb液体培养基中(含15ul 10mg/ml的卡那霉素和15ul10mg/ml的利福平),200rpm,28℃过夜;次日取300
µ
l的菌液于20mllb液体培养基中(含100ul10mg/ml的卡那霉素和100ul10mg/ml的利福平),200 rpm,28℃震荡培养6-7 h;用分光光度计检测od
600
至0.5-0.6;5000 rpm室温离心10 min收集菌体,菌体用无菌水稀释至od
600
=0.1-0.2,即得含有wrky71-pbi121质粒的eha105农杆菌侵染液。
57.实施例2:一种抑制番茄果实成熟的基因slwrky71及其调控方法
一、瞬时过表达slwrky71抑制番茄果实的成熟。
58.构建的wrky71-psak277重组载体通过农杆菌转化到野生型(wt)的番茄植株果实中。果实中的wrky71表达量显著高于对照组,表明果实中slwrky71被成功高表达。同时,通过对果实成熟时间的记录表明, wrky71被高表达的番茄果组织成熟进程被抑制,而对照组番茄无明显表型(图1)。此外,通过测定以上两组果实中色素含量变化也反映出,slwrky71的高表达会导致果实成熟表型减慢(图2)。slwrky71被沉默的果实中总叶绿素的含量在侵染后的4天和7天时,都显著高于对照组果实(p《0.01)。在wrky71-psak277侵染番茄果实后的4天和7天,果实中的β-类胡萝卜素的含量显著低于对照组果实(p《0.01)。以上的结果表明,slwrky71的高表达导致果实成熟过程中色泽转变的关键色素合成和降解的速率减慢,直接为slwrky71的高表达导致果实成熟速度减慢提供了证据。
59.二、利用病毒诱导的基因沉默技术沉默表达slwrky71促进番茄果实成熟。
60.构建的trv-wrky71重组载体通过农杆菌转化到野生型(wt)的番茄植株果实中。果实中的wrky71表达量相对于对照组被显著抑制,表明trv技术成功的沉默了果实中slwrky71的表达。同时,通过对果实成熟时间的记录表明,当slwrky71被沉默时,番茄果实的成熟进程被明显加快,其成熟时间被提前约10天 (图3)。此外,通过测定以上两组果实中色素含量变化也反映出,slwrky71的沉默会加速果实成熟(图4)。slwrky71被沉默的果实中总叶绿素的含量在侵染后的第10天和第20天,都显著高于对照组果实(p《0.01)。在trv-wrky71侵染番茄果实后的第10天和第20天,果实中的β-类胡萝卜素和番茄红素的含量也都显著低于对照组果实(p《0.01)。以上的结果表明,slwrky71的沉默表达导致果实成熟过程中色泽转变速率加快,直接为slwrky71的沉默导致果实成熟速度加快提供了证据。
61.三、slwrky71的crispr-cas9基因编辑植株构建。
62.测序结果表明,通过靶点接头制备、两轮pcr扩增、载体连接以及质粒的转化等实验步骤,slwrky71的双靶点与grna表达盒成功构建(图3)。经过无菌组培实验获得的阳性番茄植株的测序结果表明“ttgtaaagaattcat”序列上方有54个碱基缺失,而反义链为复杂突变(图6),这表明slwrky71的基因编辑植株(wrky71)构建成功。
63.四、slwrky71的缺失导致番茄果实成熟进程加速。
64.通过记录crispr-cas9基因编辑技术构建slwrky71基因编辑植株(wrky71)和野生型番茄果实的成熟时间。结果表明,缺失slwrky71的番茄果实成熟时间被提前5天(图7)。通过对果实成熟过程中颜色转变的关键色素含量测定(图8),wrky71中的叶绿素含量始终低于野生型(p《0.05)。wrky71果实中的β-类胡萝卜素的含量始终高于野生型番茄果实(p《0.05)。 wrky71果实中的番茄红素则始终高于野生型番茄果实(p《0.05)。以上的结果表明slwrky71是一个负向调控果实成熟的基因。
65.为了揭示slwrky71影响果实成熟过程的分子机制,我们对wrky71和wt的果实中的成熟关键基因进行了rt-qpcr表达量分析(图9)。结果表明,在番茄果实成熟过程中slwrky71缺失的果实中与类胡萝卜合成相关的基因psy、pds、zds表达量始终高于野生型。wrky71果实中的与叶绿素降解相关的基因nyc1、pao、pph、sgr1的表达量则始终高于野生型。以上结果从转录水平上证明了slwrky71是一种抑制番茄果实成熟的关键基因。
66.五、slwrky71高表达植株果实的成熟进程减慢。
67.通过两轮的pcr扩增、线性化载体和目的片段的体外同源重组以及质粒的转化成
功构建wrky71-pbi121载体,并利用无菌的组培实验筛选得到wrky71的高表达植株(wrky71-oe)。通过对wrky71-oe番茄果实和野生型番茄果实成熟时间的记录表明,wrky71-oe番茄果实成熟进程大概提前5天左右(图10)。直接表明wrky71是番茄果实成熟的抑制子。
68.以上所述者仅为用以解释本发明之较佳实施例,并非企图具以对本发明做任何形式上之限制,是以,凡有在相同之发明精神下所作有关本发明之任何修饰或变更,皆仍应包括在本发明意图保护之范畴。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1