一种从虾组织中提取基因组DNA的改良方法与流程
一种从虾组织中提取基因组dna的改良方法
技术领域
1.本发明涉及生物工程领域,更具体地说,它涉及一种从虾组织中提取基因组dna的改良方法。
背景技术:
2.现有技术中有许多从不同样品中分离核酸的方法。然而,相同的方法并不是对所有样品都同样有效。例如,使用一种方法,核酸可以从组织、血浆、血清或尿液等特定样本中被有效地分离出来。然而,这种方法可能无法有效地从其他样本如虾组织样本中分离核酸,特别是含有高细胞数量、蛋白质和/或脂肪含量的虾组织样本,例如从对虾、基围虾、皮皮虾、小河虾、小龙虾等海洋及淡水虾的肌肉及头部组织中提取dna构成了特别的挑战。
3.目前基于旋转柱的核酸分离方法对处理虾肉样本的适用性非常有限,特别对虾、基围虾、皮皮虾、小河虾、小龙虾等海洋及淡水虾的肌肉及头部组织样本。使用已建立的核酸分离方法从各种虾肉样本中分离核酸时,由于这些样本的特殊组成,硅柱容易堵塞是主要问题。特别是高细胞数量,大量的蛋白质和/或脂质可能导致这种堵塞效应。硅柱被蛋白质及脂肪等物质堵塞,导致净化效率低,因此,很少甚至没有核酸被分离出来。此外,分离出的核酸经常被杂质/抑制物质及核酸酶污染,导致核酸得率很低,并且这损害了分离出的核酸的下游性能,特别是在rt-pcr等扩增反应中。这使得在分离出的核酸中对某一目标核酸的检测变得困难。此外,堵塞效应导致一次制样只能处理少量样品,通常,为了减少堵塞,必须限制样品的上样量不超过10mg。
4.当使用96道硅柱或自动化系统从大量样本中分离核酸时,上述的堵塞尤其会造成问题。因此,特别是在处理大量样本和/或使用自动化系统时,相应的核酸样本会丢失,丢失的样本数据将导致必须重新提供样本。
5.当分离虾肉组织样本中可能包含的特定目标核酸时,低的纯化效率和上样体积的限制是显著的缺点。例如,虾头部组织核酸,可能在虾肉组织样本中少量存在。低纯化效率和上样量的限制导致常规的核酸分离方法往往不允许分离足够数量的目标组织核酸,以便进行后续的标准检测试验,例如聚合酶链反应。而不同部位虾肉组织核酸的检测,是从各种虾肉组织中分离核酸的主要原因之一。
6.现有可参考申请公布号为wo2011157683a的专利申请文件,公开了一种基于硅柱的核酸提取方法,其裂解混合液的主要成分基于不同的潮盐(如盐酸胍或硫氰酸胍)及表面活性剂,并且在核酸与固定相的结合步骤中摒弃了硅柱,改用更适合高通量提取设备及自动化设备的磁珠,在后续洗涤液中适用不同浓度的乙醇,此方法在基因组dna提取过程中抑制dnase i活性表现并不理想。
7.现有可参考申请公布号为cn201810404724.0、cn201910971430.0、cn202111251984.7的专利申请文件中提到核酸结合固定相的使用采用磁珠而非硅柱,这有利于可行性组织的高通量自动化提取,但其裂解混合液成分仅适用或可能仅适用于某些哺乳动物组织及血液的提取,并不适合含有高细胞数量、大量的蛋白质和/或脂质的虾肉组
织,尤其是虾头组织。
8.因此,需要一种可靠、有效的方法,同时也适用于自动化并可以从虾组织中分离核酸。
技术实现要素:
9.针对现有技术存在的不足,本发明的目的在于提供一种从虾组织中提取基因组dna的改良方法,解决从虾组织中提取核酸得率低及核酸降解的问题。
10.为实现上述目的,本发明提供了如下技术方案:一种从虾组织中提取基因组dna的改良方法,包括以下步骤:
11.s1、裂解:向虾组织中加入裂解液和酶,得到含有核酸的裂解溶液;所述裂解液包括聚氧乙烯十六烷基醚硫酸钠,至少一种表面活性剂,至少一种吸潮剂;所述酶为蛋白酶k和rna酶;
12.s2、结合:向裂解溶液中加入结合液和磁珠,得到结合体;所述结合液包括异丙醇,盐酸胍和非离子型洗涤剂;
13.s3、清洗:使用乙醇清洗结合体;
14.s4、洗脱:将清洗后的结合体用洗脱液洗脱,得到虾组织dna;所述洗脱液为te缓冲液。
15.通过采用上述技术方案,由于向虾组织中加入了裂解液和酶,从而可以酶解与核酸结合的蛋白,并降解rna;通过在裂解液中加入聚氧乙烯脂肪醇醚硫酸钠,可以有效抑制样品中dnase i的活性,防止基因组dna在提取的过程中发生降解,并促进与dna双螺旋结构结合的组蛋白降解,进而提高dna纯度和得率。
16.进一步地,所述聚氧乙烯十六烷基醚硫酸钠为聚氧乙烯脂肪醇醚硫酸钠。
17.进一步地,所述裂解液包括聚氧乙烯脂肪醇醚硫酸钠、0.1%-5%十二烷基磺酸钠、1.0-2.0m硫氰酸胍。
18.进一步地,所述裂解液还包括乙二胺四乙酸、三羟甲基氨基甲烷、tritonx-100、tween 20的任意混合物;
19.进一步地,所述聚氧乙烯脂肪醇醚硫酸钠的浓度为1%-10%。
20.进一步地,所述聚氧乙烯脂肪醇醚硫酸钠的浓度为5.5%。
21.进一步地,所述虾组织包括但不限于虾头组织和虾肉组织。
22.进一步地,所述虾包括但不限于对虾、基围虾、皮皮虾、小河虾、小龙虾等海洋虾和淡水虾。
23.综上所述,本发明具有以下有益效果:
24.由于本发明采用由于向虾组织中加入了裂解液和酶,从而可以酶解与核酸结合的蛋白,并降解rna;通过在裂解液中加入聚氧乙烯脂肪醇醚硫酸钠,可以有效抑制样品中dnase i的活性,防止基因组dna在提取的过程中发生降解,并促进与dna双螺旋结构结合的组蛋白降解,进而提高dna纯度和得率。通过本发明的方法,可以提高虾组织的上样量至20mg,且得到的虾组织核酸纯度提高,虾组织核酸得率从不足10ng/ul提升至50ng/μl以上。
附图说明
25.图1是从虾组织中提取基因组dna的琼脂糖凝胶电泳图,从左到右依次显示的是实施例1、实施例2和对比例1;
26.图2是本发明实施例3-5及对比例2的琼脂糖凝胶电泳图;
27.图3是本发明实施例6-11的琼脂糖凝胶电泳图;
28.图4是本发明实施例12-16及对比例3的琼脂糖凝胶电泳图。
具体实施方式
29.以下结合实施例对本发明作进一步详细说明。本发明所使用的试剂均可通过市售购买得到。
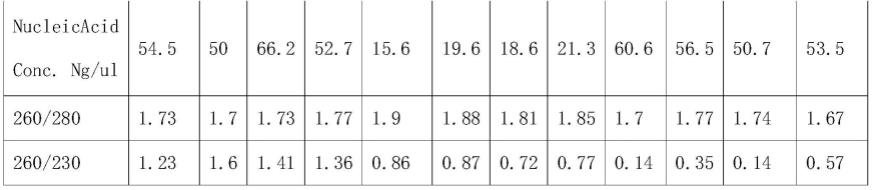
30.实施例1
31.向20mg虾组织中加入由聚氧乙烯脂肪醇醚硫酸钠、乙二胺四乙酸、三羟甲基氨基甲烷和十二烷基磺酸钠组成的裂解液进行裂解,并加入蛋白酶k及rna酶20ul,得裂解溶液。然后,在裂解溶液中加入异丙醇、盐酸胍和非离子型洗涤剂tween 20、triton x-100组成的结合液,所得到的结合混合物包括2.31m硫氰酸胍、13%异丙醇、10mm三羟甲基氨基甲烷和3.5%聚氧乙烯脂肪醇醚硫酸钠。后续通过磁珠法,用75%的乙醇清洗两次,用te缓冲液洗脱核酸。
32.实施例2
33.向20mg虾组织中加入由十二烷基磺酸钠、乙二胺四乙酸和三羟甲基氨基甲烷组成的裂解液进行裂解,并加入蛋白酶k及rna酶20ul,得裂解溶液。然后,在裂解溶液中加入异丙醇、硫氰酸胍和非离子型洗涤剂tween 20、triton x-100组成的结合液,所得到的结合混合物包括总浓度为2.3m的潮盐gtc和guhcl,13%的异丙醇和10mm三羟甲基氨基甲烷。后续通过磁珠法,用75%的乙醇清洗两次,用te缓冲液洗脱核酸。
34.对比例1
35.向20mg虾组织中加入由硫氰酸胍、异丙醇和非离子型洗涤剂tween 20、triton x-100组成的裂解液进行裂解,并加入蛋白酶k及rna酶20ul,得裂解溶液。然后,在裂解溶液中加入硫氰酸胍和乙醇组成的结合液,所得到的结合混合物包括总浓度为2m硫氰酸胍、33%乙醇和triton x-100的潮盐混合液。后续通过磁珠法,用75%的乙醇清洗两次,用te缓冲液洗脱核酸。
36.以上实施例1-2和对比例1分离的核酸均取1μl用于后续的nanodrop核酸定量及琼脂糖电泳,其中,以pbs为阴性对照。在实验中获得的nanodrop核酸浓度值越高说明分离核酸中dna浓度越高,琼脂糖电泳较亮的主dna条带为基因组dna,主带越明显说明核酸分离的基因组dna越完整,没有拖尾及降解现象说明基因组dna在提取过程中没有发生降解。结果如图1和表1所示。
37.表1实施例1-2及对比例1虾组织提取基因组dna的nanodrop测量结果
38.[0039][0040]
图1显示实施例1提取的主带基因组dna完整并有较高的得率,对应表1中的数据,实施例1提取的基因组dna浓度较高;图1显示实施例2提取的基因组dna得率较低,对应表1中的数据,实施例2提取的基因组dna浓度较低;图1显示对比例1提取的基因组dna主带几乎全部降解,然而对应表1中的数据,对比例1获得的dna浓度高于实施例2,单纯看nanodrop的结果,并不能表明基因组dna的实际浓度,这是由于dna降解所致。以上说明,裂解液中添加聚氧乙烯脂肪醇醚硫酸钠,尽管后续操作与其他方案相同或类似,却能有效提高虾肉基因组dna得率并防止dna降解。
[0041]
对比例2
[0042]
与实施例1不同之处在于,裂解液为1.81m硫氰酸胍,5%十二烷基磺酸钠和6.5%tween 20。
[0043]
实施例3
[0044]
与实施例1不同之处在于,裂解液为1.81m硫氰酸胍、2%聚氧乙烯脂肪醇醚硫酸钠和6.5%tween 20。
[0045]
实施例4
[0046]
与实施例1不同之处在于,裂解液为1.81m硫氰酸胍,4%聚氧乙烯脂肪醇醚硫酸钠,0.3%十二烷基磺酸钠。
[0047]
实施例5
[0048]
与实施例1不同之处在于,裂解液为1.81m硫氰酸胍,8%聚氧乙烯脂肪醇醚硫酸钠,0.3%十二烷基磺酸钠。
[0049]
对比例2、实施例3-5的nanodorp检测结果及琼脂糖凝胶电泳图分别见表2和图2。
[0050]
表2对比例2、实施例3-5虾组织提取基因组dna的nanodrop测量结果
[0051][0052]
由图2和表2可知,对比例2即使nanodorp检测的结果显示dna浓度较高,但是核酸发生了降解;实施例3-5中,尽管聚氧乙烯脂肪醇醚硫酸钠的终浓度不同,但均获得较高浓度的dna浓度,并且从图2上看到,随着聚氧乙烯脂肪醇醚硫酸钠浓度增加,基因组dna的完整性没有明显变化,并都较为完整,当聚氧乙烯脂肪醇醚硫酸钠终浓度在2.5%左右时,获得的基因组dna浓度较高,主带较亮。
[0053]
实施例6
[0054]
与实施例1不同之处在于,裂解液为4%聚氧乙烯脂肪醇醚硫酸钠、1.81m硫氰酸胍、5%十二烷基磺酸钠、20mm氯化镁。
[0055]
实施例7
[0056]
与实施例1不同之处在于,裂解液为4%聚氧乙烯脂肪醇醚硫酸钠、2.5m盐酸胍、5%十二烷基磺酸钠、20mm氯化镁。
[0057]
实施例8
[0058]
与实施例1不同之处在于,裂解液为4%聚氧乙烯脂肪醇醚硫酸钠、1.81m硫氰酸胍、5%十六烷基三甲基溴化铵、20mm氯化镁。
[0059]
实施例9
[0060]
与实施例1不同之处在于,裂解液为4%聚氧乙烯脂肪醇醚硫酸钠、2.5m盐酸胍、5%十六烷基三甲基溴化铵、20mm氯化镁。
[0061]
实施例10
[0062]
与实施例1不同之处在于,裂解液为1.81m硫氰酸胍、5%十六烷基三甲基溴化铵、20mm氯化镁。
[0063]
实施例11
[0064]
与实施例1不同之处在于,裂解液为2.5m盐酸胍、5%十六烷基三甲基溴化铵、20mm氯化镁。
[0065]
实施例6-11琼脂糖凝胶电泳图见图3。由图3可知,使用本发明的方法的不同组合的裂解液都能够从测试的虾组织样本中分离出核酸,但是,使用不同组合的裂解液对基因组dna降解影响不同,在添加聚氧乙烯脂肪醇醚硫酸钠的裂解液中,即便使用不同表面活性剂及盐粒子组合,均能有效防止基因组dna降解,并获得较高浓度的核酸。
[0066]
根据实施例1的方法,分别处理不同的虾组织样品,从其中提取其基因组dna,即为实施例12-16,并进行核酸的分光光度计测量和琼脂糖凝胶电泳,结果见表3和图4。其中,对比例3为使用对比例1的方法处理对虾。
[0067]
表3从对虾、基围虾、皮皮虾、小河虾、小龙虾提取的基因组dna的nanodrop测量结果
[0068][0069]
由表3可知,使用本发明的方法,可以处理不同虾组织样品并从中提取基因组dna,从图4可知,实施例12-16制备得到核酸电泳条带清晰,说明可以制备得到较高浓度和完整度的核酸,能有效防止上述多种虾组织样品的核酸降解。
[0070]
本具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1