GhASPG1基因在调控棉花耐盐胁迫中的应用
ghaspg1基因在调控棉花耐盐胁迫中的应用
技术领域
1.本发明属于生物基因技术领域,具体涉及一种ghaspg1基因在调控棉花耐盐胁迫中的应用。
背景技术:
2.土壤盐渍化是制约我国乃至全球农业生产最主要的非生物胁迫之一,超过6%(9亿公顷)世界陆地总面积的土壤面临盐渍化问题(tuteja,2007;munns et al.,2008),超过20%的世界耕地和50%的世界灌溉土地正面临土壤盐渍化问题(zhu,2001)。作为纺织工业中最重要的纤维作物之一,棉花在我国国民经济中一直占有非常重要的地位。我国是世界上最大的棉花生产国和消费国。陆地棉(gossypium hirsutum l.aadd,2n=52),纤维产量高,在生产上被广泛种植。新疆是我国棉花主产区,同时也是我国土壤荒漠化大区。新疆拥有我国最大的盐土区,土壤盐渍化面积约占全国盐渍化土壤面积的1/3,占陆地总面积的6.6%。培育耐盐棉花品种应用于新疆棉花生产对于我国棉花产业意义重大。近年来,棉花耐盐基因的筛选取得了一定的进展(zhou et al.,2016;gao et al.,2018)。但是棉花耐盐基因的功能研究并不深入(ashraf et al.,2018)。因此,加快棉花耐盐基因功能鉴定以及分子机制研究,对于培育耐盐棉花新品种具有一定的指导意义。
3.天冬氨酸蛋白酶包括一个蛋白水解酶亚家族,其具有两个高度保守的天冬氨酸酯,用于催化其肽底物(szecsi,1992)。它们分布于各种生物中,包括病毒、细菌、真菌、植物和动物(davies et al.,1990;rawlings and barrett,1995)。拟南芥基因组中至少含有51种假定的天冬氨酸蛋白酶,但其生理和生化功能仍然难以捉摸(faro and gal,2005)。许多研究表明天冬氨酸蛋白酶在拟南芥发育过程中发挥重要作用(xia et al.,2004;ge et al.,2005)。有研究报道aspg1基因参与非生物胁迫,例如aspg1基因参与拟南芥植株的干旱胁迫和响应aba(yao et al.,2012)。
技术实现要素:
4.本发明针对现有技术中的不足,目的是提供一种ghaspg1基因在调控棉花耐盐胁迫中的应用。
5.为达到上述目的,本发明的解决方案是:
6.ghaspg1基因在调控棉花耐盐胁迫中的应用。
7.优选地,ghaspg1基因的核苷酸序列如seq id no.3所示。
8.优选地,ghaspg1基因编码多肽的氨基酸序列如seq id no.4所示。
9.优选地,ghaspg1基因提高棉花的耐盐胁迫。
10.一种重组质粒,该重组质粒含有ghaspg1基因片段,开放阅读框具有如seq id no.3所示的序列。
11.一种重组载体,其包括ghaspg1基因和载体。
12.优选地,ghaspg1基因的开放阅读框具有如seq id no.3所示的序列。
13.优选地,载体为pyl156。
14.由于采用上述方案,本发明的有益效果是:
15.本发明从荧光定量结果表明该ghaspg1基因与盐胁迫相关,从陆地棉tm-1中克隆出棉花ghaspg1基因,该基因构建病毒诱导的沉默复合体,侵染棉花,测定了丙二醛和脯氨酸的含量,证实了沉默该基因降低了棉花的耐盐胁迫能力。
附图说明
16.图1为本发明的实施例2中ghaspg1基因参与植物的生长过程示意图。
17.图2为本发明的实施例6中pyl156、pyl156:ghaspg1、pyl156:pds耐盐结果示意图。
具体实施方式
18.本发明提供了一种ghaspg1基因在调控棉花耐盐胁迫中的应用。
19.实验材料
20.1.棉花材料
21.本实验采用棉花tm-1品种进行盐处理,该品种种植于温室中,两叶一心期进行200mm nacl处理,分别在0h、1h、3h、6h、12h、24h和48h取样。
22.2.试剂和耗材
23.限制性内切酶、高保真酶、胶回收试剂盒、质粒小提试剂盒购自诺唯赞生物有限公司。
24.其他药品:琼脂糖为西班牙原装产品,氯化钠等为国产分析纯,氨苄青霉素等购自宝生物工程大连有限公司,大肠杆菌感受态细胞dh5α购自北京擎科生化科技公司。
25.培养基:lb液体培养基:胰蛋白胨(tryptone)10g/l、酵母提取物(yeast extract)5g/l、氯化钠(nacl)10g/l;lb固体培养基:胰蛋白胨(tryptone)10g/l、酵母提取物(yeast extract)5g/l、氯化钠(nacl)10g/l、琼脂粉15g/l,定容至1l;lb选择培养基:在lb铺平板前,待培养基高压灭菌冷却至55℃时加入相应浓度抗生素,摇匀后铺平板。
26.主要仪器:pcr扩增仪(bio-rad)、高速离心机(hettich mikro 200r)、电泳设备(bio-rad)、凝胶成像系统(bio-rad)、荧光定量pcr仪(abi7500)、电热恒温培养箱(上海森信)、恒温培养振荡器(上海智城)、人工气候室。
27.实施例1:
28.1.棉花ghaspg1基因和启动子的克隆与生物信息学分析
29.cottonfgd检索ghaspg1的基因序列,采用ncbi的primer-blast网站设计引物,采用pcr(polymerase chain reaction)的方法从陆地棉标准系tm-1中扩增,其cds全长1479bp,编码492个氨基酸,蛋白的相对分子量为52.4kda,等电点为6.65。基因结构显示该基因含有1个外显子。
30.上游引物f:5
’‑
atggctacttcagtatcttcttc-3’(seq id no.1);
31.下游引物r:5
’‑
ttaacatttgtgaggagagaacc-3’(seq id no.2)。
32.cds序列(seq id no.3)为:
33.atggctacttcagtatcttcttcaaagctttcccttttcttcttgttttcgttcttgtttacttccactttagctcgtaattccccttcaccaacaacaaaaatcctcgatgtcttagcttctttgaaacaaactcaacatatt
ctttcctttgatcctcaaatttctaatggcttttccaaaagccagccccttttcttcaactcttcttcttcatcgggttctgctttttcgattccacttcattcacggggctcattgcgcaaaacccatcatgttgattataaaaacctggtccgaacccgactcgaccgtgactcagcccgagttaactcgctcaccaccgaggtactactcgctgtcaatgggattcgcaaaactgagctgaagcctgttgttaccgagttagaaccagaggcgctttccacccctgttatttccggtatgagccaagggagtggggagtattttacccgggtcggagtcggtaacccagctaaacaattctacatggttcttgataccgggagtgatgttaattggatccaatgtgaaccatgtacggattgttaccaacaatccgacccgatttttaacccgtcggcgtcgtcgacttacagtccggttacttgcgagtcaaggcaatgttcttatctacgacaatcggcttgtcgtagcgggaaatgtctttaccaggtgtcttacggtgatggatcttacacagtaggtgattttgtgactgaaacggtgtcatttgggaactccggtgatatcaaaggcgttgctttgggttgtggccataccaacgaaggcttatttgttgcagctgccggtttagttggactcggtggtggtcccttgtctttaacatctcagattaaagcgacgtcgttttcttattgtttagtggatcgtgactcagcgggttcatcgacgttggatttcaactccgggttaccggctgactcagtggttgctccgttaataaggagccgaaaggtggataccttttattacgtcggactgaccgggcttagcgtaggcggccaaccggtacaactcccgccgggctttttcgagttggaacaatcgggaaacggaggagtgatcgtcgactgcgggacggccataacacggttgcaagcggaggcttacaacgcactccgtgacgcgttcgtgaaattaacgccggacttgccgacgaccggtgggtttgcgttgttcgacacgtgctacgacttgtcttcaagaaccagtgttagggtcccgacggttgcgtttcatttcagcggcggactgtcactggaattgccggcgaaaaattatttgataccggtggactcctcgggaacgttttgcttggcgtttgcccccacgacgtcgtctttgtctataattgggaacgtacaacagcaagggacacgtgtgagcttcgacttggctaataataagatcgggttctctcctcacaaatgttaa。
34.编码的氨基酸序列(seq id no.4)为:
35.matsvsssklslfflfsflftstlarnspspttkildvlaslkqtqhilsfdpqisngfsksqplffnsssssgsafsiplhsrgslrkthhvdyknlvrtrldrdsarvnslttevllavngirktelkpvvtelepealstpvisgmsqgsgeyftrvgvgnpakqfymvldtgsdvnwiqcepctdcyqqsdpifnpsasstyspvtcesrqcsylrqsacrsgkclyqvsygdgsytvgdfvtetvsfgnsgdikgvalgcghtneglfvaaaglvglgggplsltsqikatsfsyclvdrdsagsstldfnsglpadsvvaplirsrkvdtfyyvgltglsvggqpvqlppgffeleqsgnggvivdcgtaitrlqaeaynalrdafvkltpdlpttggfalfdtcydlssrtsvrvptvafhfsgglslelpaknylipvdssgtfclafapttsslsiignvqqqgtrvsfdlannkigfsphkc。
36.2.ghaspg1非生物胁迫下的表达模式分析
37.棉花tm-1品种种植于沙子中于本课题人工气候室,在恒温25℃下培育,光照16h,黑暗6h。棉花生长至三叶期采用200mm nacl溶液处理,取处理后0h、1h、3h、6h、9h、12h和24h的棉花根组织样品。棉花tm-1品种种植于营养土中本课题人工气候室,在恒温25℃下培育,光照16h,黑暗6h。棉花生长至三叶期采用100μm aba处理棉花叶片,取处理后0h、0.5h、1h、2h、3h、6h、9h和12h棉花叶片组织。取陆地棉中棉所24号的根、茎、叶、芽、花瓣、雌蕊、雄蕊和纤维样品。组织样品提取rna,反转录,稀释5倍后进行qrt-pcr实验。实验步骤如下:
38.rna的提取步骤如下:
39.以下所有离心步骤均在室温下进行。
40.1)匀浆处理:100mg植物叶片在液氮中迅速研磨成粉末,加入700μl sl(使用前加入β-巯基乙醇),立即剧烈震荡使样品混匀。注意1:对于预期rna得率小于10μg的植物样本,请使用100mg的起始样本量;对于富含淀粉的样本或成熟叶片,请将裂解液sl用量增加至700μl。注意2:由于植物多样性非常丰富,而且同种植物的不同生长发育阶段和不同组织的
[0064][0065][0066]
用移液器轻轻吹打混匀。
[0067]
5.进行逆转录反应
[0068][0069]
1μg rna反转录为cdna,将反转录产物cdna溶液稀释5倍作为pcr反应模板。
[0070]
实施例2:
[0071]
荧光定量验证的过程如下:
[0072]
分别设计ghaspg1和内参基因actin荧光定量的引物:
[0073]
ghaspg1上游引物:5
’‑
ccacttcattcacggggctcat-3’(seq id no.5);
[0074]
下游引物:5
’‑
aggcttcagctcagttttgcga-3’(seq id no.6);
[0075]
actin上游引物:5
’‑
atcctccgtcttgaccttg-3’(seq id no.7);
[0076]
下游引物:5
’‑
tgtccgtcaggcaactcat-3’(seq id no.8)。
[0077]
冰上配制qrt-pcr反应体系,进行荧光定量pcr反应。
[0078]
pcr反应体系为:
[0079][0080]
pcr反应程序:
[0081][0082]
融解曲线分析
[0083]
95℃、15s;60℃、1min;95℃、15s;60℃、15s。
[0084]
荧光定量结果显示,ghaspg1基因在盐处理12h表达量最高,是受盐胁迫上调表达的基因;ghaspg1在aba处理12h表达量最高,ghaspg1的转录水平在aba处理的不同时间段没有明显的差异,因此探究了ghaspg1基因的组织表达模式。组织表达特异性荧光定量结果显示ghaspg1基因在叶中表达量最高,因此ghaspg1基因可能参与植物的生长过程和非生物胁迫反应,如图1所示。
[0085]
实施例3:
[0086]
ghaspg1 cds序列的克隆
[0087]
1.在棉花的盛花期,取棉花tm-1品种成熟的棉花叶片,速冻于液氮,存于-80℃冰箱备用。提取rna进行反转录。
[0088]
2.基因克隆的pcr反应体系、程序和产物检测。
[0089]
1)pcr反应体系
[0090]
所有操作请在冰上进行,各组分解冻后请充分混匀,用完之后请及时放回-20℃保存。
[0091][0092]
2)pcr反应程序
[0093][0094]
3)pcr产物的检测
[0095]
取2μl pcr产物,加入2μl 6
×
loading buffer,混匀,点样于1%琼脂糖凝胶,电泳检测。
[0096]
3.pcr产物的胶回收
[0097]
1)dna电泳结束后,在紫外光灯下快速切下含目的dna片段的凝胶,建议用纸巾吸尽凝胶表面液体并切碎,并尽量去除多余的凝胶。称取凝胶重量(去除空管重量),100mg凝胶等同于100μl体积,作为一个凝胶体积。
[0098]
2)加入等倍体积buffer gdp。50-55℃水浴7-10min,根据凝胶大小适当调整时间,确保凝胶块完全溶解。水浴期间颠倒混匀2次加速溶胶。
[0099]
3)短暂离心收集管壁上的液滴。将fastpure dna mini columns g吸附柱置于collection tubes2 m收集管中,把《700μl溶胶液转移至吸附柱中,12,000rpm(13,400rpm)离心30-60s。若溶胶体积大于700μl,把吸附柱置回收集管中,剩余的溶胶液转移至吸附柱中,12,000rpm(13,400rpm)离心30-60s。
[0100]
4)弃滤液,把吸附柱置于收集管中。加入300μl bufer gdp至吸附柱中。静置1min。12,000rpm(13,400rpm)离心30-60s。
[0101]
5)弃滤液,把吸附柱置于收集管中。加入700μl buffer gw(已加入无水乙醇)至吸附柱中。12,000rpm(13,400rpm)离心30-60s。
[0102]
6)重复步骤5)
[0103]
7)弃滤液,把吸附柱置回收集管中。12,000rpm(13,400rpm)离心2min。
[0104]
8)将吸附柱置于在1.5m灭菌的离心管中,加入20-30μl elution bufer至吸附柱中央,放置2min,12,000rpm(13,400rpm)离心1min,弃去吸附柱,把dna保存于-20℃。
[0105]
4.胶回收产物与载体pgadt7连接
[0106]
连接体系
[0107][0108]
使用移液器轻轻吹打混匀,短暂离心将反应液收集至管底,37℃反应30min,降至4℃或者立即置于冰上冷却。
[0109]
5.连接产物转化大肠杆菌
[0110]
1)向连接反应体系中加入100μl大肠杆菌dh5a感受态,冰浴30min;
[0111]
2)42℃水浴热激70s;
[0112]
3)冰水浴孵育2min;加入800μl无抗性的lb液体培养基,37℃,150rpm,孵育1h;
[0113]
4)离心收菌,5000rpm,2min,弃上层上清,留约150μl混匀后涂布含kna抗性的lb平板;
[0114]
5)37℃,恒温培养过夜。
[0115]
6.阳性克隆的检测及测序
[0116]
1)从转化平板上挑取白色菌落,放入含有kna的液体lb液体培养基中,37℃恒温摇床培养8h;
[0117]
2)菌落pcr验证阳性克隆,将验证正确的单克隆送到尚亚生物科技有限公司测序,每个序列测3个重复。
[0118]
7.阳性菌液的保存
[0119]
菌液pcr验证且测序正确的菌液中加入一定量的甘油,使甘油终浓度在20%左右,-80℃保存。
[0120]
实施例4:
[0121]
pyl156-ghaspg1病毒诱导的沉默复合体的构建
[0122]
1.设计沉默片段
[0123]
在sgn vigs tool网站设计基因的沉默片段,在ncbi的primer-blast网站上设计引物,基因的引物如下:
[0124]
上游引物f:5
’‑
atttgggaactccgg-3’(seq id no.9);
[0125]
下游引物r:5
’‑
ggttggccgcctacg-3’(seq id no.10)。
[0126]
2.带有特定酶切位点的目的基因片段的获得
[0127]
为了扩增基因的沉默片段,并加上特定酶切位点,在沉默片段引物上加含有适合酶切位点引物。所用酶切位点为xbai和bamhi。
[0128]
ghaspg1酶切位点引物序列如下:
[0129]
上游引物f:5
’‑
aaggttaccgaattctctagaatttgggaactccgg-3’(seq id no.11);
[0130]
下游引物r:5
’‑
gagctcggtaccggatccggttggccgcctacg-3’(seq id no.12)。
[0131]
2.pyl156-ghaspg1植物沉默载体的构建
[0132]
具体过程为:将pyl156质粒分别用bamhi和xbai双酶切,以基因的cds片段为模板,用含有酶切位点的引物扩增,电泳回收目的片段和pyl156载体的大片段产物;目的基因片段和pyl156的酶切大片段产物t4连接酶连接过夜;连接产物转化大肠杆菌dh5α,37℃培养过夜;挑取单克隆摇菌,测序验证序列的正确性。
[0133]
3.转化农杆菌
[0134]
利用冻融法转化根癌农杆菌lba4404感受态细胞,具体转化过程如下:
[0135]
1)-80℃农杆菌融化,冰水混合状态插入冰中;
[0136]
2)根癌农杆菌lba4404感受态细胞100μl中加入质粒1μg,用手拨打管底混匀,依次于冰上静置5min,液氮速冻5min,37℃水浴5min,冰浴5min;
[0137]
3)加入700μl无抗生素的lb液体培养基,190rpm,28℃,培养2h后取150μl菌液涂在含有卡那霉素和利福平的lb筛选培养基上,28℃培养大约48h,抗性菌落可见;
[0138]
4)挑选阳性克隆,在含有卡那霉素和利福平的lb液体培养基上28℃培养48h,甘油终浓度在20%左右,-80℃保存备用。
[0139]
实施例5:
[0140]
病毒诱导的沉默复合体侵染棉花
[0141]
1)将-20℃保存的pyl156、pyl156:ghaspg1、pyl156:pds和pyl192农杆菌菌液20μl接种到1ml含有卡那霉素和利福平的lb液体培养基中,28℃、180rpm振荡培养过夜,取活化菌液200μl加入到50ml lb液体培养基28℃、180rpm振荡培养;
[0142]
2)待菌液od
600
值约为1.5-2.0时,3000rpm离心菌液收集菌体,离心10min;
[0143]
3)转化介质配方为:
[0144][0145]
4)用上述转化介质悬浮菌体,调od至1.5,黑暗静置3h后,pyl156、pyl156:ghaspg1、pyl156:pds和pyl192等量混匀;
[0146]
5)等到子叶展平时,用针头在子叶背部轻轻划出一个口子,1ml注射器将菌液注射到棉花子叶中。
[0147]
实施例6:
[0148]
vigs棉花植株的表型鉴定
[0149]
1.等植株生长至三叶期,取植物叶片测定基因表达量;
[0150]
2.200mm nacl溶液处理棉花植株;
[0151]
3.脯氨酸和mda含量的测定。
[0152]
脯氨酸含量的测定参照索莱宝公司脯氨酸(pro)含量检测试剂盒步骤如下所示:
[0153]
样本处理:
[0154]
组织样本的制备:称取约0.1g组织,加入iml提取液进行冰浴匀浆,之后置水浴振荡提取10min,10000rpm,常温离心10min,取上清,冷却后待测。
[0155]
测定步骤:
[0156]
1)分光光度计预热30min以上,调节波长至520nm,用甲苯调零。
[0157]
2)标准品的处理:将标准品用蒸馏水稀释为20μg/ml、10μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0μg/ml。
[0158]
3)取0.5ml上清液(或稀释后的标准品)+0.5ml冰乙酸+0.5ml试剂二(索莱宝公司脯氨酸(pro)含量检测试剂盒)于有盖试管中,置沸水浴中保温30min(盖紧,防止水分散失),每10min振荡一次。
[0159]
4)待冷却后,在试管中加入1ml甲苯,振荡30s,静置片刻,使色素转至甲苯中;吸取0.8-1ml上层溶液于1ml玻璃比色皿中,在520nm波长处比色,记录吸光值。
[0160]
5)根据标准品吸光值和浓度,建立标准曲线。
[0161]
pro含量计算
[0162]
通过标准曲线计算样品脯氨酸含量(y为脯氨酸含量,μg/ml;x为od值)
[0163]
按照组织质量计算
[0164]
pro含量(μg/g质量)=y
÷
w(w为组织样品的质量)
[0165]
mda含量的测定:
[0166]
组织样本的制备:称取约0.1g组织,加入1ml提取液进行冰浴匀浆;8000rpm,4℃离心10min,取上清,置冰上待测。
[0167]
测定步骤:
[0168]
1)分光光度计预热30min以上,蒸馏水调零。
[0169]
2)按下表步骤加样:
[0170]
3)试剂名称(μl)测定管空白管
[0171][0172]
混合液在100℃水浴中保温60min后(盖紧,防止水分散失),置于冰浴中冷却,10000rpm,常温,离心10min。取上清至1ml玻璃比色皿中,测定各样本在450nm、532nm和600nm处的吸光度,分别计算δa450=a450测定-a450空白,δa532=a532测定-a532空白,δa600=a600测定-a600空白。(空白管只需做1-2次)。
[0173]
按照样本质量计算
[0174]
mda含量(nmol/g质量)=5
×
(6.45
×
(δa532-δa600)-1.29
×
δa450)
÷w[0175]
综上,荧光定量结果显示该基因得到了有效沉默,沉默pds植株呈明显白化,观察发现沉默植株的叶片边缘严重萎蔫,而对照植株的叶片只有轻微的失水皱缩。为了了解盐
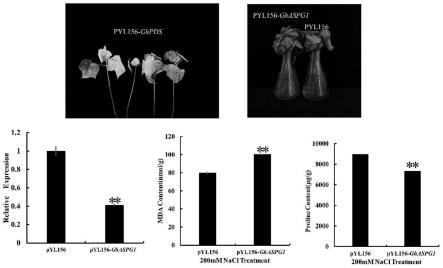
处理下植物体内生理指标变化,取盐处理后沉默植株和对照植株的叶片,测定了植株体内脯氨酸和mda的含量。结果显示,盐处理后对照植株叶片中mda的含量极显著低于沉默植株叶片中mda的含量;对照植株叶片中脯氨酸的含量极显著高于沉默植株叶片中脯氨酸的含量。因此,相对于对照植株,降低ghaspg1的表达水平可以导致棉花呈现盐敏感表型,如图2所示。
[0176]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1