一种合成用于制备BRD4蛋白抑制剂的中间体的方法与流程
一种合成用于制备brd4蛋白抑制剂的中间体的方法
技术领域
1.本发明涉及化学合成领域,具体涉及一种合成用于制备brd4蛋白抑制剂的中间体的方法。
背景技术:
2.bromodomain(brd)是一类能够特异性识别组蛋白中的乙酰化赖氨酸的保守蛋白结构域,通过与乙酰化赖氨酸结合促使染色质重塑因子和转录因子等相关蛋白富集于特定的转录位点,改变rna聚合酶ⅱ的活性,调节基因的转录表达。brd4蛋白能够直接导致rna拓扑异构酶ⅱ的c端磷酰化,影响rna聚合酶所介导的基因转录。研究证实,brd4蛋白与人类许多疾病的发生都有密切关系。
3.2010年报道了一类具有苯并二氮类化合物,例如i-bet762(2010,nature,v468,1119-1123),这类化合物与bet bromodomain brd4的bd1结构域和bd2结构域具有很高的结合能力。在动物模型上,i-bet762能够调控相关基因转录,具有治疗炎性疾病和肿瘤疾病的潜在疗效(2011,nature,v478,529-533)。三期临床化合物rvx-208,能够提高人体内高密度脂蛋白(hdl),其临床主要用于冠状动脉病变相关的心脏疾病治疗药物的开发。研究表明,rvx-208也具有结合bet bromodomain brd4的bd1和bd2结构域的功能。
4.otx-015是merck公司收购并临床开发的一类新颖的抗肿瘤药物。otx-015与bet bromodomain brd4的bd1结构域和bd2结构域具有很好的结合能力,在动物模型上,otx-015具有很好的抗肿瘤疗效(2013,cancer cell,v24,777-790)。
5.因此,研究bet bromodomain brd4的bd1结构域和bd2结构域抑制剂是一个重要的药物开发方向,在治疗糖尿病、炎性疾病、癌症和心脏疾病以及作为男性避孕药物方面,都具有潜在的药物应用前景。
6.wo2020156357a1报道了一种具有苯并七元环结构的化合物、其制备方法及其在制备用于治疗bet brd4的活性或表达量相关疾病的药物中的用途。在制备该化合物前,首先需要合成重要的中间体化合物。
7.wo2020156357a1中相关中间体合成路线如下:
[0008][0009]
其中,在合成1-(5-溴-2-碘苯基)内-2-烯-1-酮(c-3)的需要加热至110℃的第二步中,温度会瞬间从110℃升至160℃,存在巨大的潜在危险。并且,在合成3-叠氮基-1-(5-溴-2-(丙-1-炔-1-基)苯基)丙-1-醇(c-7)的第六步中,n,n-二甲基甲酰胺(dmf)的回流温度为153℃,时间是6-8个小时,而叠氮化合物在长时间高温加热的情况下存在发生爆炸的风险。同时,该合成路线以1-(5-溴-2氨基苯基)乙酮为起始原料,价格昂贵。
[0010]
因此,本领域亟需新的合成用于制备brd4蛋白抑制剂的中间体的方法,该方法不存在上述的问题,并且还可以采用价格低廉的起始原料。
技术实现要素:
[0011]
有鉴于此,本发明旨在提供一种新的合成用于制备brd4蛋白抑制剂的中间体d6的方法,以解决现有技术中存在的上述问题。
[0012]
本发明提供了一种合成用于制备brd4蛋白抑制剂的中间体d6的方法,所述中间体d6的结构如下所示:
[0013][0014]
其中x2表示卤素如cl、f或br;
[0015]
所述方法包括以下步骤:
[0016]
s1:使化合物d0 3-卤代丙酸甲酯与叠氮化试剂例如叠氮钠发生取代反应,得到化合物d1:
[0017][0018]
其中,x1表示卤素如f、cl、br或i;
[0019]
s2:使化合物d1与丙炔基化合物r
1-c≡c-ch3如1-(三甲基硅基)丙炔、以及cui发生click反应,得到化合物d2:
[0020][0021]
其中,r1为含硅基的末端炔烃保护基例如三甲基硅基;
[0022]
s3:使化合物d2与化合物d2-1发生suzuki反应,得到化合物d3:
[0023][0024]
其中,x2表示卤素如cl、f或br;
[0025]
s4:使化合物d3发生claisen缩合反应,得到化合物d4:
[0026][0027]
s5:使化合物d4发生krapcho反应,得到化合物d5:
[0028]
以及
[0029]
s6:使化合物d5发生还原反应,得到中间体d6:
[0030][0031]
在本发明提供的合成用于制备brd4蛋白抑制剂的中间体d6的方法中,通过使用3-卤代丙酸甲酯作为起始原料,相对于使用1-(5-溴-2-氨基苯基)乙酮作为起始原料,原料成本降低了七十多倍,并且通过起始原料的改变还避免了原路线出现的反应过程中剧烈放热的现象。本发明还进一步改进了合成路线,在低温下从化合物d1到d2合成小环,避免了原技术路线中温度瞬间上升(从110℃瞬间升至160℃)而存在的潜在危险,并且避免了叠氮化合物在长时间高温加热(在153℃加热8小时)的情况下会引起的叠氮爆炸风险。此外,在本发明的步骤s3中,通过筛选溶剂、硼酸类型、温度、催化剂以及碱,探索到比较合适的条件,大大提高了收率。
附图说明
[0032]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的实施方案。
[0033]
图1是中间体d1的氢谱图谱;
[0034]
图2是中间体d2’的氢谱图谱;
[0035]
图3是中间体d3’的氢谱图谱;
[0036]
图4是中间体d5’的氢谱图谱;
[0037]
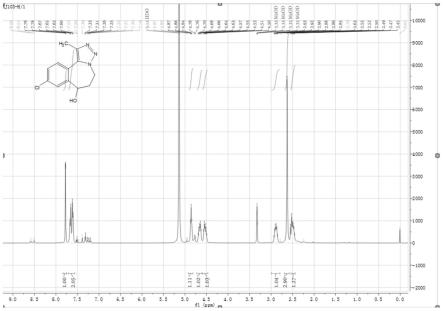
图5是中间体d6’的氢谱图谱。
具体实施方式
[0038]
下面将结合本发明的实施方案,对本发明进行清楚、完整的描述。显然,所描述的实施方案仅仅是本发明的一部分实施方案,而不是全部的实施方案。基于本发明中的实施方案,本领域普通技术人员可以获得的所有其他实施方案,都属于本发明保护的范围。
[0039]
在现有技术报道的brd4蛋白抑制剂的重要中间体d6的合成路线中,存在原料成本
过高、反应温度瞬间上升以及由于高温加热时间长而容易爆炸等问题。
[0040]
基于此,本发明提供了一种合成用于制备brd4蛋白抑制剂的中间体d6的方法,所述中间体d6的结构如下所示:
[0041][0042]
其中x2表示卤素如cl、f或br;
[0043]
所述方法包括以下步骤:
[0044]
s1:使化合物d0 3-卤代丙酸甲酯与叠氮化试剂例如叠氮钠发生取代反应,得到化合物d1:
[0045][0046]
其中,x1表示卤素如f、cl、br或i;
[0047]
s2:使化合物d1与丙炔基化合物r
1-c≡c-ch3如1-(三甲基硅基)丙炔、以及cui发生click反应,得到化合物d2:
[0048][0049]
其中,r1为含硅基的末端炔烃保护基例如三甲基硅基;
[0050]
s3:使化合物d2与化合物d2-1发生suzuki反应,得到化合物d3:
[0051][0052]
其中,x2表示卤素如cl、f或br;
[0053]
s4:使化合物d3发生claisen缩合反应,得到化合物d4:
[0054][0055]
s5:使化合物d4发生krapcho反应,得到化合物d5:
[0056]
以及
[0057]
s6:使化合物d5发生还原反应,得到中间体d6:
[0058][0059]
如本领域技术人员所理解的,取代反应指化合物或有机物分子中任何一个原子或原子团被试剂中同类型的其它原子或原子团所替代的反应。在本发明方法的步骤s1中,所述取代反应是用含n3的叠氮化试剂例如叠氮钠中的n3取代卤素。当然也可以使用本领域普通技术人员已知的其他叠氮化试剂,本发明对此不作进一步的限定。
[0060]
如本领域技术人员所理解的,click反应是指在还原剂和/或稳定配体存在下,叠氮化物和炔烃、铜(i)发生环加成反应形成类似酰胺键的稳定三唑部分[1,4-二取代(反)-1,2,3-三唑]的反应,也称为cuaac反应。在本发明方法的步骤s2中,所述取代反应是使叠氮化物即化合物d1与丙炔基化合物r
1-c≡c-ch3、cui发生环加成反应,得到化合物d2,其中,r1为含硅基的末端炔烃保护基例如三甲基硅基(tms)、甲基二苯基硅基(mdps)、三乙基硅基(tes)、二甲基异丙基硅基(dmips)、叔丁基二甲基硅基(tbs)、叔丁基二苯基硅基(tbdps)、叔己基二甲基硅基(tds)、三异丙基硅基(tips)等。当然也可以使用本领域普通技术人员已知的可以用于上述click反应的其他催化剂等,本发明对此不作进一步的限定。
[0061]
如本领域技术人员所理解的,suzuki反应是指在零价钯配合物催化下,芳基或烯基硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联。在本发明方法的步骤s3中,化合物d2与化合物d2-1在二(三苯基膦)二氯化钯的催化下发生交叉偶联反应,得到化合物d3。
[0062]
如本领域技术人员所理解的,claisen缩合反应是指含有α-活泼氢的酯类在醇钠等碱性缩合剂作用下缩合失去一分子醇得到β-酮酸酯类的反应。在本发明方法的步骤s4
中,化合物d3在碱性缩合剂例如叔丁醇钾的作用下发生claisen缩合反应得到化合物d4。当然也可以使用本领域普通技术人员已知的可以用于上述claisen缩合反应的其他碱性缩合剂等,本发明对此不作进一步的限定。
[0063]
如本领域技术人员所理解的,krapcho反应是指含活泼亚甲基的酯在碱金属盐存在下,在二甲基亚砜(dmso)中脱除烷氧羰基。在本发明方法的步骤s5中,化合物d4在碱金属盐例如氯化钠的存在下脱去烷氧羰基,得到化合物d5。当然也可以使用本领域普通技术人员已知的可以用于上述krapcho反应的其他碱金属盐等,本发明对此不作进一步的限定。
[0064]
如本领域技术人员所理解的,还原反应是指在还原剂的作用下在有机物分子中加入h原子或脱去o原子的反应。在本发明方法的步骤s6中,化合物d5在还原剂例如硼氢化钠的作用下发生还原反应,得到中间体d6。当然也可以使用本领域普通技术人员已知的可以用于上述还原反应的其他还原剂等,本发明对此不作进一步的限定。
[0065]
在一些实施方案中,所述步骤s1包括:在0-70℃的温度下进行所述取代反应。在进一步的实施方案中,所述步骤s1包括:在反应瓶中依次加入丙酮、水、3-溴丙酸甲酯、叠氮钠,并使其在0-70℃反应3-8小时;反应完毕后,降温,将反应液倒入水中,萃取,有机相用无水硫酸钠干燥,反应液减压浓缩。
[0066]
在一些实施方案中,所述步骤s2包括:在-10℃至80℃的温度下,在溶剂例如四氢呋喃中进行所述click反应。在进一步的实施方案中,所述步骤s2包括:在反应瓶中加入化合物d1、四氢呋喃、1-(三甲基硅基)丙炔、碘化亚铜、n,n-二异丙基乙胺,将温度控制在-10至80℃,加入脱保护剂如四丁基氟化铵(tbaf)与n-溴代琥珀酰亚胺(nbs),滴加完毕,撤去冰浴,室温搅拌过夜;反应结束后,抽滤,滤液减压浓缩,柱层析分离残余物。
[0067]
在一些实施方案中,所述步骤s3包括:在30℃-80℃的温度下,在催化剂例如二(三苯基膦)二氯化钯的作用下,在溶剂例如乙二醇二甲醚中,使所述化合物d2与d2-1进行所述suzuki反应,得到所述化合物d3。在进一步的实施方案中,所述步骤s3包括:在反应瓶中依次加入乙二醇二甲醚、d2、d2-1、碳酸钾、二(三苯基膦)二氯化钯,升温至30-160℃,反应5-30小时。反应完毕后,过滤,反应液加入水,乙酸乙酯(ea)萃取3次,合并有机相后用饱和食盐水洗涤,有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物。
[0068]
在一些实施方案中,所述步骤s4包括:在-20℃至20℃的温度下,在碱性缩合剂例如叔丁醇钾的作用下,发生所述claisen缩合反应。在进一步的实施方案中,所述步骤s4包括:在反应瓶中加入d3、四氢呋喃(thf),降温至-20至20℃,加入叔丁醇钾,反应1-6个小时;反应结束后,用酸中和,反应液倒入水中,ea萃取,合并有机相后用饱和食盐水洗涤,有机相用无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物。
[0069]
在一些实施方案中,所述步骤s5包括:在50℃-200℃的温度下,在碱金属盐例如氯化钠的存在下,在溶剂例如dmso和水中使所述产物d4发生krapcho反应,得到所述化合物d5。在进一步的实施方案中,所述步骤s5包括:在反应瓶中依次加入d4、dmso、氯化钠、水,升温至50-200℃,反应0.5-5小时;反应完毕后,降温,将反应液倒入水中,ea萃取,合并有机相后用饱和食盐水洗涤,再将有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物。
[0070]
在一些实施方案中,所述步骤s6包括:-10℃至30℃的温度下,在低级醇例如乙醇的溶剂中,在还原剂例如硼氢化钠的作用下,使化合物d5发生所述还原反应,得到中间体
d6。在本文中,所谓“低级醇”是指c1-c4的醇,例如甲醇、乙醇、正丙醇、异丙醇、正丁醇、叔丁醇。在进一步的实施方案中,所述步骤s6包括:在反应瓶中依次加入d5、乙醇、硼氢化钠,在-10至30℃,反应1-5小时;反应完毕,加酸淬灭,将反应液倒入水中,dcm萃取,合并有机相后用饱和食盐水洗涤,有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物,得到中间体d6。
[0071]
在一个具体的实施方案中,其中x2为氯(cl)的中间体d6’的制备过程可以如下所示:
[0072][0073]
本发明所提供的重要中间体d6可以用于制备例如具有如下结构式的其他中间体:
[0074][0075]
其中x(在两个的情况下,各自独立地)表示卤素例如氟、氯、溴、碘。
[0076]
中间体d6自身也可以直接用于制备brd4蛋白抑制剂,或者利用由该中间体d6获得的上述中间体来制备brd4蛋白抑制剂。采用这些中间体来制备brd4蛋白抑制剂的具体过程可参考pct专利申请wo2020156357a1,其全部内容通过引用并入本文。
[0077]
本发明提供的合成用于制备brd4蛋白抑制剂的中间体d6的方法通过使用3-卤代丙酸甲酯作为起始原料,使原料成本降低了七十多倍,并且通过起始原料的改变还避免了原路线出现的反应过程中剧烈放热的现象。本发明还进一步改进了合成路线,在低温下从化合物d1到d2合成小环,避免了原技术路线中温度瞬间上升(从110℃瞬间升至160℃)而存在的潜在危险,以及叠氮化合物长时间高温加热(在153℃加热8小时)会引起的叠氮爆炸风险。此外,在本发明的步骤s3中,通过筛选溶剂、筛选硼酸类型、筛选温度、筛选催化剂以及碱,探索到比较合适的条件,大大提高了收率。
[0078]
下面结合附图和实施例对本发明进行更为具体和详细的描述,实施例仅是本发明的优选实施方式,并不用于限制本发明。若无特殊说明,本发明的所有原料和试剂均为常规市场的原料、试剂。
[0079]
实施例
[0080]
实施例1:3-叠氮丙酸甲酯(产物d1)的合成(步骤s1)
[0081]
向反应瓶中依次加入丙酮(150ml)、水(50ml)、3-溴丙酸甲酯(20.01g,119.76mmol)、叠氮钠(8.00g,123.05mmol),升温至70℃,反应5小时。反应完毕,降温,将反应液倒入100ml冰水中,dcm萃取3次(100ml*3),合并有机层,有机相用无水硫酸钠干燥,反应液减压浓缩,得10.20g产物d1,收率65.9%:
[0082][0083]
由图1的氢谱可以看出步骤s1所得产物为产物d1。
[0084]
实施例2:3-(5-碘-4-甲基-1h-1,2,3-三唑-1-基)丙酸甲酯(产物d2)的合成(步骤s2)
[0085]
向反应瓶中加入d1(10.20g,78.95mmol)、四氢呋喃(thf)(200ml)、1-(三甲基硅基)丙炔(11.41g,101.83mmol)、碘化亚铜(cui)(46.40g,243.63mmol)、n,n-二异丙基乙胺(dipea)(34.10g,263.85mmol),控温在0-10℃,同时滴加四丁基氟化铵(tbaf)(34.60g,109.64mmol)的thf溶液100ml以及n-溴代琥珀酰亚胺(nbs)(42.8g,240.47mmol)的四氢呋喃(thf)溶液300ml,滴加完毕,撤去冰浴,室温搅拌过夜。反应结束,抽滤,滤液减压浓缩,柱层析分离残余物,得6.90g产物d2,收率29.6%:
[0086][0087]
esi-ms理论计算值[m+1]
+
=295.98;实验测得:295.80,实际值与理论值相符。
[0088]
实施例3:5-氯-2-(1-(3-甲氧基-3-氧代丙基)-4-甲基-1h-1,2,3-三唑-5-基)苯甲酸甲酯(产物d3’)的合成(步骤s3)
[0089]
向反应瓶中依次加入乙二醇二甲醚(50ml)、d2(5.00g,16.90mmol)、d2-1’(8.00g,43.10mmol)、碳酸钾(5.00g,36.10mmol)、二(三苯基膦)二氯化钯(1.50mg,2.10mmol),升温至120℃,反应18小时。反应完毕,过滤,反应液加入100ml水,乙酸乙酯(ea)萃取3次(100ml*3),合并有机相后用饱和食盐水洗涤,有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物,得5.05g产物d3’,收率88.4%:
[0090][0091]
esi-ms理论计算值[m+1]
+
=338.08,实验测得:337.80,与理论值相符。
[0092]
实施例4:9-氯-1-甲基-7-氧代-6,7-二氢-5h-苯并[c][1,2,3]三唑[1,5-a]氮杂-6-羧酸甲酯(产物d4’)的合成(步骤s4)
[0093]
向反应瓶中加入d3’(1.40g,4.14mmol)、四氢呋喃(thf)(10ml)、降温至-10℃,分批加入叔丁醇钾(t-buok)(0.93g,8.28mmol),反应4个小时。反应结束,用醋酸中和,反应液加入水50ml,ea(3*50ml)萃取3次,合并有机相后用饱和食盐水洗涤,有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物,得1.02g产物d4’,收率82.8%:
[0094][0095]
esi-ms理论计算值[m+1]
+
=306.06;实验测得:305.80,实际值与理论值相符。
[0096]
实施例5:9-氯-1-甲基-5h-苯并[c][1,2,3]三唑并[1,5-a]氮杂-7(6h)-酮(产物d5’)的合成(步骤s5)
[0097]
向反应瓶中依次加入d4’(1.02g,2.64mmol)、二甲基亚砜(dmso)(10ml)、氯化钠(0.31g,5.28mmol)、水(0.10g,5.55mmol),升温至145℃,反应2小时。反应完毕,降温,将反应液倒入100ml水中,ea萃取3次(100ml*3),合并有机相后用饱和食盐水洗涤,再将有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物,得0.50g产物d5’,收率76.4%:
[0098][0099]
esi-ms理论计算值[m+1]
+
=248.05;实验测得:247.80,实际值与理论值相符。
[0100]
实施例6:9-氯-1-甲基-6,7-二氢-5h-苯并[c][1,2,3]三唑并[1,5-a]氮杂-7-醇(中间体d6’)的合成(步骤s6)
[0101]
向反应瓶中依次加入产物d5’(0.41g,1.65mmol)、乙醇(5ml)、硼氢化钠(93.2mg,
2.48mmol),0-10℃,反应2小时。反应完毕,加1m盐酸3ml淬灭,将反应液倒入50ml水中,dcm萃取3次(50ml*3),合并有机相后用饱和食盐水洗涤,有机相无水硫酸钠干燥,抽滤,滤液减压浓缩,柱层析分离残余物,得0.40g中间体d6’,收率97.1%:
[0102][0103]
esi-ms理论计算值[m+1]
+
=250.07;实验测得:249.90,实际值与理论值相符。
[0104]
以上仅为本发明的较佳实施方案而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1