一种检测NPM1突变分型的方法及其引物和探针与流程
一种检测npm1突变分型的方法及其引物和探针
技术领域
1.本发明涉及基因突变检测技术领域,具体涉及一种检测npm1突变分型的方法及其引物和探针。
背景技术:
2.npm1是一种编码具有伴侣和穿梭功能的多功能核仁蛋白的基因,30%的成人急性髓系白血病(aml)患者携带npm1突变,表现出独特的分子和临床病理特征。npm1基因外显子12的突变是正常核型aml患者中最特异和最常见的遗传病变。npm1突变导致其蛋白c端改变,这是其细胞质异常的原因。经修订的2017年世界卫生组织(who)子分类中,npm1突变型aml被视为aml的一个独特亚型。
3.迄今为止,已鉴定出约40个杂合npm1突变。成人病例中,75%以上的病例是由于tctg重复而导致a突变,另有15-20%的病例是由于catg或cctg四核苷酸插入而导致b或d突变。大量证据表明,人类白血病微小残留病(mrd)与临床结局显著相关,因此mrd监测对临床决策至关重要。mrd正确评估在npm1突变aml的复发风险方面也起着重要作用。
4.目前,检测npm1突变的主要检测方法包括一代测序法、定量pcr、变性高效液相色谱法(dhplc)和基因表达谱等。一代测序是核酸检测的金标准,但检测过程时间长,检测灵敏度低,检测下限仅为20%,且不能定量;变性高效液相色谱法(dhplc)和基因表达谱由于操作繁琐和技术问题,还没有在临床应用中推广。荧光定量pcr由于其敏感性高,检测周期短及成本低等优点,在临床上得到广泛的应用。但是目前的pcr检测方法在检测npm1 a、b、d突变分型时,针对各种分型分别设计引物和探针,容易产生操作误差和增加交叉差污染的几率。。
技术实现要素:
5.针对上述现有技术,本发明的目的是提供一种检测npm1突变分型的方法及其引物和探针。本发明通过利用npm1突变的rna序列特征,开发了高灵敏度、特异、可靠的rna实时定量pcr检测方法,能够监测npm1的a型、b型和d型三种常见突变。
6.为实现上述目的,本发明采用如下技术方案:
7.本发明的第一方面,提供一种检测npm1突变分型的引物-探针组合,所述引物-探针组合包括:
8.共用上游引物,其序列为tgtgaagaattgcttccgg(seq id no.1);
9.a型下游引物,其序列为ttctcctccactgcca(seq id no.2);
10.b型下游引物,其序列为gacttcctccactgcc(seq id no.3);
11.d型下游引物,其序列为ttcctccactgccag(seq id no.4);
12.共用探针,其序列为5
’‑
fam-tgaccaagaggctattca-mgb-3’(seq id no.5)。
13.本发明的第二方面,提供引物-探针组合在制备检测npm1突变分型的试剂和/或试剂盒中的用途。
14.本发明的第三方面,提供一种检测npm1突变分型的试剂盒,所述试剂盒中含有上述引物-探针组合。
15.优选的,所述试剂盒中还包括:rt mix、hiscript ii enzyme mix、oligo(dt)、aceq u+probe master mix、rox参比染料和ddh2o。
16.优选的,所述rt mix为5~15μl;所述hiscript ii enzyme mix为1~3μl;所述oligo(dt)为0.5~1.5μl;所述aceq u+probe master mix为5~15μl;所述rox参比染料为0.4μl;所述rnase-free ddh2o为2~4μl。
17.优选的,所述试剂盒中还包括:a型、b型和d型突变质粒参考品。
18.优选的,a型下游引物、b型下游引物或d型下游引物分别和共用上游引物、共用探针预先包被于一个pcr反应管内。
19.本发明的第四方面,提供试剂盒的使用方法,包括以下步骤:
20.采用试剂盒构建pcr扩增体系,以待测样本的rna为模板,利用突变质粒参考品定量出待测样本的突变拷贝数,确定npm1突变分型。
21.优选的,所述逆转录体系包括:
22.rt mix 10μl、hiscript ii enzyme mix 2μl、oligo(dt)1μl;
23.所述突变型扩增体系包括:
24.aceq u+probe master mix 10μl、rox 0.4μl、上游引物0.6μl、a3下游共用引物0.6μl、共用探针0.4μl。
25.优选的,所述逆转录的条件为:25℃5min;50℃15min;85℃2min;
26.所述pcr扩增的条件为:95℃5min;95℃15s,62℃1min,40个循环。
27.本发明的有益效果:
28.(1)本发明的试剂盒进一步提高了npm1突变检测敏感性,缩短了检测时长,最低检测限可达到100copies/μl。
29.(2)本发明的试剂盒可以对npm1突变进行定量检测,线性范围宽。特别是在拷贝数为100copies/μl,仍具有很好的线性范围。
30.(3)本发明的检测过程为闭管操作,可以避免污染;同时,已经利用临床阴阳性样本验证,特异性好,灵敏度高,稳定性强,仪器设备也无特殊要求,适合临床广泛开展。
31.(4)本发明实现了在检测npm1突变的rna序列特征中共用上游引物及共用探针检测a、b、d三种npm1突变分型,并可以保障目标序列的扩增完整性,有效识别突变序列,同时可以减少工作量,降低操作误差和交叉差污染的几率。
附图说明
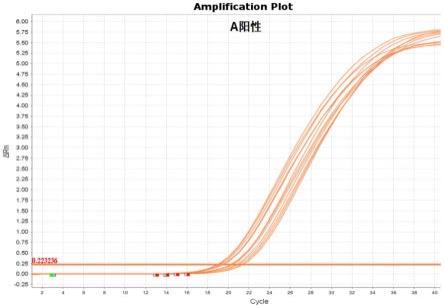
32.图1:a型阳性样本扩增曲线;
33.图2:b型和d型阳性样本扩增曲线;
34.图3:阴性样本扩增曲线;
35.图4:a型突变参考品扩增曲线和线性;
36.图5:b型突变参考品扩增曲线和线性;
37.图6:d型突变参考品扩增曲线和线性;
38.图7:重复不精密度—a型检测孔扩增曲线;
39.图8:重复不精密度—b型检测孔扩增曲线;
40.图9:重复不精密度—d型检测孔扩增曲线;
41.图10:a型线性曲线检测;
42.图11:b型线性曲线检测;
43.图12:d型线性曲线检测;
44.图13:a型下游引物-1在阴性样本中的扩增曲线。
具体实施方式
45.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
46.本发明利用npm1突变的rna序列特征,开发了高灵敏度、特异、可靠的定量pcr检测方法。
47.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
48.本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
49.实施例1:引物探针设计与确定
50.1.引物探针设计
51.本发明通过设计检测npm1突变的特异性引物和taqman荧光探针,采用实时荧光pcr法,对人外周血dna中npm1突变进行定量检测,并计算突变型的拷贝数。本发明首先对a型、b型和d型设计各自的特异性下游引物,然后设计共用上游引物和共用探针。因此本发明设计了检测npm1突变的引物和探针,包括:共用上游引物、a型下游引物、b型下游引物、d型下游引物和共用探针。具体序列见表1:
52.表1:引物、探针序列
[0053][0054]
使用4套引物、探针进行试剂配制,分别为引物探针组合a型(共用上游引物、a型下游共用引物、共用探针)、b型(共用上游引物、b型下游共用引物、共用探针)、d型(共用上游
引物、d型下游共用引物、共用探针,用于检测三种突变型。
[0055]
2.引物探针确定
[0056]
选择阴性样本(10例)、a型阳性样本(12例)、b型阳性样本(1例)和d型阳性样本(1例)进行实验,阳性样本有典型突变扩增曲线图1-图2,而阴性样本无扩增曲线图3。
[0057]
(1)检测样本:
[0058]
选择经过二代测序测定的阴性样本(10例)、a型阳性患者样本(12例)、b型阳性患者样本(1例)和d型阳性患者样本(1例)进行实时荧光定量pcr检测。
[0059]
(2)样本rna的提取:
[0060]
用全血核酸提取试剂盒(美基)进行提取人rna,通过分光光度计检测核酸浓度和纯度(od
260
/od
280
比值介于1.9-2.0之间),后将实验用rna模板稀释至140ng/μl。具体如下:
[0061]
1)在15ml离心管中,加入1ml抗凝血剂。
[0062]
2)加入5ml 1x rbc lysis buffer,颠倒混匀5-10次。冰上放置10~15分钟,其间颠倒混匀两次。在放置过程中,血液会从雾状变成透亮的溶液。透亮的溶液就表明了红细胞已裂解。处理病人的血液时,有可能需要延长至20分钟。
[0063]
3)4℃,500x g离心10分钟,小心倒弃上清液。
[0064]
4)加入3ml 1x rbc lysis buffer,短暂涡旋重悬细胞。
[0065]
5)4℃,500x g离心10分钟。
[0066]
6)小心吸弃上清液和超量的白细胞,余~20μl残液,涡旋打散淋巴细胞。加入450μl消化液rtl,用移液枪反复吸打数次。消化液比较粘稠时,可用1ml注射器吸打3-5次打断基因组,降低粘度,或将无法打散的白细胞团吸弃。
[0067]
7)在1.5ml离心管中,先加入450μl结合液mcb和30μl磁珠液mrp。
[0068]
8)转移第6步准备的消化液或上清液(450μl)至含磁珠的离心管中,颠倒混匀15-30次,室温静置10分钟,其间颠倒混匀数次。转移至磁力架上吸附2分钟,吸弃溶液。
[0069]
9)加入600μl洗涤液mw1,涡旋10秒。转移至磁力架上吸附1分钟。吸弃溶液。
[0070]
10)短暂离心,转移至磁力架上,吸尽残液。空气干燥5分钟。
[0071]
11)加入300μl dnase mixture(280μl dnase buffer+10μl dnase i+10μl proteinase k,可预混)至样品中,轻轻振荡重悬磁珠。室温振荡10~15分钟消化dna。
[0072]
12)加入450μl结合液mcb至样品中,涡旋混匀10秒。室温静置5分钟,其间颠倒混匀数次。转移至磁力架上吸附1分钟,吸弃溶液。
[0073]
13)加入600μl洗涤液mw1,涡旋10秒。转移至磁力架上吸附1分钟,吸弃溶液。重复洗涤一次。
[0074]
14)短暂离心,吸尽残液。室温干燥10~15分钟
[0075]
15)加入60μl rnase free water至样品中,涡旋打散磁珠。室温静置3分钟。
[0076]
16)转移至磁力架上吸附2分钟,把rna转移至新的离心管中。
[0077]
17)使用nanodrop仪器测得rna浓度和od
260
/od
280
比值,并将模板rna稀释为浓度为140ng/μl。
[0078]
(3)逆转录合成cdna:
[0079]
本发明采用abi veritipro pcr仪,逆转录体系使用南京诺唯赞生物技术有限公司的q211
ꢀꢀ
ii 1st strand cdna synthesis kit。具体配制方法和pcr扩增如表
1-表2所示。
[0080]
表1:试剂体系配制
[0081][0082]
表2:逆转录程序
[0083][0084]
(4)pcr扩增:
[0085]
本发明采用abi q5时荧光定量pcr系统,pcr扩增体系使用南京诺唯赞生物技术有限公司的q113 aceq u+probe master mix,适用于高灵敏的探针法qpcr反应,并引入了dutp/ung酶防污染体系,消除了扩增产物对qpcr反应的影响。
[0086]
阴性样本分为a、b和d三管进行扩增,阳性样本扩增对应的分型,具体配制方法和pcr扩增如表3-表4所示。检测使用fam通道。
[0087]
表3:试剂体系配制
[0088][0089]
表4:pcr扩增程序
[0090][0091]
(4)结果判读:
[0092]
1)确定基线和阈值:
[0093]
选择荧光曲线波动较小、较稳定的那段作为基线,可自行酌情调整。阈值应设在扩增曲线的拐点并覆盖未扩增曲线的最高点且阴性对照未检出为原则。
[0094]
2)结果阴阳性判定
[0095]
如图1-图3所示fam通道下,所有突变参考品最低浓度的fam信号c
t
值≤33,阴性质控样本其突变型检测孔无扩增。在满足上述条件下,若样本突变型检测孔fam信号≤38,则判断为阳性;若fam信号>38,或显示“undet”,则判断为阴性。
[0096]
3)定量和计算:
[0097]
使用突变质粒参考品定出样本的突变拷贝数。
[0098]
实施例2:突变质粒参考品和野生质粒参考品的构建
[0099]
根据实施例1中所设计的上、下游引物,选取基因外显子所在位置构建突变质粒参考品。a型、b型和d型突变质粒参考品中由插入突变所在位点部分片段加上载体组成。
[0100]
将突变质粒参考品分别稀释为1
×
106copies/μl、1
×
105copies/μl、1
×
104copies/μl、1
×
103copies/μl,并用引物探针组合对稀释好的参考品进行扩增,验证其线性,由实验结果可知,突变质粒参考品的r2均为1.000,满足线性要求(r2≥0.980)。结果见表5,扩增曲线和线性见图4-图6。
[0101]
表5:参考品线性
[0102][0103]
实施例3:方法学验证
[0104]
1.正确度验证:
[0105]
选择经过二代测序证实的阴性样本(10例)、a型阳性样本(12例)、b型阳性样本(1例)和d型阳性样本(1例)进行检测,结果如表8所示,与二代测序结果一致。
[0106]
表6:正确度比对
[0107]
[0108]
[0109][0110]
2.精密度验证:
[0111]
(1)重复性不精密度:选取npm1突变阳性样品与阴性样本按一定比例混合,a型和b型得到突变拷贝数分别为1
×
105copies/μl和1
×
103copies/μl的样本各一份,d型得到突变拷贝数分别为4
×
104copies/μl和1
×
103copies/μl的样本各一份,重复测定20次。结果如下表7-表9,以及图7-图9所示。
[0112]
表7:重复性不精密度—a型
[0113]
测试号拷贝数拷贝数log值测试号拷贝数拷贝数log值l-112653.10h-11126985.05l-212343.09h-2875764.94l-311463.06h-31110865.05l-413663.14h-41066545.03l-513163.12h-5975384.99l-610753.03h-61059765.03l-713113.12h-71043995.02l-813403.13h-81089645.04l-910083.00h-91085535.04l-1011873.07h-101117435.05l-1111713.07h-11972234.99l-1212893.11h-12988575.00l-1311533.06h-131041555.02l-1413883.14h-141066845.03l-1510113.00h-151017425.01l-1611763.07h-16956324.98l-179592.98h-17992625.00l-1811143.05h-18984674.99l-1911233.05h-191066215.03l-2011413.06h-20993455.00 平均值3.07 平均值5.01 sd0.05 sd0.03 cv1.49 cv0.55
[0114]
表8:重复性不精密度—b型
[0115][0116][0117]
表9:重复性不精密度—d型
[0118]
测试号拷贝数拷贝数log值测试号拷贝数拷贝数log值l-111353.05h-1406254.61l-29092.96h-2418044.62l-311463.06h-3425064.63l-417123.23h-4366434.56l-521403.33h-5415264.62l-614793.17h-6419284.62l-713913.14h-7377324.58l-810093.00h-8400144.60l-920703.32h-9412804.62l-107582.88h-10381724.58l-1115523.19h-11414154.62l-1213653.14h-12427874.63l-137482.87h-13387444.59l-1413303.12h-14420024.62
l-1512383.09h-15381644.58l-169022.96h-16426934.63l-1722753.36h-17388934.59l-1819263.28h-18384284.58l-1914503.16h-19396424.60l-2011613.06h-20377804.58 平均值3.12 平均值4.60 sd0.14 sd0.02 cv4.57 cv0.46
[0119]
由表7~9和图7~9可以看出,本发明中样本突变拷贝数的变异系数(cv,%)分别为a型的1.49%和0.55%、b型的0.99%和0.43%、d型的4.57%和0.46%,满足重复性不精密度要求(cv≤5%)。说明本发明检测三种突变的方法重复性好,检测方法可靠。
[0120]
(2)中间不精密度:选取npm1突变阳性样品与阴性样本按一定比例混合,a型和b型得到突变拷贝数分别为1
×
105copies/μl和1
×
103copies/μl的样本各一份,d型得到突变拷贝数分别为4
×
104copies/μl和1
×
103copies/μl的样本各一份。每天检测一次,每个浓度重复5个测试,连续检测4天。结果如下表10-表12所示。
[0121]
表10:中间不精密度—a型
[0122]
[0123]
表11:中间不精密度—b型
[0124][0125][0126]
表12:中间不精密度—d型
[0127][0128][0129]
由表10~12可以看出,在连续4天的测试中,样本突变拷贝数的cv值<5%,满足中间不精密度要求(cv≤5%)。说明本发明的检测方法重复性好、非常可靠。
[0130]
3.线性:
[0131]
(1)样本线性:选取npm1突变阳性样品与阴性样本按一定比例混合,得到一系列突变拷贝数不同的样本5个,以每个样本检测得到的拷贝数对数值的均值与靶值做相关性分析,要求r2≥0.980。如表13和图10-图12所示。
[0132]
表13:样本线性
[0133][0134]
由表13可以看出,本发明检测方法的r2≥0.980,线性满足要求。
[0135]
4.最低检出限:
[0136]
通过选取npm1突变阳性样品与阴性样本按一定比例混合的阳性样本,使样本中突变拷贝数终浓度为100copies/μl。结果如表14所示。
[0137]
表14:最低检测限—100copies/μl
[0138]
[0139][0140]
由表14可以看出,本发明的检测方法样本重复测定20次均能稳定检出,本发明方法的检测下限可定为100copies/μl。说明本发明的检测方法灵敏度高。
[0141]
5.检测范围
[0142]
将通过罕见型突变质粒与bcr-abl阴性样本按一定比例混合,配制为1
×
106copies/μl、1
×
105copies/μl、1
×
104copies/μl、1
×
103copies/μl和1
×
102copies/μl的样本进行检测。检测结果见表15所示。
[0143]
表15:检测范围
[0144][0145]
由表15可以看出,本发明的检测方法对于所有突变率均可稳定检出,且拷贝数对数值均符合要求,本发明最低突变率检测限为100copies/μl。
[0146]
对比例
[0147]
实验过程中,a型下游引物-1,其序列为tcctccactgccagac(seq id no.6)在检测阴性样本中,出现少量扩增,结果如图13所示,说明a型下游引物-1的特异性差,本发明设计的a型下游引物特异性好,提高了检测的准确度和灵敏度。
[0148]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1