一种来源于日本沼虾外骨骼的C型凝集素及其编码基因和应用
一种来源于日本沼虾外骨骼的c型凝集素及其编码基因和应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种来源于日本沼虾外骨骼的c型凝集素及其编码基因和应用。
背景技术:
2.甲壳动物身体表面坚硬的外骨骼由表皮及内面的上皮细胞层构成。表皮的主要化学组分为几丁质、蛋白质及碳酸钙,其中,绝大多数蛋白质是结构表皮蛋白(cuticularproteins,cps),cps能与几丁质结合形成表皮中的有机支架。近年来发现,表皮中还存在着具有免疫功能的蛋白质,如抗菌肽及前酚氧化酶原等,这使得外骨骼不仅仅是一道物理屏障,可能还具有一定的抗菌活性,然而表皮中是否还存在其他免疫分子及其相关功能尚未见报道。
3.先天性免疫系统是甲壳动物主要的防御系统,其启动的关键步骤是对病原微生物的识别。c-型凝集素是模式识别受体(patternrecognition receptors,prrs)的成员之一,是一类重要的免疫因子。甲壳动物中c-型凝集素发挥着多种免疫功能。作为prrs家族成员之一,c-型凝集素专一地识别与结合pamps。此外,c-型凝集素还具有促进微生物的凝集、促进血细胞对细菌的吞噬作用和包封、抗病毒、抗菌和调理的作用。
4.但是,迄今为止有关于在甲壳动物外骨骼中发现c-型凝集素的报道很少。
技术实现要素:
5.本发明的目的在于提供一种来源于日本沼虾外骨骼的c型凝集素及其编码基因和应用,本发明在甲壳动物外骨骼中发现了新的c-型凝集素。
6.本发明提供了一种来源于日本沼虾外骨骼的c型凝集素,氨基酸序列如seq id no.1所示。
7.本发明还提供了上述方案所述c型凝集素的编码基因,核苷酸序列如seq id no.2所示。
8.本发明还提供了一种重组载体,插入有上述方案所述的编码基因。
9.优选的,所述重组载体的原始质粒包括pet-30a;所述编码基因插入在pet-30a上的nde i和xho i酶切位点之间
10.本发明还提供了一种重组菌,包含上述方案所述的重组载体。
11.本发明还提供了上述方案所述的c型凝集素或者所述的编码基因或者所述的重组载体或者所述的重组菌在制备提高日本沼虾存活率的产品中的应用。
12.优选的,所述提高日本沼虾存活率通过提高日本沼虾免疫力实现。
13.优选的,所述提高日本沼虾免疫力包括提高日本沼虾抗细菌感染的能力。
14.优选的,所述细菌包括嗜水气单胞菌。
15.本发明还提供了降低上述方案所述编码基因表达量的试剂在构建免疫力降低的
日本沼虾动物模型中的应用;所述降低上述方案所述编码基因表达量的试剂包括干扰引物;所述干扰引物的上游引物的核苷酸序列如seq id no.5所示;所述干扰引物的下游引物的核苷酸序列如seq id no.6所示。
16.本发明提供了一种来源于日本沼虾外骨骼的c型凝集素,氨基酸序列如seq id no.1所示。本发明在日本沼虾外骨骼中发现了新的c型凝集素,并证明其在提高日本沼虾免疫力和存活率中的作用。本发明对日本沼虾腹部注射c型凝集素后,嗜水气单胞菌侵染后的存活率显著增加,攻毒后96h,存活率为60%。
附图说明
17.图1为mnlec3全长编码区基因扩增产物凝胶电泳结果;
18.图2为rmnlec3的表达分析及纯化结果(考马斯亮蓝染色),其中,m为蛋白质分子标记,1为上清(未诱导),2为沉淀(未诱导),3为上清(iptg诱导),4为沉淀(iptg诱导),5为由包涵体中纯化的rmnlec3;
19.图3为注射rmnlec3后嗜水气单胞菌侵染日本沼虾成活率;
20.图4为双链rna凝胶电泳图,其中,a:dsmnlec3凝胶电泳图;b:dsgfp凝胶电泳图;m:dna分子量标记;
21.图5为干扰后mnlec3的表达;
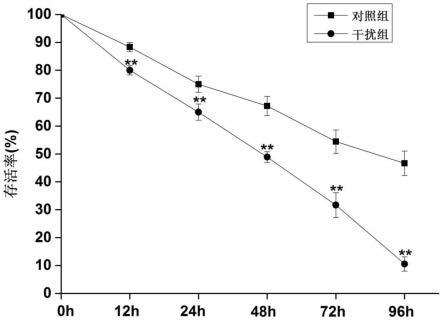
22.图6为mnlec3干扰后嗜水气单胞菌侵染日本沼虾成活率。
具体实施方式
23.本发明提供了一种来源于日本沼虾外骨骼的c型凝集素mnlec3,氨基酸序列如seq id no.1所示,具体为:
24.etdvantiglgigdisatlsdhedrcsythvegkleeqlehnerflgfqessvvamknntevlrnkteealeryyktadkevpdvcgepfqrsagscfwahkgpalswgdarefclqeggdlatpedilrvveflneelgsgwwyvwlggkqdasgdwkwlesdktmdagdsfwedeevteadpermrcaafrsesgykiakqdcgntnwflcekki。
25.本发明对所述c型凝集素mnlec3的来源和制备方法没有特殊限制。在本发明具体实施过程中,所述c型凝集素mnlec3采用基因工程的手段制备并纯化得到。
26.本发明还提供了上述方案所述c型凝集素的编码基因mnlec3,核苷酸序列如seq id no.2所示,具体为:
27.gagaccgacgttgcaaatacgatcggcctaggaatcggcgatatatccgccactctgagtgaccatgaggaccgctgctcttacacccatgtcgaaggaaagctggaagagcagttagagcataacgagagattcttgggattccaagagtcatcagtcgttgcaatgaagaataacactgaggtactgcggaacaagacagaggaggctttggaacgctactataagactgccgataaagaagttcccgacgtctgtggagagccgttccagaggtctgcagggagctgcttctgggctcacaagggccctgccctctcgtggggcgacgcccgtgagttctgcctacaagaaggaggagatctggcgactccagaggatatccttcgggtggttgagttccttaacgaggaactcggctcaggatggtggtacgtgtggcttggaggaaagcaggacgctagcggagactggaaatggctggaatctgataaaactatggacgctggtgattccttctgggaagatgaggaagtgacagaggccgatccagaacgcatgcgctgtgctgcctttagaagcgagtctggatacaagatcgccaagcaggactgcggaaataccaactggttcttatgcgaaaagaagatc。
28.本发明还提供了一种重组载体,插入有上述方案所述的编码基因。
29.在本发明中,所述重组载体的原始质粒优选的包括pet-30a;所述编码基因优选的插入在pet-30a上的nde i和xho i酶切位点之间。
30.本发明对所述重组载体的构建方法没有特殊限制,采用本领域的常规构建方法即可。
31.本发明还提供了一种重组菌,包含上述方案所述的重组载体。
32.在本发明中,所述重组菌的原始菌优选的包括大肠杆菌,更优选为大肠杆菌感受态细胞bl21(de3)。
33.本发明对所述重组菌的构建方法没有特殊限制,采用本领域的常规构建方法即可。
34.本发明还提供了上述方案所述的c型凝集素或者所述的编码基因或者所述的重组载体或者所述的重组菌在制备提高日本沼虾存活率的产品中的应用。
35.在本发明中,所述产品优选的包括药品;所述药品的剂型优选为注射剂。以c型凝集素计,所述药品的单次注射剂量优选为1~3μg/只日本沼虾,更优选为2μg/只日本沼虾。
36.在本发明中,所述提高日本沼虾存活率优选的通过提高日本沼虾免疫力实现。
37.在本发明中,所述提高日本沼虾免疫力优选的包括提高日本沼虾抗细菌感染的能力。在本发明中,所述细菌优选的包括嗜水气单胞菌。
38.本发明还提供了降低上述方案所述编码基因表达量的试剂在构建免疫力降低的日本沼虾动物模型中的应用;所述降低上述方案所述编码基因表达量的试剂包括干扰引物;所述干扰引物的上游引物的核苷酸序列如seq id no.5所示,具体为:5
‘
(tgaggaccgctgctcttac)3’;所述干扰引物的下游引物的核苷酸序列如seq id no.6所示,具体为:5
‘
(cagattccagccatttccag)3’。
39.为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种来源于日本沼虾外骨骼的c型凝集素及其编码基因和应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
40.实施例1
41.1.rna提取及反转录:
42.选取五只日本沼虾,用镊子小心取下头胸甲,因取材时头胸甲内面不易与其他组织如结缔组织等脱离,体式显微镜下用无rna酶的解剖刀迅速剥离头胸甲内面游离组织后转移至液氮预冷的离心管中,-80℃保存。为检测取材的准确性,随机选取一块头胸甲组织,剪成6~8mm的小块,davidson’s fixative(df)固定液固定24h,自来水下冲洗,1h,不同浓度酒精脱水,然后置于正丁醇内过夜透明,石蜡包埋,行横切,切片厚6μm,h.e.染色后显微镜下观察外骨骼的组织结构,并拍照记录。根据柱式法total rna小量提取试剂盒说明书进行总rna的提取,检测质量后,根据反转录说明书操作步骤反转录合成cdna。
43.2.mnlec3全长编码区基因扩增:
44.设计用于序列扩增的专一性引物:
45.上游引物mnlec3-nde i(seq id no.3):
[0046]5‘
(ggaattccatatggagaccgacgttgcaaatacg)3’,
[0047]
下游引物mnlec3-xho i(seq id no.4):
[0048]5‘
(ccgctcgaggatcttcttttcgcataagaaccag)3’;
[0049]
扩增片段长度为651bp;以反转录得到的cdna为模板作pcr扩增;建立50μl pcr反应体系,反应条件为:94℃预变性5min,94℃变性30s,56℃退火30s,72℃延伸35s,35次循环后72℃延伸10min;扩增产物用1.0%琼脂糖凝胶电泳检测,结果参见图1,电泳检测后胶回收试剂盒回收651bp的pcr产物;pcr扩增产物经胶回收纯化得到目的片段。
[0050]
3.pet-30a-mnlec3表达载体的构建:
[0051]
mnlec3 pcr产物/pet-30a空载体用nde i和xho i进行双酶切,胶回收酶切片段和质粒并进行连接,取10μl连接产物并加入10μl工程菌(dh5α,bl21)冰孵30min,放入42℃水浴锅中热激90s随后立即放入冰上二次冰孵3min,将混合物加入500μl液体lb培养液(无抗生素)中37℃培养1h,常温3500r,5min弃上清,保留沉淀涂布在含kana的lb固体培养基,放入37℃培养箱中培养过夜,挑取单菌落以primer-mnlec3引物进行菌液pcr,阳性克隆送测序。
[0052]
4.pet-30a-mnlec3融合蛋白的诱导表达:
[0053]
测序正确的阳性克隆扩大培养,抽提重组质粒,同样方法将重组质粒转化至大肠杆菌感受态细胞bl21(de3),菌液pcr鉴定阳性克隆。鉴定正确的阳性克隆于含kana的lb液体培养基中,37℃培养至od600为0.6时,加入终浓度为0.5mmol/l的iptg,37℃诱导表达6h,收集菌体;用pbs重悬菌体,4℃,超声波破碎30min,超声破碎后菌液4℃,12000r/min离心10min,分离上清和沉淀;取超声波处理后的上清和沉淀样品各10μl,进行sds-page电泳分析。
[0054]
5.重组蛋白(rmnlec3)的纯化:
[0055]
在最佳诱导条件下诱导rmnlec3的表达,收集诱导后菌体超声破碎的上清液,按照ni-ida琼脂糖说明书进行层析,进行12%sds-page电泳。结果参见图2。
[0056]
层析的步骤为:
[0057]
①
取保存于20%酒精中的ni-ida琼脂糖2ml,将其加入空的亲和层析柱,室温下酒精缓慢流出,待ni-ida琼脂糖逐渐沉降后,依次加入5ml去离子水和10ml结合缓冲液。
[0058]
②
将菌体超声破碎的上清液逐滴加入柱中,每次1ml。待上清液全部通过后,5ml结合缓冲液冲洗。
[0059]
③
按照咪唑浓度从低至高,依次加入5ml(每次1ml)不同咪唑浓度的洗脱缓冲液,分别收集流出的液体(洗脱液)。
[0060]
④
sds-page电泳,考马斯亮蓝染色,分析不同咪唑浓度洗脱液中的蛋白条带。
[0061]
⑤
将大小准确且无杂带的洗脱液加入透析袋,1l透析液中,4℃透析8~10h,此步骤重复一次。透析结束后,收集透析袋内液体,12,000rpm,4℃离心10min,超滤管浓缩重组蛋白,测定浓度,-80℃保存。
[0062]
6.rmnlec3对日本沼虾存活率的影响
[0063]
健康日本沼虾(体长1.0~1.5cm)随机分为两组,每组60只。
[0064]
对照组:每只虾用微量注射器于腹部注射2μg牛血清白蛋白;
[0065]
实验组:每只虾腹部注射2μg rmnlec3;
[0066]
注射后20min,对照组和实验组每只虾注射2μl嗜水气单胞菌悬液(7.5
×
105cfu/ml),记录每组虾在注射菌后0、12、24、48、72、96h的死亡率。结果参见表1和图3。
[0067]
表1 rmnlec3对日本沼虾存活率的影响
[0068][0069]
由表1和图3可以看出:与对照组相比,实验组嗜水气单胞菌侵染后日本沼虾的存活率显著增加,攻毒后96h,实验组的存活率为60%,而对照组的存活率只有42.22%。
[0070]
7.利用rna干扰(rnai)技术,根据mnlec3基因序列设计干扰引物:
[0071]
上游引物dsmnlec3(seq id no.5):5
‘
(tgaggaccgctgctcttac)3’,
[0072]
下游引物dsmnlec3(seq id no.6):5
‘
(cagattccagccatttccag)3’;
[0073]
扩增片段长度为425bp;以日本沼虾头胸甲外骨骼cdna为模板,扩增合成dsmnlec3的cdna模板,胶回收含有t7启动子的目的片段,与pmd19-t载体连接、转化到大肠杆菌dh5α,在含amp的lb固体培养基上生长(37℃过夜),挑取单菌落以primer-dsmnlec3引物进行菌液pcr,阳性克隆送测序。扩大培养测序正确的菌株,抽提质粒,测定质粒浓度,ecor i、hindⅲ双酶切提取的质粒,以质粒dna为模板按照invitro transcriptiont7 kit(for sirna synthesis)试剂盒说明体外合成双链rna(dsmnlec3)。mnlec3的双链rna序列的核苷酸序列如seq id no.7所示,具体为:
[0074]
tgaggaccgctgctcttacacccatgtcgaaggaaagctggaagagcagttagagcataacgagagattcttgggattccaagagtcatcagtcgttgcaatgaagaataacactgaggtactgcggaacaagacagaggaggctttggaacgctactataagactgccgataaagaagttcccgacgtctgtggagagccgttccagaggtctgcagggagctgcttctgggctcacaagggccctgccctctcgtggggcgacgcccgtgagttctgcctacaagaaggaggagatctggcgactccagaggatatccttcgggtggttgagttccttaacgaggaactcggctcaggatggtggtacgtgtggcttggaggaaagcaggacgctagcggagactggaaatggctggaatctg。
[0075]
以绿色荧光蛋白基因(gfp)的双链rna(dsgfp)为对照。
[0076]
双链rna凝胶电泳图参见图4,其中a:dsmnlec3凝胶电泳图;b:dsgfp凝胶电泳图。m:dna分子量标记。
[0077]
(1)健康本沼虾(体长1.0~1.5cm)随机分为两组,每组30只。
[0078]
对照组:每只虾用微量注射器于腹部注射dsgfp,注射量按虾的重量计算(5μg dsgfp/每克体重)。
[0079]
干扰组:每只虾腹部注射dsmnlec3,注射量为5μg dsmnlec3/每克体重。
[0080]
分别于注射后0、24、48、72、96h取样,每组每时间点随机选取3只日本沼虾,取其头胸甲抽提总rna,合成cdna第一链,qrt-pcr方法检测mnlec3基因的表达。结果参见图5,结果显示:注射后12h,干扰组mnlec3的表达比相应对照组降低了49.59%(p《0.01),至48h,mnlec3表达的降低幅度达到91.83%(p《0.01),至96h,mnlec3的表达仍比对照组低56.61%(p《0.01)。
[0081]
(2)健康本沼虾(体长1.0~1.5cm)随机分为两组,每组60只。
[0082]
对照组:每只虾用微量注射器于腹部注射dsgfp,注射量按虾的重量计算(5μg dsgfp/每克体重)。
[0083]
干扰组:每只虾腹部注射ds mnlec3,注射量为5μg dsmnlec3/每克体重。
[0084]
注射双链rna 48h时,每只虾注射2μl嗜水气单胞菌悬液(7.5
×
105cfu/ml),记录每组虾在注射菌后0、12、24、48、72、96h的死亡率。结果参见表2和图6。
[0085]
表2 mnlec3干扰后嗜水气单胞菌侵染日本沼虾存活率
[0086][0087]
由表2和图6可以看出:mnlec3基因的沉默导致嗜水气单胞菌侵染后日本沼虾的生存能力显著降低,攻毒后96h,dsmnlec3组的存活率降至10.56%,而dsgfp组的存活率为46.67%。
[0088]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1