一种pH触发电荷可逆荧光探针与其在细胞成像中的应用
一种ph触发电荷可逆荧光探针与其在细胞成像中的应用
技术领域
1.本发明属于前沿新材料及生物医药技术领域,涉及临床诊断材料,具体涉及一种ph触发电荷可逆荧光探针与其在细胞成像中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.据发明人研究了解,虽然目前已经对脂滴(lds)的各种动力学及其细胞质功能进行了深入的探索,但对lds在细胞核中的功能和变化仍不清楚。而唯一一项用荧光探针无损检测细胞核内lds变化的现有技术是采用bodipy 558(商用lds探针)和hoechst 33342(商用核探针)的免疫荧光显微镜。然而,核仁作为细胞核的重要组成部分,在探索lds在细胞核中的功能时并没有考虑到。此外,虽然可以通过共染实验来探索核lds的变化,但两种不同种类的探针摄取速率不同,可能会干扰同步成像。因此,开发双色多靶点荧光探针,如同时检测lds和核仁,可以为进一步探索核中lds的功能意义提供有效手段。遗憾的是,由于缺少特异的rna靶向基团,核仁探针的设计一直是一个挑战,同时标记核仁和lds也变得更有价值。
技术实现要素:
4.为了解决现有技术的不足,本发明的目的是提供一种ph触发电荷可逆荧光探针与其在细胞成像中的应用,本发明提供的荧光探针能够以两种不同的颜色同时对lds和核仁染色,首次可视化lds与核仁之间的物理接触。
5.为了实现上述目的,本发明的技术方案为:
6.一方面,一种ph触发电荷可逆荧光探针,其化学结构如下所示:
[0007][0008]
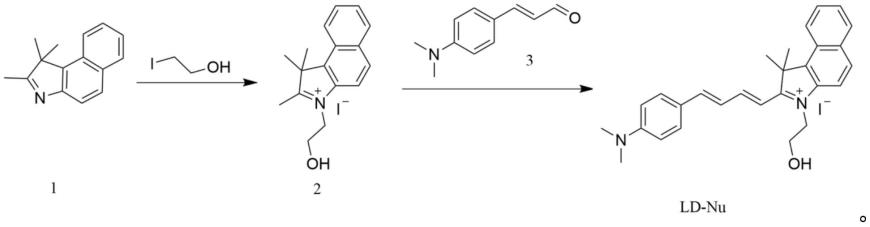
其化学名称为2-((1e,3e)-4-(4-(二甲基氨基)苯基)丁-1,3-二烯-1-基)-3-(2-羟基乙基)-1,1-二甲基-1h-苯并[e]吲哚-3-鎓碘化物,记为ld-nu。
[0009]
另一方面,一种ph触发电荷可逆荧光探针的制备方法,包括以化合物1按照如下反应路线获得荧光探针ld-nu的步骤;
[0010][0011]
第三方面,一种制剂组合物,包括活性成分和辅料,所述活性成分为上述ph触发电荷可逆荧光探针。
[0012]
第四方面,一种上述ph触发电荷可逆荧光探针在检测ph中的应用。研究表明,本发明提供ph触发电荷可逆荧光探针的荧光在酸性环境下相对于在碱性环境下会发生蓝移,从而实现对ph变化的灵敏检测。
[0013]
第五方面,一种上述ph触发电荷可逆荧光探针在细胞成像中的应用,所述细胞成像为采用ph触发电荷可逆荧光探针对细胞中的脂滴染色、核仁染色或脂滴与核仁同时染色。
[0014]
第六方面,一种细胞成像检测试剂盒,包括活性组分和缓冲液,所述活性组分为上述ph触发电荷可逆荧光探针或上述制剂组合物。
[0015]
本发明基于lds和核仁之间的ph值和电荷差异,基于环化开环机制构建了ph触发电荷可逆荧光探针(ld-nu)。试验结果证实,ld-nu探针以两种不同的颜色同时对lds和核仁染色,首次可视化lds与核仁之间的物理接触。探针ld-nu的荧光在酸性环境下相对于在碱性环境下会发生蓝移,从而实现对ph变化的灵敏检测。在rna和dna同时存在的情况下,ld-nu可以优先结合rna,这为探针在细胞核中特异性染色核仁提供了前提条件。同时,进一步研究了lds与核仁的关系,结果表明,两者的相互作用比核仁更容易受到lds异常的影响。此外,细胞成像结果显示,使用ld-nu探针可以观察到细胞质和细胞核中的lds,有趣的是,细胞质中的lds比细胞核中的lds更容易受到外界刺激的影响。
[0016]
综上,本发明提供的ph触发电荷可逆荧光探针能够实现在软酸性或弱碱性环境下特定对lds和核仁的染色并能够进一步探索lds和核仁之间相互作用关系。
附图说明
[0017]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0018]
图1探针ld-nu(10μm)的吸光度和荧光光谱随ph(a,b,c)的变化,e
x
(b)=380nm,e
x
(c)=603nm。(d)在i
727nm
/i
470nm
处的荧光比与ph的关系图。(e)ph与log[(i
max-i)/(i-i
min
)]的关系图。y截距为探针的pka值(6.24
±
0.79)。(f)ld-nu(10μm)探针在ph 4.0和9.0下的光稳定性。
[0019]
图2ld-nu的ph传感机理:(a)加入naoh前后探针ld-nu在dmso-d6中的1h nmr谱,(b)ld-nu在开环和环化形态下的最佳几何结构。
[0020]
图3带正电形式的ld-nu在单晶细胞中单分子构型。
[0021]
图4不同浓度的ld-nu培养24h后hepg2、hela、a549和raw264.7细胞存活率的mtt结果。
[0022]
图5ld-nu染色hepg2细胞的荧光成像(2μm,10min)。(a):绿色通道,(b):红色通道,(c):dic,(d):通道a和b的合并图像,(e)通道a和c的合并图像,(f):通道b和c的合并图像。(g-i):通道a、c和e分别用实线框标记的放大图像。(j-l):通道b、d、f的放大图像,用虚线框标记。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺(a-f)=20μm,标尺(g-l)=5μm。
[0023]
图6ld-nu染色hela细胞的荧光成像(2μm,10min)。(a):绿色通道,(b):红色通道,(c):dic,(d):通道a和b的合并图像,(e)通道a和c的合并图像,(f):通道b和c的合并图像。(g-i):通道a、c和e分别用实线框标记的放大图像。(j-l):通道b、d、f的放大图像,用虚线框标记。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺(a-f)=20μm,标尺(g-l)=5μm。
[0024]
图7ld-nu染色raw细胞的荧光成像(2μm,10min)。(a):绿色通道,(b):红色通道,(c):dic,(d):通道a和b的合并图像,(e)通道a和c的合并图像,(f):通道b和c的合并图像。(g-i):通道a、c和e分别用实线框标记的放大图像。(j-l):通道b、d、f的放大图像,用虚线框标记。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺(a-f)=20μm,标尺(g-l)=5μm。
[0025]
图8hepg2细胞在ld-nu(2μm,10min)作用下的荧光图像,荧光通道为绿色和红色。(a)二维荧光图像,(b)实线框标记面板(a)放大图像,(c)面板(b)三维图像,(d)面板(c)三维透视校正平面图像。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺(a)=40μm,标尺(b,c)=10μm,标尺(d)=5μm。
[0026]
图9ld-nu(10μm)对rna响应的荧光滴定光谱,e
x
=603nm。b)图按scatchard方程拟合曲线,rna结合常数为2.0*106m-1
,拟合常数r2=0.947。c)探针ld-nu与rna分子对接,d)二维相互作用图细节。
[0027]
图10a)ld-nu(10μm)对dna(0~3750μg/ml)的荧光滴定光谱,e
x
=603nm;b)根据scatchard方程拟合的图曲线,dna的结合常数为2.8*105m-1
,拟合常数r2=0.925;c)ld-nu(10μm)对rna和dna在相同浓度2500μg/ml下的荧光发射光谱。
[0028]
图11用dnase和rnase消化培养4h后,用ld-nu染色(2μm,10min)的hepg2细胞的荧光(绿色、红色通道)、dic及其合并图像。箭头表示核仁的变化。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺=20μm。
[0029]
图12用dnase和rnase消化培养4h后,用ld-nu染色(2μm,10min)的hepg2细胞的荧光(绿色、红色通道)、dic及其合并图像。箭头表示核仁的变化。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺=20μm。
[0030]
图13hepg2细胞经dnase消解培养4h后,不同时间dapi染色后的蓝色通道、dic及合并图像。蓝色通道:e
x
=405nm,em=420-550nm。标尺=20μm。
[0031]
图14ld-nu(2μm,10min)染色hepg2细胞在正常状态下和pfoa孵育不同时间后的荧光(绿色通道、红色通道)、dic及其合并图像和白色箭头的强度分布图。叠加图1:绿、红通道与dic合并图像;叠加图2:合并后的红绿通道图像;绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺=10μm。
[0032]
图15正常状态下和h2o2培养后的hepg2细胞的荧光(绿色通道、红色通道)、dic、合并图、放大图以及不同比例的ld-nu(2μm,10min)染色图。放大图像:合并图像中用实线框标
记的区域。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺=20μm,标尺(放大)=5μm。
[0033]
图16正常状态下和h2o2培养后的hela细胞的荧光(绿色通道、红色通道)、dic、合并图、放大图以及不同比例的ld-nu(2μm,10min)染色图。放大图像:合并图像中用实线框标记的区域。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺=20μm,标尺(放大)=5μm。
[0034]
图17荧光(绿色通道,红色通道),dic,合并后的放大图像,以及不同比例的ld-nu染色的raw细胞(2μm,10min),在正常状态下和ldl孵育12h后。放大图像:合并图像中用实线框标记的区域。绿色通道:e
x
=405nm,em=420-550nm,红色通道:e
x
=633nm,em=650-850nm。标尺=20μm,标尺(放大)=5μm。
[0035]
图18正常状态下和lps孵育后hepg2细胞的荧光(绿色通道、红色通道)、dic、合并图像、放大图像以及不同比例的ld-nu(2μm,10min)染色细胞。放大图像:合并图像中用实线框标记的区域。绿色通道:e
x
=405nm,em=420-550nm;红色通道:e
x
=633nm,em=650-850nm。标尺=20μm,标尺(放大)=5μm。
具体实施方式
[0036]
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0037]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0038]
鉴于现有同种荧光探针无法同时对脂滴和核仁进行染色,本发明提出了一种ph触发电荷可逆荧光探针与其在细胞成像中的应用。
[0039]
本发明的一种典型实施方式,提供了一种ph触发电荷可逆荧光探针,其化学结构如下所示:
[0040][0041]
其化学名称为2-((1e,3e)-4-(4-(二甲基氨基)苯基)丁-1,3-二烯-1-基)-3-(2-羟基乙基)-1,1-二甲基-1h-苯并[e]吲哚-3-鎓碘化物,记为ld-nu。
[0042]
本发明的另一种实施方式,提供了一种ph触发电荷可逆荧光探针的制备方法,包括以化合物1按照如下反应路线获得荧光探针ld-nu的步骤;
[0043][0044]
在一些实施例中,化合物1与碘乙醇进行季铵化反应获得化合物2,化合物2与化合物3进行缩合反应获得荧光探针ld-nu。
[0045]
在一些实施例中,化合物1与碘乙醇在三氯甲烷中加热回流获得化合物2。化合物1与碘乙醇的摩尔比为1:0.9~1.1。
[0046]
在一些实施例中,化合物2加入至乙醇中,加热溶解,然后加入化合物3,加热回流,反应至少48h,即得荧光探针ld-nu。
[0047]
本发明的第三种实施方式,提供了一种制剂组合物,包括活性成分和辅料,所述活性成分为上述ph触发电荷可逆荧光探针。
[0048]
本发明所述的辅料为药用辅料,例如增溶剂、乳化剂、稳定剂、防腐剂等。
[0049]
本发明的第四种实施方式,提供了一种上述ph触发电荷可逆荧光探针在检测ph中的应用。研究表明,本发明提供ph触发电荷可逆荧光探针的荧光在酸性环境下相对于在碱性环境下会发生蓝移,从而实现对ph变化的灵敏检测。
[0050]
本发明的第五种实施方式,提供了一种上述ph触发电荷可逆荧光探针在细胞成像中的应用,所述细胞成像为采用ph触发电荷可逆荧光探针对细胞中的脂滴染色、核仁染色或脂滴与核仁同时染色。
[0051]
所述细胞为活细胞,在一些实施例中,所述活细胞为永生化细胞或正常细胞。具体地,所述永生化细胞为hela、hepg2或a549细胞;所述正常细胞为raw264.7细胞。
[0052]
所述在细胞成像中的应用,可以以疾病的诊断与治疗为目的,也可以以非疾病的诊断与治疗为目的。其中,非疾病的诊断与治疗为目的,可以指科学研究,例如对细胞毒性及细胞染色的研究、对特定的rna回应的研究以及进一步探索lds和核仁之间相互作用关系的研究等;也可以指制备药物的应用,例如在制备细胞成像试剂中的应用。
[0053]
本发明的第六种实施方式,提供了一种细胞成像检测试剂盒,包括活性组分和缓冲液,所述活性组分为上述ph触发电荷可逆荧光探针或上述制剂组合物。
[0054]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0055]
实施例1
[0056]
ld-nu的合成路线
[0057]
将化合物2,3,3-三甲基苯并吲哚4ml(25.2mmol)和三氯甲烷30ml加入到100ml圆底烧瓶中,充分搅拌。然后向溶液中加入2ml(25.2mmol)碘乙醇,加热回流反应48h以上,用柱层析法对反应进行监测。反应结束后,将体系冷却至室温,过滤得到3-(2-羟乙基)-1,1,2-三甲基-1h-苯并[e]吲哚-3-碘化铵。1hnmr(dmso-d6,400mhz)δ(ppm):8.39(d,j=8.4hz,1h),8.29(d,j=8.9hz,1h),8.22(d,j=8.2hz,1h),8.14(d,j=8.9hz,1h),7.76(dt,j=24.2,7.4hz,2h),5.32(s,1h),4.72(t,j=5.1hz,2h),3.94(t,j=5.1hz,2h),2.92(s,3h),
1.78(,6h)。
[0058]
然后将3-(2-羟乙基)-1,1,2-三甲基-1h-苯并[e]吲哚-3-碘化铵(0.2g,0.525mmol)和乙醇(30ml)加入到三口烧瓶中,在55℃加热直到溶解。然后,加入4-二甲基氨基肉桂醛(0.11g,0.606mmol),使其完全溶解,并将温度升高至回流48h以上。用柱层析法监测反应过程。反应结束后,将体系冷却至室温,过滤得到2-((1e,3e)-4-(4-(二甲氨基)苯基)丁-1,3-二烯-1-基)-3-(2-羟乙基)-1,1-二甲基-1h-苯并[e]吲哚-3-碘化铵。1h nmr(400mhz,dmso-d6)δ(ppm):8.63(d,j=16.1hz,1h),8.54(d,j=1.9hz,1h),8.45(d,j=8.5hz,1h),8.31-8.15(m,3h),8.09(d,j=9.0hz,1h),7.92-7.76(m,3h),7.75-7.66(m,2h),7.32(dd,j=9.1,2.6hz,1h),7.04(d,j=2.6hz,1h),5.27(s,1h),4.91(t,j=5.0hz,2h),3.98(t,j=5.0hz,2h),3.14(s,6h),2.08(s,6h).
13
c nmr(101mhz,dmso-d6)δ(ppm):181.87,155.47,153.18,151.72,139.71,137.22,133.05,131.80,131.00,130.46,128.69,127.42,126.99,124.41,123.57,123.39,113.78,112.85,112.07,59.20,53.28,49.00,26.65.hrms(m/z):calcd for c
28h31
in2o:538.15;found:411.25(m-i)
+
。
[0059]
实施例2
[0060]
细胞培养与成像
[0061]
hela和hepg2细胞在含10%胎牛血清(fbs)和1%青霉素/链霉素的hdmem培养基中培养。raw264.7细胞在含10%胎牛血清/1%青霉素/链霉素的rpmi 1640培养基中培养。a549细胞在含10%胎牛血清和1%青霉素/链霉素的f12k培养基中培养。采用甲基噻唑酰二苯基溴化四唑(mtt)法测定探针对哺乳动物细胞的毒性。hela、hepg2和raw264.7细胞用2μm ld-nu在培养基中孵育20min,在荧光显微镜下从绿色通道和红色通道观察。利用3d成像技术对红通道和绿通道荧光进行成像,并观察lds与核仁的位置关系。hepg2细胞用5μm dapi孵育后,在荧光显微镜下观察。
[0062]
实施例3
[0063]
ld-nu的ph传感行为及其机理实验
[0064]
为了验证探针是否对ph变化有响应,对探针ld-nu进行了ph滴定实验,得到吸收光谱和荧光光谱如图1a-c所示。如图1a所示,随着ph值的降低,探针ld-nu的最大吸收峰逐渐由380nm变为600nm。而且当探针被380nm激发时,随着ph的增加,ld-nu的荧光强度逐渐增加,在470nm左右出现最大发射峰(图1b)。而当探针被600nm激发时,则观察到荧光强度的相反变化,在727nm附近出现了一个强烈的发射峰(图1c)。此外,727和470nm之间的荧光强度比(i
727nm
/i
470nm
),表示探针ld-nu对ph值的比率荧光响应(图1d)。同时,根据图1e计算出ld-nu的pka为6.24。此外,还对ld-nu的光稳定性进行了研究,如图1f所示,荧光强度比(i
727nm
/i
470nm
)的ld-nu在ph 4.0和9.0下,即使在氙灯连续照射20分钟,仍然稳定,这有利于ld-nu长时间成像细胞。这些实验结果初步证实了探针ld-nu的荧光在酸性环境下相对于在碱性环境下会发生蓝移,从而实现对ph变化的灵敏检测。
[0065]
为了进一步证实探针ld-nu在碱性环境中的蓝移是由于环化反应引起的ld-nu在dmso-d6中的1h nmr谱得到了加入naoh前后的谱图。如图2a所示,羟基氢(红色虚线)有明显的“s”峰而在加入naoh后的谱图中则消失。更重要的是,苯胺环上的两个甲基质子(1和2)在dmso-d6中由一个“s”峰表示,但在dmso-d6中变成了两个“s”峰(3和4)后添加氢氧化钠。为了解释这一现象,利用gauss软件对不同状态下探针ld-nu的几何结构进行了优化。从图2b可
以看出,在开环形式下,苯环、两个双键和苯唑吲哚共面,因此两个甲基质子(1和2)可以对称分布在平面两侧,得到相同的屏蔽效果。而在环化形式下,苯并吲哚基团无法与其他两基团共面,因此两个甲基质子(3和4)的屏蔽效果不同,从而出现了两个“s”峰。因此,随着ph值的增加,探针ld-nu可以从正电荷形式逐渐过渡到环化。此外,通过单晶x射线衍射分析进一步确认了ld-nu在开环形态下的结构(ccdc编号为2192276,图3)。
[0066]
实施例4
[0067]
ld-nu的细胞毒性和活细胞的染色能力的实验
[0068]
细胞毒性是评价荧光探针的关键参数,因此进行探针ld-nu的mtt测定。如图4所示,hepg2、hela、a549和raw 264.7细胞均被ld-nu(2、4、6、8和10μm)染色24h,所有细胞存活率仍高于87%。因此,ld-nu探针在短时间内(如30min)对活细胞成像显示出可忽略的细胞毒性,可用于分析细胞内部的生物行为。根据设计的机制,ld-nu探针可以同时对lds和核仁进行染色,并首次用ld-nu对hepg2细胞进行染色,验证其对细胞成像的能力。如图5a-d所示,绿色(a)和红色(b)通道都发射荧光,但其显示的分布、形状和大小不同。绿色荧光像“液滴”一样在细胞内随机出现,而红色荧光则以较大的实体形式集中在细胞核内。为了进一步确定ld-nu的染色位置,将红色通道和绿色通道的荧光分别与dic图像合并(图5e-f)。首先,绿色“液滴”的平均直径几乎为1-2μm,这与相关报道中lds的大小一致。此外,由于lds的折射率高于细胞中的其他结构,因此在dic图像中呈现为黑点。因此,图5e的dic图像中的黑色图应该是lds,而图5g中的绿色荧光根据图5i可以很好地与黑色图合并。另外,如图5j-l放大图像所示,图5j中的红色荧光与图5k dic图像中的核仁融合得非常好。综合来看,探针ld-nu可以同时对lds和核仁进行染色,分别显示绿色和红色荧光。此外,在hela(图6)和raw(图7)细胞中也观察到类似的现象。更幸运的是,在图5i和5l中,在核仁附近成像到一个lds,如图5i和5l中白色箭头所示,提示lds与核仁之间可能存在密切联系甚至物理联系。
[0069]
为了更准确地观察lds与核仁之间的关系,利用3d成像技术对细胞进行多维度可视化。如图8所示,选取面板a中的一个细胞进行放大,在xy平面的红色核仁正上方有一个绿色的lds(图8b)。然后,得到该细胞的3d图像(图8c),从xy、xz、yz三个维度观察lds与核仁之间的物理连接(图8d)。这一实验事实证实了lds与核仁之间确实存在物理接触,为核lds的存在提供了坚实的证据,为探索lds与核仁相互作用奠定了基础。
[0070]
实施例5
[0071]
ld-nu的特定的rna的回应的实验
[0072]
由于缺乏特异性靶向基团,rna探针的开发一直是一个难题。为了详细研究探针ld-nu的rna靶向机制,本实施例进行了一系列实验。首先,分别进行了ld-nu对rna和dna响应的体外滴定荧光测定。如图9a所示,随着rna的加入,ld-nu的荧光强度逐渐增强。探针ld-nu的rna结合常数为2.0*106m-1
(图9b),表明其对rna具有较高的亲和力。同时,虽然ld-nu的荧光强度随着dna的加入而增加,但其结合常数仅为2.8*105m-1
,远小于ld-nu与rna的结合常数(图10)。因此,在rna和dna同时存在的情况下,ld-nu可以优先与rna结合,这为探针在细胞核中特异性染色核仁提供了前提条件。
[0073]
为了进一步确认探针ld-nu与rna的结合机制,本实施例对ld-nu进行了开环形式的分子对接分析。如图9c所示,在开环形式下,rna与探针ld-nu之间有三个主要的结合位点。首先,环上带正电荷的n原子与a14的磷酸基形成盐桥,核仁弱酸性环境中质子化的二甲
苯胺基也与g18形成盐桥。此外,羟基与a15和g8分别形成了两个典型的氢键。此外,在ld-nu与u6和g17之间还观察到几个弱氢键。因此,由于静电相互作用和氢键作用,开环形式的ld-nu可以特异性地对rna进行染色。rna与ld-nu的二维相互作用图如图9d所示。
[0074]
最后,为了证明探针ld-nu通过靶向rna、rna和dna消化实验在细胞内染色核仁。如图11所示,在用脱氧核糖核酸酶(dnase)消化4h后,hepg2细胞的核仁内仍能在红色通道中观察到明亮的荧光。而用核糖核酸酶(rnase)消化相同时间后,核仁中未见红色荧光。此外,在hela细胞中也观察到同样的现象(图12)。此外,为了确认在dnase消化4h后,细胞核中的dna足够被完全消除,本实施例使用dapi(一种商用dna探针)作为对照。从图13中可以看出,dnase消化4h,dapi染色2min后,蓝色荧光只出现在细胞膜中,而没有出现在细胞核中。当dapi的染色时间延长到20min时,细胞质中只出现了微弱的蓝色荧光,而细胞核中没有。因此,用dnase消化4h足以去除细胞核中的所有dna。从上面的实验可以看出,ld-nu探针可以特异性地对核仁进行染色,因为它针对的是rna,而且它们之间有很强的氢键和静电相互作用。
[0075]
实施例6
[0076]
追踪lds与核仁之间的关系
[0077]
根据上述实验,ld-nu探针可以对lds和核仁进行双色成像,并可视化了它们的物理接触。因此,推测可以利用ld-nu进一步探索两种亚细胞结构之间的相互作用关系。如上所述,lds储存了大量的脂肪酸,必要时可以释放到细胞质中作为脂质合成和蛋白质修饰的底物。然而,脂肪酸在细胞核中的作用还不清楚。
[0078]
根据最近的报道,pfoa可以干扰脂肪酸的正常活性,因为它具有脂肪酸样特性、高度疏水、刚性全氟碳碳尾和强极性羧基头。因此,首先用pfoa诱导细胞,研究脂肪酸在lds
[0079]
与核仁相互作用中的作用。如图14所示,随着pfoa的加入,原本与核仁有物理接触的lds(黄色箭头)逐渐远离核仁。pfoa处理10min后,lds与核仁之间的距离逐渐增大到4μm。同时,随着pfoa的加入,原本分散的3个直径约为2.5μm的lds逐渐积累为直径为5μm的大lds,这与相关报道一致。这可能是因为pfoa的加入干扰了脂肪酸的正常运作,导致lds活性受到限制,从而阻断了lds与核仁的相互作用,触发了lds的积累。因此,脂肪酸在它们的相互作用中起着至关重要的作用,甚至影响着lds与核仁的物理接触。
[0080]
此外,细胞凋亡作为清除不必要或异常细胞的重要生理过程,对内环境的稳定起着重要作用因此,本实施例研究了lds和核仁在细胞凋亡过程中的变化。从图15的dic图像中可以看出,h2o2处理hepg2细胞后,质膜周围出现了几个膜泡,说明此时细胞已处于凋亡中后期。凋亡细胞中核仁的大小明显增大,平均直径由3.41μm增大到5.70μm,表明凋亡对核仁的形态有很大影响。放大图像显示,凋亡细胞中lds与核仁之间也存在物理接触。此外,在hela细胞中也观察到同样的现象(图16)。这可能是因为在lds与核仁的相互作用中,lds的运动占主导地位,而核仁处于被动接触状态。因此,在核仁受到轻微损伤后,lds与核仁之间的联系仍能保持,但在lds中脂肪酸活性受到干扰后,lds与核仁之间的联系被阻断。
[0081]
最后,还值得指出的是,该探针可以穿透核膜,因此可以同时看到胞质和核内的lds。迄今为止,lds在细胞质中的功能已被充分研究,而在细胞核中的作用尚不清楚。因此,研究两种环境中lds的关系,对于深入了解细胞内脂质网络具有重要意义。因此,本实施例首先用ld-nu探针研究了细胞发泡过程中lds的变化。如图17所示,raw细胞与ldl孵育12h
后,红绿通道荧光强度比从0.91下降到0.66,说明细胞中lds的总体含量增加。但ldl处理后,细胞核与全细胞的绿色荧光强度比从0.07下降到0.03,且ldl与核仁之间的物理接触(白色箭头)仍然存在。因此,虽然ldl的加入使细胞中lds的数量几乎翻倍,但对细胞核lds的数量和功能没有明显影响。此外,在炎症刺激过程中也观察到类似的现象。从图18中可以看出,lps处理细胞后,虽然整体绿色荧光强度降低,但细胞核中lds的数量及其与核仁的接触并未受到明显干扰。这些实验结果表明,细胞发泡和炎症刺激可分别增加或减少细胞质中的lds,而对核中的lds无显著影响。这可能是因为靠近核仁的lds是在靠近核膜的内质网中产生的,可以直接运输到细胞核,从而大大避免了细胞质内刺激的干扰。
[0082]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1