一种红光铱配合物及其应用的制作方法
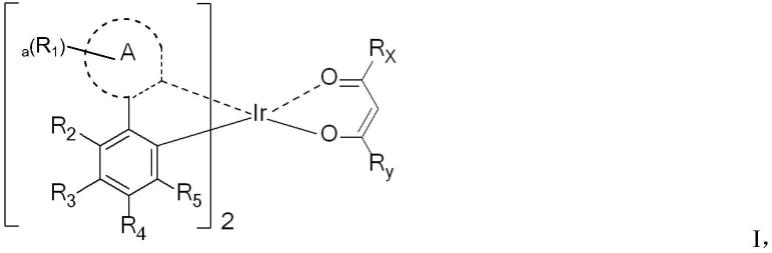
1.本发明涉及有机电致发光技术领域,具体涉及一种稠环、环烷基的红光铱配合物及其在有机电致发光器件上的应用。
背景技术:
2.有机电致发光器件(oleds)为在两个金属电极之间通过旋涂或者真空蒸镀沉积一层有机材料制备而成的器件,早在1963年,pope等人发表了一篇关于蒽单晶电致发光的文章,但是由于需要很高的驱动电压(》300v),使得蒽单晶的研究工作仍处于基础研究水平,无法用于商业化的电子设备。到1987年,美国柯达公司的tang和van slyke开发出三明治结构的有机电致发光器件,使用8-羟基喹啉铝(alq3)作为电子传输层和发光层,芳香族二胺作为空穴传输层。器件工作电压小于10v,亮度超过1000cd m-2
(tang,c.w., vanslyke,s.a.(1989).organic electroluminescent diodes.in:shionoya,s.,kobayashi,h. (eds)electroluminescence.springer proceedings in physics,vol 38.springer,berlin, heidelberg.),这一突破性的研究引发了oled里程碑式发展。至此,由于有机发光器件具有结构简单、响应速度快、省电、色域广、对比高等优点,已经广泛应用在手机、电脑等平板显示器上。
3.经典的三层有机电致发光器件包含空穴传输层、发光层和电子传输层。由阳极产生的空穴经空穴传输层跟由阴极产生的电子经电子传输层结合在发光层形成激子,而后发光。有机电致发光器件可以根据需要通过改变发光层的材料来调节发射各种需要的光。
4.由于注入的载流子是半自旋粒子,重组产生的激发态的自旋多重度由自旋统计所决定,即有25%的激子为单重激发态,75%的激子为三重激发态。这两种激子所对应的辐射跃迁途径分别是单线态的荧光和三重态的磷光。最早的荧光oled仅依靠25%单重态激子,75%的三重态激子均被浪费掉。
5.1998年,s.forrest和m.baldo等首次将金属配合物作为发光材料应用于oleds中,打破了荧光材料内量子效率低于25%的极限,试图实现100%的内量子效率,以此提高器件的效率。因此,高效率的磷光有机电致发光器件的研究为平板和便携式显示行业的发展提供了一个重要的推动力。
6.铱的原子序数较大,可使配合物产生很强的自旋轨道耦合,有利于磷光发射;铱金属离子中的d轨道能级分裂较大,避免与配合物的mlct态相互作用而降低磷光发射效率;铱的三价离子可与配体形成非常稳定的中性分子,有利于采用真空蒸镀或溶液加工的方式制备器件。此外,络合物的发射光的颜色可以涵盖整个可见光谱,稳定性好等特性,符合电致发光发光材料的要求,使得铱配合物成为有机电致发光磷光材料的研究重点。
7.然而,由于红色铱配合物能隙较窄,致使红光材料同载流子传输层之间能级匹配困难,并容易发生浓度淬灭,造成红光器件的综合性能不理想,影响了整个器件的颜色饱和度。因此,对于红色铱配合物及器件的研究对于器件性能(例如在效率、电压、寿命等方面) 显得尤为重要。铱配合物辅助配体可以用来微调发光波长、改善升华性质、热稳定性以及提
高材料的效率。现有的乙酰丙酮配体,特别是有分叉烷基支链的乙酰丙酮类配体,在上述性质上取得了一些效果,但是在发光效率和寿命上,均还有一定的不足。
8.因此,本领域需要进一步在器件的颜色饱和度、发光效率和器件寿命上做进一步的改进。
技术实现要素:
9.本发明的目的在于提供一种铱配合物,通过调整主配体和辅助配体的结构组合,可以进一步提升器件的颜色饱和度(红色饱和度)、发光效率和器件寿命。
10.本发明的另一目的是提供一种合成上述铱配合物的合成方法。
11.本发明的再一目的是提供一种使用上述铱配合物作为红光掺杂材料的器件。
12.技术方案:
13.为了完成上述发明目的,本发明提供了一种由通式ⅰ表示的铱配合物:
[0014][0015]
其中,
[0016]
环a选自由三个或者更多个单环基团彼此稠合的c
12-c
30
多环基团,其前提条件是:环a表示的c
12-c
30
多环基团至少包含通式ⅱ的结构:
[0017][0018]
其中,*表示通式ⅱ与依(ir)的结合位点,*'表示通式ⅱ与通式ⅰ中的苯环的结合位点;
[0019]
a选自0-20的整数,当a表示≥2的整数时,r1可以彼此相同或者不同,r1的位置可以相同也可以不同;
[0020]
r1、r2、r3、r4和r5相同或不同,各自独立地为h、氘、卤素、-cf3、cn、氨基、取代或未取代的c
1-c
10
烷氧基或取代或未取代的c
1-c
30
烷基,c
1-c
10
烷氧基和c
1-c
30
烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代,其中,卤素选自氟、氯、溴或碘;并且
[0021]rx
和ry相同或者不同,各自独立地包含饱和的脂肪环结构。
[0022]
在本发明的一些实施方案中,环a为通式ii与1-3个五元环或者六元环稠合的基团。
[0023]
在本发明的一些实施方案中,环a为通式ii与1-3个芳环稠合的基团。
[0024]
具体的,本发明的通式ii结构稠合的芳环结构越多,基态和激发态的能量差越高,进一步提高发光效率,同时可以提升器件红光的色彩饱和度。但是,稠合的环数也不宜过
多,当稠合环数超过3个时,化合物的稳定性会有所下降,从而导致器件寿命减少,并且可能导致器件的发光波长超出可见光范围,发红外光。
[0025]
在本发明的一些实施方案中,芳环为苯环。
[0026]
在本发明的一些实施方案中,环a为通式ii与1个芳环稠合的基团。
[0027]
在本发明的一些实施方案中,环a为通式ii与1个苯环稠合。
[0028]
在本发明的一些实施方案中,环a的结构选自通式rd-1到rd-3中的任意一个:
[0029][0030]
具体的,在通式ii的基础上稠合一个苯环,有助于提升器件色彩饱和度,同时提供较高的发光效率;并且所述结构具有更优的热稳定性,有助于提高器件寿命。
[0031]
在本发明的一些实施方案中,在rd-1到rd-3任一结构中,a表示0到8中任一整数,具体的可以是0、1、2、3、4、5、6、7或8;当a表示≥2的整数时,r1可以相同或者不同,各自独立地选自h、氘、卤素、-cf3、cn、氨基、取代或未取代的c
1-c
10
烷氧基或取代或未被取代的c
1-c
30
烷基。
[0032]
在本发明的一些实施方案中,烷基中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0033]
在本发明的一些实施方案中,卤素包括氟、氯、溴或碘。
[0034]
在本发明的一些实施方案中,烷基包括直链烷基或支链烷基。
[0035]
在本发明的一些优选实施方案中,当a表示≥2的整数时,r1可以相同或者不同,各自独立地选自h、氘、卤素、-cf3、cn或氨基。
[0036]
在本发明的一些优选实施方案中,当a表示≥2的整数时,r1之间可以相同或者不同,各自独立地选自取代或未取代的c
1-c
10
烷氧基。
[0037]
在本发明的一些优选实施方案中,当a表示≥2的整数时,r1之间可以相同或者不同,各自独立地选自取代或未取代的c
1-c4烷氧基。
[0038]
在本发明的一些优选实施方案中,烷氧基选自甲氧基、乙氧基或丙氧基。
[0039]
在本发明的一些优选实施方案中,当a表示≥2的整数时,r1可以相同或者不同,各自独立地选自取代或未被取代的c
1-c
20
烷基。
[0040]
在本发明的一些优选实施方案中,当a表示≥2的整数时,r1可以相同或者不同,各自独立地选自取代或未被取代的c
1-c
10
烷基。
[0041]
在本发明的一些优选实施方案中,当a表示≥2的整数时,r1可以相同或者不同,各自独立地选自取代或未被取代的c
1-c4烷基。
[0042]
在本发明的一些优选实施方案中,烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、新戊基、1-甲基戊基、2-甲基戊基、1-戊基己基、1-丁基戊基、1-庚基辛基或 3-甲基戊基。
[0043]
在本发明的一些优选实施方案中,烷基选自甲基、乙基、丙基、异丙基、丁基和异丁基。
[0044]
在本发明的一些实施方案中,通式rd-1中包含8个可取代位(即a可以为0-8的任意整数),分别将8个可取代位上的取代基标号为t
11
、t
12
、t
13
、t
14
、t
15
、t
16
、t
17
和t
18
:
[0045][0046]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中至少一个不为氢,且至多三个不为氢。
[0047]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中有一个不为氢。
[0048]
在本发明的一些优选实施方案中,通式rd-1中t
14
、t
15
、t
17
和t
18
中的任意一个不为氢,在通式rd-1中t
14
、t
15
、t
17
、t
18
对应的位置取代,可以使制备的铱配合物为器件提供更高的发光效率以及稳定性。
[0049]
在本发明的一些优选实施方案中,t
11-t
18
中任意一个不为氢的取代基选自氘、卤素、
ꢀ‑
cf3、cn、氨基、取代或未取代的c
1-c
10
烷氧基或取代或未被取代的c
1-c4烷基,c
1-c
10
烷氧基和c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0050]
在本发明的一些优选实施方案中,t
11-t
18
中任意一个不为氢的取代基选自氘、氟、
ꢀ‑
cf3、氨基、cn或c
1-c4烷基。
[0051]
在本发明的一些优选实施方案中,t
13-t
16
中任意一个不为氢的取代基选自氘、氟、
ꢀ‑
cf3、氨基、cn或c
1-c4烷基。
[0052]
在本发明的一些优选实施方案中,c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基和叔丁基中任意一个。
[0053]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中任意两个不为氢。
[0054]
在本发明的一些优选实施方案中,通式rd-1中t
13-t
16
中任意两个不为氢。
[0055]
在本发明的一些优选实施方案中,通式rd-1中两个不为氢的取代基包括t
14
和/或t
16
。
[0056]
在本发明的一些优选实施方案中,通式rd-1中t
13
、t
14
、t
16
中任意两个不为氢。
[0057]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
任意两个不为氢的取代基各自独立地选自氘、卤素、-cf3、氨基、cn或取代或未取代的c
1-c4烷基,c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0058]
在本发明的一些优选实施方案中,c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0059]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中至少有一个选自f、氨基或
ꢀ‑
cf3。
[0060]
在本发明的一些优选实施方案中,通式rd-1中t
13
、t
14
、t
16
中至少有一个选自f、氨基或-cf3。
[0061]
具体的,当取代基包括f或-cf3时,可以进一步提高器件的发光效率。
[0062]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中任意三个不为氢。
[0063]
在本发明的一些优选实施方案中,通式rd-1中t
13-t
18
中任意三个不为氢。
[0064]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中任意三个不为氢的取代基各自独立地选自氘、卤素、-cf3、氨基、cn或取代或未取代的c
1-c4烷基,c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0065]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中至少有一个选自f、氨基或
ꢀ‑
cf3。
[0066]
在本发明的一些优选实施方案中,通式rd-1中t
11-t
18
中至少有一个选自f或-cf3。
[0067]
在本发明的一些优选实施方案中,通式rd-1中t
13-t
18
中至少有一个选自f、氨基或
ꢀ‑
cf3。
[0068]
在本发明的一些优选实施方案中,通式rd-1中t
13-t
16
中至少有一个选自f、氨基或
ꢀ‑
cf3。
[0069]
在本发明的一些优选实施方案中,通式rd-1中t
13-t
18
中至少有一个选自f或-cf3。
[0070]
在本发明的一些优选实施方案中,当通式rd-1中t
11-t
18
中不为氢的取代基数目≥2 时,任意两个或者更多个取代基团可以彼此连接形成碳环基团。
[0071]
在本发明的一些优选实施方案中,碳环基团可以是c
5-c
20
碳环基团。
[0072]
其中,c
5-c
20
碳环基团上的氢可以各自独立地被选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基的取代基取代。
[0073]
在本发明的一些实施方案中,通式rd-2中包含8个可取代位(即a可以为0-8的任意整数),分别将8个可取代位上的取代基标号为t
21
、t
22
、t
23
、t
24
、t
25
、t
26
、t
27
和t
28
:
[0074][0075]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中至少一个不为氢,且至多三个不为氢。
[0076]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中有一个不为氢。
[0077]
在本发明的一些优选实施方案中,通式rd-2中t
23
或t
28
任意一个不为氢,在通式 rd-2中t
23
或t
28
对应的位置取代,可以使制备的铱化合物为器件提供更高的发光效率以及稳定性。
[0078]
在本发明的一些优选实施方案中,t
21-t
28
中任意一个不为氢的取代基选自氘、卤素、
ꢀ‑
cf3、cn、氨基、取代或未取代的c
1-c
10
烷氧基或取代或未被取代的c
1-c4烷基,c
1-c
10
烷氧基或c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0079]
在本发明的一些优选实施方案中,t
21-t
28
中任意一个不为氢的取代基选自氘、氟、
ꢀ‑
cf3、cn、c
1-c4烷基或c
1-c4烷氧基。
[0080]
在本发明的一些优选实施方案中,c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基中任意一个。
[0081]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中任意两个不为氢。
[0082]
在本发明的一些优选实施方案中,通式rd-2中t
23-t
28
中任意两个不为氢。
[0083]
在本发明的一些优选实施方案中,通式rd-2中两个不为氢的取代基包括t
23
和/或t
28
。
[0084]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
任意两个不为氢的取代基各自独立地选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基或烷氧基,c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0085]
在本发明的一些优选实施方案中,c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0086]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中至少有一个选自f、c
1-c4烷氧基或-cf3。
[0087]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中至少有一个选自f或-cf3。
[0088]
在本发明的一些优选实施方案中,通式rd-2中t
23-t
28
中至少有一个选自f、c
1-c4烷氧基或-cf3,从而可以进一步提高器件的发光效率。
[0089]
在本发明的一些优选实施方案中,通式rd-2中t
23-t
28
中至少有一个选自f或-cf3,从而可以进一步提高器件的发光效率。
[0090]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中任意三个不为氢。
[0091]
在本发明的一些优选实施方案中,通式rd-2中t
23-t
28
中任意三个不为氢。
[0092]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中任意三个不为氢的取代基各自独立地选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基,c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0093]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中至少有一个选自f、-och3或-cf3。
[0094]
在本发明的一些优选实施方案中,通式rd-2中t
21-t
28
中至少有一个选自f或-cf3。
[0095]
在本发明的一些优选实施方案中,通式rd-2中t
23-t
28
中至少有一个选自f、-och3或-cf3。
[0096]
在本发明的一些优选实施方案中,通式rd-2中t
23-t
28
中至少有一个选自f或-cf3。
[0097]
在本发明的一些优选实施方案中,当通式rd-2中t
21-t
28
中不为氢的取代基数目≥2 时,任意两个或者更多个取代基团可以彼此连接形成碳环基团。
[0098]
在本发明的一些优选实施方案中,碳环基团可以是c
5-c
20
碳环基团。
[0099]
其中,c
5-c
20
碳环基团上的氢可以各自独立地被选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基的取代基取代。
[0100]
在本发明的一些实施方案中,通式rd-3中包含8个可取代位(即a可以为0-8的任意整数),分别将8个可取代位上的取代基标号为t
31
、t
32
、t
33
、t
34
、t
35
、t
36
、t
37
和t
38
:
[0101][0102]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中至少一个不为氢,且至多三个不为氢。
[0103]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中有一个不为氢。
[0104]
在本发明的一些优选实施方案中,通式rd-3中t
33-t
38
任意一个不为氢。在通式rd-2 中t
33-t
38
对应的位置取代,可以使制备的铱配合物为器件提供更高的发光效率以及稳定性。
[0105]
在本发明的一些优选实施方案中,t
31-t
38
中任意一个不为氢的取代基选自氘、卤素、
ꢀ‑
cf3、cn、氨基、取代或未取代的c
1-c
10
烷氧基或取代或未被取代的c
1-c4烷基,c
1-c
10
烷氧基和c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0106]
在本发明的一些优选实施方案中,t
21-t
28
中任意一个不为氢的取代基选自氘、氟、
ꢀ‑
cf3、cn、c
1-c4烷基或c
1-c4烷氧基。
[0107]
在本发明的一些优选实施方案中,c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基中任意一个。
[0108]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中任意两个不为氢。
[0109]
在本发明的一些优选实施方案中,通式rd-3中t
34-t
37
中任意两个不为氢。
[0110]
在本发明的一些优选实施方案中,通式rd-3中t
35
、t
37
和t
38
中任意两个不为氢。
[0111]
在本发明的一些优选实施方案中,通式rd-3中两个不为氢的取代基包括t
35
和/或t
37
。
[0112]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中任意两个不为氢的取代基各自独立地选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基或烷氧基,c
1-c4烷基的烷基链中的氢可以各自独立地被氘、卤素、-cf3或cn取代。
[0113]
在本发明的一些优选实施方案中,c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0114]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中至少有一个选自f、c
1-c4烷基或烷氧基或-cf3。
[0115]
在本发明的一些优选实施方案中,通式rd-3中t
35
、t
37
或t
38
中至少有一个选自f、 c
1-c4烷基或烷氧基或-cf3,从而可以进一步提高器件的发光效率。
[0116]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中任意三个不为氢。
[0117]
在本发明的一些优选实施方案中,通式rd-3中t
32
、t
34
和t
35-t
38
中任意三个不为氢。
[0118]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中任意三个不为氢的取代基各自独立地选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基或烷氧基,c
1-c4烷基的烷基
链中的氢可以各自独立地被氘、卤素、-cf3、c
1-c4烷基或烷氧基或cn取代。
[0119]
在本发明的一些优选实施方案中,通式rd-3中t
31-t
38
中至少有一个选自f、c
1-c4烷基或烷氧基或-cf3。
[0120]
在本发明的一些优选实施方案中,通式rd-3中t
34-t
37
中至少有一个选自f、c
1-c4烷基或烷氧基或-cf3。
[0121]
在本发明的一些优选实施方案中,通式rd-3中t
32
、t
34
和t
35-t
38
中至少有一个选自 f、c
1-c4烷基或烷氧基或-cf3。
[0122]
在本发明的一些优选实施方案中,当通式rd-3中t
31-t
38
中不为氢的取代基数目≥2 时,任意两个或者更多个取代基团可以彼此连接形成碳环基团。
[0123]
在本发明的一些优选实施方案中,碳环基团可以是c
5-c
20
碳环基团。
[0124]
其中,c
5-c
20
碳环基团上的氢可以各自独立地被选自氘、卤素、-cf3、cn或取代或未取代的c
1-c4烷基的取代基取代。
[0125]
在本发明的一些实施方案中,环a为通式ii与2个芳环稠合的基团。
[0126]
在本发明的一些实施方案中,通式ii与2个苯环稠合的结构选自rd-4到rd-12中的任意一个:任意一个:
[0127]
在本发明的一些实施方案中,环a可以为通式ii与3个芳环稠合的基团。
[0128]
在本发明的一些实施方案中,通式ii与3个苯环稠合的结构优选rd-13:
[0129][0130]
在本发明的一些实施方案中,环a可以为通式ii与饱和或者不饱和的五元环稠合
的基团。
[0131]
在本发明的一些实施方案中,通式ii与饱和或者不饱和的五元环稠合的基团可以是rd-14至rd-18中的任意一种。
[0132][0133][0134]
在本发明的一些实施方案中,环a可以是通式ii与含有n、o或s的五元或者六元杂环稠合的基团。
[0135]
在本发明的一些实施方案中,通式ii与含有n、o或s的五元或者六元杂环稠合的基团可以是rd-19至rd-27中的任意一种:
[0136][0137]
在本发明的一些实施方案中,环a可以为通式ii通过一个五元环与苯环环稠合的基团,其中五元环中未参与稠合的碳原子可以被n、o或s取代。
[0138]
在本发明的一些实施方案中,通式ⅱ通过一个五元环与苯环环稠合的基团可以是 rd-28至rd-42中的任意一种:
[0139][0140]
在本发明的一些实施方案中,通式rd-4至rd-42中可取代位的取代基标记为pn,其中n为大于0的整数,在同一取代位上可含有取代基数量记为m,m=0、1或2;环a可以是下列通式中的任意一种:
[0141]
[0142]
[0143]
[0144]
[0145]c10
烷基。
[0152]
在本发明的一些优选实施方案中,p
1-p
124
各自独立地选自取代或未被取代的c
1-c4烷基。
[0153]
在本发明的一些优选实施方案中,烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、新戊基、1-甲基戊基、2-甲基戊基、1-戊基己基、1-丁基戊基、1-庚基辛基或 3-甲基戊基。
[0154]
在本发明的一些优选实施方案中,烷基选自甲基、乙基、丙基、异丙基、丁基或异丁基。
[0155]
在本发明的一些实施方案中,在通式i中,r2、r3、r4和r5相同或不同,各自独立地选自h或c
1-c
10
烷基。
[0156]
在本发明的一些优选实施方案中,在通式i中,r2、r3、r4和r5相同或不同,各自独立地选自h或c
1-c4烷基。
[0157]
具体的,c
1-c
10
烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正壬基或正癸基。c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0158]
在本发明的一些优选实施方案中,r2、r3、r4和r5中的一个或更多个不为氢。
[0159]
在本发明的一些优选实施方案中,r2、r3、r4和r5中的任意1个不为氢。
[0160]
在本发明的一些优选实施方案中,r2、r3、r4和r5中的任意2个不为氢。
[0161]
在本发明的一些优选实施方案中,r2和r3不为氢。
[0162]
在本发明的一些优选实施方案中,r3和r4不为氢。
[0163]
在本发明的一些优选实施方案中,r4和r5不为氢。
[0164]
在本发明的一些优选实施方案中,r3和r5不为氢。
[0165]
在本发明的一些优选实施方案中,r2、r3、r4和r5中的任意3个不为氢。
[0166]
在本发明的一些优选实施方案中,r2、r3和r4不为氢。
[0167]
在本发明的一些优选实施方案中,r2、r3和r5不为氢。
[0168]
在本发明的一些优选实施方案中,r3、r4和r5不为氢。
[0169]
在本发明的一些实施方案中,在通式i的辅助配体部分中,r
x
和ry可以相同或者不同,各自独立地包含有饱和的脂肪环结构。饱和的脂肪环结构的热稳定性较高,从而可以提升通式i的铱配合物的热稳定性。
[0170]
在本发明的一些优选实施方案中,r
x
和ry各自独立地包含饱和的c
3-c8单环。
[0171]
在本发明的一些优选实施方案中,r
x
和ry中各自独立地包含的饱和的c
3-c8单环结构选自以下环结构中任意一种:
[0172][0173]
在本发明的一些优选的实施方案中,r
x
和ry各自独立地包含饱和的c
5-c6单环。
[0174]
具体的,c
5-c6单环具体例举如下结构:当单环的碳原子数在 5-6时,环张力较小,从而可以进一步提升通式i的铱配合物的热稳定性,使器件的使用
寿命进一步提升。
[0175]
在本发明的一些优选的实施方案中,r
x
和ry各自独立地包含的c
7-c
15
螺环或桥环。
[0176]
在本发明的一些优选实施方案中,r
x
和ry中各自独立地包含的饱和的c
7-c
15
螺环或桥环结构选自以下环结构中任意一种:
[0177][0178]
具体的,上述c
7-c
15
螺环或桥环结构具有适宜的环张力,从而可以进一步提升通式i 的铱配合物的热稳定性,使得器件的使用寿命进一步提升。
[0179]
在本发明的一些优选的实施方案中,r
x
和ry各自独立地为两个或更多个饱和的脂肪环(例如,饱和c
3-c8单环、饱和c
7-c
15
螺环和饱和c
7-c
15
桥环)通过单键连接形成的环结构。
[0180]
在本发明的一些优选的实施方案中,r
x
和ry可以各自独立地是两个或更多个c
3-c8单环通过单键连接形成的环结构。
[0181]
在本发明的一些优选的实施方案中,r
x
和ry可以各自独立地是两个或更多个c
7-c
15
螺环通过单键连接形成的环结构。
[0182]
在本发明的一些优选的实施方案中,r
x
和ry可以各自独立地是两个或更多个c
7-c
15
桥环通过单键连接形成的环结构。
[0183]
在本发明的一些优选的实施方案中,r
x
和ry可以各自独立地是一个或更多个c
7-c
15
螺环与一个或更多个c
3-c8单环通过单键连接形成的环结构。
[0184]
在本发明的一些优选的实施方案中,r
x
和ry可以各自独立地是一个或更多个c
7-c
15
桥环与一个或更多个c
3-c8单环通过单键连接形成的环结构。
[0185]
在本发明的一些优选的实施方案中,r
x
和ry各自独立地包含的环结构中的一个或更多个氢可以各自独立地被选自氘、卤素、-cf3、-cn或c
1-c4烷基的取代基取代。取代可以是单取代,也可以是多取代,可以在同一个碳原子上取代一个氢,也可以在同一个碳原子上取代两个氢,取代数不超过所在环的可取代位数,并且取代基可以相同或者不同,取代基各取代基独立地选自氘、卤素、-cf3,-cn或c
1-c4烷基。
[0186]
具体的,卤素选自氟、氯、溴或碘;c
1-c4烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
[0187]
在本发明的一些优选的实施方案中,通式i中的辅助配体结构选自rp-1至rp-21中的任意一个:
[0188][0189]
在本发明的一些优选的实施方案中,通式i的主配体包含通式rd-1到rd-42中任意一种。
[0190]
在本发明的一些优选的实施方案中,通式i的主配体包含通式rd-1到rd-18中任意一种。
[0191]
在本发明的一些优选的实施方案中,通式i的主配体包含通式rd-1到rd-13中任意一种。
[0192]
在本发明的一些优选的实施方案中,通式i的主配体包含通式rd-1到rd-3中任意一种。
[0193]
在本发明的更进一步优选的实施方案中,通式i的主配体选自下列中的任意一种:
[0194]
[0195][0196]
在本发明的一些优选的实施方案中,通式i的辅助配体选自rp-1至rp-21中任意一种。
[0197]
在本发明的一些优选的实施方案中,通式i的辅助配体选自rp-9至rp-21中任意一种。
[0198]
在本发明的一些优选的实施方案中,通式i的辅助配体选自rp-9、rp-12和rp-13至 rp-19中任意一种。
[0199]
在本发明的进一步优选的实施方案中,通式i的辅助配体选自rp-13至rp-19中任意一种。
[0200]
在本发明的更进一步优选的实施方案中,通式i的辅助配体选自rp-13和rp-19中任意一种。
[0201]
在本发明的一些优选的实施方案中,通式i的主配体与辅助配体的搭配选自以下任意一种:rd-1与rp-13、rd-2与rp-13、rd-3与rp-13、rd-1与rp-14、rd-2与rp-14、 rd-3与rp-14、rd-1与rp-16、rd-2与rp-16、rd-3与rp-16、rd-1与rp-17、rd-2 与rp-17、rd-3与rp-17、rd-1与rp-18、rd-2与rp-18、rd-3与rp-18、rd-1与rp-19、 rd-2与rp-19或rd-3与rp-19。
[0202]
在本发明的一些优选的实施方案中,通式i选自rdp-1至rdp-52所示的结构中的任意一种。
[0203]
[0204]
[0205]
[0206]
[0207][0208]
本发明所述通式i的化合物包含通式rd-1的结构时,所述通式i的化合物优选rdp-1 至rdp-24、rdp-52所示的化合物;本发明所述通式i的化合物包含通式rd-2的结构时,所述通式i的化合物优选rdp-50、rdp-51所示的化合物;本发明所述通式i的化合物包含rd-3的结构时,所述通式i的化合物优选rdp-25至rdp-49所示的化合物;上述化合物用做有机发光器件的红光掺杂材料时,可以更高的发光效率,同时热稳定性更好,可以进一步提升有机发光显示器件寿命。
[0209]
本发明还提供了一种制备上述通式i的铱配合物的方法,具体包含以下步骤:
[0210]
(1)将前体物质与三价铱反应制备得到二聚物;
[0211]
(2)二聚物与辅助配体分子和碳酸钾或者碳酸钠在溶剂中进行搅拌反应,得到所述通式i化合物;
[0212]
其中前体物质的结构式如下所示:
[0213][0214]
其中二聚物的结构式如下所示:
[0215][0216]
其中辅助配体分子的结构式如下所示:
[0217][0218]
本发明还提供一种含有通式i所示的铱配合物的有机电致发光器件,该有机电致发光器件包括阳极、阴极和有机层;有机层至少包含发光层,发光层上包含本发明通式i所示的任意一种铱配合物,通式i的铱配合物作为红光掺杂材料添加于发光层材料中。
[0219]
在本发明的一些实施方案中,有机电致发光器件发射可见红光。
[0220]
在本发明的一些实施方案中,有机层还包括空穴注入层、空穴传输层、空穴阻挡层、电子注入层或电子传输层中的至少一层。
[0221]
在本发明的一些实施方案中,有机层通过真空蒸镀法、分子束蒸镀法、溶于溶剂的浸涂法、旋涂法、棒涂法或者喷墨打印中任意一种方式制备。
[0222]
在本发明的一些实施方案中,阳极、阴极通过蒸镀法或者溅射法进行制备。
[0223]
在本发明的一些实施方案中,有机电致发光器件可用于制备显示或者发光照明光源。
[0224]
有益效果:本发明提供的具有通式i所示结构的铱配合物,环a结构中含有较多共轭结构,能够提升颜色饱和度,并提升器件的发光效率。辅助配体进一步搭配饱和脂肪环的结构,能够进一步提升铱配合物的热稳定性,从而提升了器件的稳定性,进一步改善器件的使用寿命。
具体实施方式
[0225]
以下所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0226]
以下所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。
[0227]
配合物的制备
[0228]
1.化合物1:rdp-1
[0229]
步骤1:辅助配体rp-13的合成
[0230]
取一单口烧瓶,加入dmf(650ml),然后在搅拌下分批加入叔丁醇钾(222.29g),加热至60℃,然后在氮气保护下滴加ip-1(100.00g),滴加完毕后继续搅拌20min,然后滴加ip-2(169.02g),ip-2滴加完毕后,60℃下继续搅拌30min,停止加热。加入水和正己烷萃取并洗涤多次,收集有机相,有机相旋蒸除去溶剂,柱层析分离得到白色固体 169.38g,产率90.44%。
[0231][0232]
步骤2:中间体ip-3的合成
[0233]
将2-氯-4-碘吡啶-3-甲醛(13.00g)、2-氟苯硼酸(7.48g)和碳酸氢钠(8.17g)加入烧瓶中,加入甲苯(100ml)、乙醇(50ml)和水(50ml),氮气置换后加入四三苯基磷钯 (50mg),然后加热回流搅拌4h。反应结束后,加水和乙酸乙酯萃取,收集有机相,柱层析分离得到白色固体10.92g,产率95.34%。
[0234]
步骤3:中间体ip-4的合成
[0235]
取一烧瓶,向其中加入甲氧甲基三苯基氯化磷(17.46g)和甲苯(150ml),冰水浴下分批加入叔丁醇钾(6.67g),加完后继续在冰水浴下搅拌1h,然后滴加用50ml甲苯溶解的中间体ip-3(10.00g),滴加完毕后撤去冰水浴,继续搅拌2h。反应结束后,加水淬灭反应,然后使用水和乙酸乙酯萃取并洗涤多次,收集有机相,有机相柱层析分离得到白色固体8.41g,产率75.15%。
[0236]
步骤4:中间体ip-5的合成
[0237]
取一烧瓶,向其中加入中间体ip-4(8.00g)和二氯甲烷(80ml),氮气置换,然后搅拌下向其中滴加甲磺酸(23.32g),滴加完毕后继续室温下搅拌2h,反应结束后加水淬灭。使用二氯甲烷和水萃取,收集有机相,柱层析分离得到白色固体6.30g,产率89.64%。
[0238]
步骤5:配体rd-1-1的合成
[0239]
取一烧瓶,向其中加入中间体ip-5(6.00g)和3,5-二甲基苯硼酸(4.66g),加入甲苯 (50ml)、乙醇(25ml)和水(25ml),氮气置换并搅拌,然后加入x-phos(200mg) 和醋酸钯(50mg),加热回流反应2h,检测反应结束,停止加热。加入水和乙酸乙酯萃取,收集有机相,柱层析分离,然后使用乙醇重结晶得到白色固体6.91g,产率88.53%。
[0240][0241]
步骤6:配合物rdp-1的合成
[0242]
取一烧瓶,向其中加入配体rd-1-1(2.05g)和三水合三氯化铱(1.00g),加入30ml 乙二醇乙醚和10ml水,氮气置换,然后搅拌并加热至回流,反应24h后停止加热。反应液冷却
至室温后过滤,滤饼分别用水、乙醇、甲叔醚洗涤3次,收集滤饼,滤饼即为rd-1-1a。将收集到的滤饼加入烧瓶中,然后向其中加入碳酸钾(1.96g)和配体rp-13(5.36g),用30ml二氯甲烷溶解,氮气保护下搅拌18h,检测到反应完成,停止反应,柱层析分离,然后使用乙醇和正己烷打浆,得到红色固体2.55g。
[0243][0244]
化合物1的1h nmr:
[0245]1h nmr(400mhz,氯仿-d)δ8.81(d,j=9.8hz,2h),8.66
–
8.58(m,2h),7.90(d,j= 8.9hz,2h),7.80
–
7.72(m,5h),7.54
–
7.42(m,5h),7.26(dd,j=7.8,1.1hz,2h),6.91
–ꢀ
6.81(m,5h),5.94(s,1h),2.72(p,j=8.3hz,1h),2.57
–
2.36(m,15h),1.85
–
1.58(m,7h), 1.62
–
1.47(m,6h),1.45(dddd,j=9.8,8.4,4.7,2.7hz,1h).
[0246]
2.化合物2:rdp-7的合成
[0247]
步骤1:辅助配体rp-13的合成
[0248]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0249][0250]
按照与化合物1合成中步骤2-5相同的方法(除了将步骤2中的2-氟苯硼酸替换为4
‑ꢀ
氟苯硼酸)合成rd-1-2,得到白色固体5.28g。
[0251][0252]
步骤6:配合物rdp-7的合成
[0253]
按照与化合物1合成中步骤6相同的方法(除了将配体rd-1-1替换为配体rd-1-2),合成rdp-7,得到红色固体2.31g。
[0254][0255]
化合物2的1h nmr:
[0256]1h nmr(400mhz,氯仿-d)δ8.81(d,j=9.8hz,2h),8.61(d,j=9.6hz,2h),8.36(dd, j=9.2,0.7hz,2h),7.99
–
7.88(m,5h),7.50(d,j=8.9hz,2h),7.26(dd,j=9.1,2.8hz, 2h),6.87(dd,j=2.2,1.0hz,2h),6.83(d,j=2.2hz,2h),5.94(s,1h),2.72(p,j=8.3hz, 1h),2.51(p,j=7.6hz,1h),2.42
–
2.35(m,15h),1.85
–
1.40(m,14h).
[0257]
3.化合物3:rdp-19的合成
[0258]
步骤1:辅助配体rp-13的合成
[0259]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0260][0261]
步骤2:中间体ip-10的合成
[0262]
将2-氯-4-碘吡啶-3-甲醛(13.00g)、3,4-二氟苯硼酸(8.44g)和碳酸氢钠(8.17g)加入烧瓶中,加入甲苯(100ml)、乙醇(50ml)和水(50ml),氮气置换后加入四三苯基磷钯(50mg),然后加热回流搅拌4h。反应结束后,加水和乙酸乙酯萃取,收集有机相,柱层析分离得到白色固体11.17g,产率90.60%。
[0263]
步骤3:中间体ip-11的合成
[0264]
取一烧瓶,向其中加入甲氧甲基三苯基氯化磷(17.03g)和甲苯(150ml),冰水浴下分批加入叔丁醇钾(6.50g),加完后继续在冰水浴下搅拌1h,然后滴加用50ml甲苯溶解的中间体ip-10(10.50g),滴加完毕后撤去冰水浴,继续搅拌2h。反应结束后,加水淬灭反应,然后使用水和乙酸乙酯萃取并洗涤多次,收集有机相,有机相柱层析分离得到白色固体9.34g,产率80.09%。
[0265]
步骤4:中间体ip-12的合成
[0266]
取一烧瓶,向其中加入中间体ip-11(9.00g)和二氯甲烷(80ml),氮气置换,然后搅拌下向其中滴加甲磺酸(24.56g),滴加完毕后继续室温下搅拌2h,反应结束后加水淬灭。使用二氯甲烷和水萃取,收集有机相,柱层析分离得到白色固体7.21g,产率90.27%。
[0267]
步骤5:配体rd-1-3的合成
[0268]
取一烧瓶,向其中加入中间体ip-12(7.00g)和3,5-二甲基苯硼酸(5.05g),加入甲苯(50ml)、乙醇(25ml)和水(25ml),氮气置换并搅拌,然后加入x-phos(200mg) 和醋酸钯(50mg),加热回流反应2h,检测反应结束,停止加热。加入水和乙酸乙酯萃取,收集有机相,柱层析分离,然后使用乙醇重结晶得到白色固体7.99g,产率89.23%。
[0269][0270]
步骤6:配合物rdp-19的合成
[0271]
取一烧瓶,向其中加入配体rd-1-3(2.17g)和三水合三氯化铱(1.00g),加入30ml 乙二醇乙醚和10ml水,氮气置换,然后搅拌并加热至回流,反应24h后停止加热。反应液冷却至室温后过滤,滤饼分别用水、乙醇、甲叔醚洗涤3次,收集滤饼。将收集到的滤饼加入烧瓶中,然后向其中加入碳酸钾(1.96g)和配体rp-13(5.36g),用30ml二氯甲烷溶解,氮气保护下搅拌18h,检测到反应完成,停止反应,柱层析分离,然后使用乙醇和正己烷打浆,得到红色固体2.21g。
[0272][0273]
化合物2的1h nmr:
[0274]1h nmr(400mhz,氯仿-d)δ8.84(d,j=9.7hz,2h),8.69
–
8.60(m,2h),8.01(d,j= 0.7hz,2h),7.93(dd,j=8.9,2.2hz,2h),7.90(s,2h),7.75(d,j=2.2hz,2h),7.54
–
7.46 (m,2h),6.87(dd,j=2.1,1.0hz,2h),6.83(d,j=2.2hz,2h),5.94(s,1h),2.72(p,j=8.3 hz,1h),2.57
–
2.36(m,14h),1.85
–
1.39(m,15h).
[0275]
4.化合物4:rdp-28的合成
[0276]
步骤1:辅助配体rp-13的合成
[0277]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0278][0279]
步骤2:中间体ip-13的合成
[0280]
取一烧瓶,向其中加入镁屑(11.34g)和一粒碘,氮气置换后,冰水浴下边搅拌边滴加1-溴-4-氟萘(100.00g)的四氢呋喃(500ml)溶液,滴加完毕后继续在冰水浴下搅拌 30min,然后快速滴加hplc级dmf(35.73g),控制温度不超过30℃,滴加完毕后撤去冰水浴,室温下继续搅拌1h,加水淬灭反应。使用饱和碳酸氢钠溶液和乙酸乙酯萃取,收集有机相,
柱层析分离得到白色固体70.23g,产率90.75%。
[0281]
步骤3:中间体ip-14的合成
[0282]
取一烧瓶,向其中加入中间体ip-13(70.00g)和氨基乙缩醛(64.23g),然后向其中滴入5ml浓盐酸,加热至100℃,搅拌2h,然后加入甲苯旋蒸,重复至少3次,抽干溶剂后得到棕色固体,不经任何处理直接参与下一步反应。
[0283]
步骤4:中间体ip-15的合成
[0284]
向步骤3所得的固体(ip-14)中加入三氟乙酸酐(675.29g),然后搅拌并加热至回流, 12h后停止加热,向所得混合物中加入正己烷,柱层析分离得到白色固体53.81g,产率 67.89%。
[0285]
步骤5:中间体ip-16的合成
[0286]
取一烧瓶,向其中加入中间体ip-15(52.00g)和二氯甲烷(400ml),氮气置换,冰水浴下搅拌并逐滴加入30%的三氯氧磷161.71g。然后向其中缓慢滴加dmf(11.49g),滴加完毕后撤去冰水浴,在室温下继续搅拌18h。反应完成后,加入饱和碳酸氢钠溶液和乙酸乙酯萃取,收集有机相,柱层析分离得到白色固体16.80g,产率27.50%.
[0287]
步骤6:配体rd-3-1的合成
[0288]
取一烧瓶,向其中加入中间体ip-16(10.00g)和3,5-二甲基苯硼酸(7.12g),加入甲苯(50ml)、乙醇(25ml)和水(25ml),氮气置换并搅拌,然后加入x-phos(200mg) 和醋酸钯(50mg),加热回流反应2h,检测反应结束,停止加热。加入水和乙酸乙酯萃取,收集有机相,柱层析分离,然后使用乙醇重结晶得到白色固体11.93g,产率91.70%。
[0289][0290]
步骤7:配合物rdp-28的合成
[0291]
取一烧瓶,向其中加入配体rd-1-3(2.17g)和三水合三氯化铱(1.00g),加入30ml 乙二醇乙醚和10ml水,氮气置换,然后搅拌并加热至回流,反应24h后停止加热。反应液冷却至室温后过滤,滤饼分别用水、乙醇、甲叔醚洗涤3次,收集滤饼。将收集到的滤饼加入烧瓶中,然后向其中加入碳酸钾(1.96g)和配体rp-13(5.36g),用30ml二氯甲烷溶解,氮气保护下搅拌18h,检测到反应完成,停止反应,柱层析分离,然后使用乙醇和正己烷打浆,得到红色固体2.23g。
[0292][0293]
化合物4的1h nmr:
[0294]1h nmr(400mhz,氯仿-d)δ8.75(d,j=10.1hz,2h),8.35(dd,j=7.2,1.8hz,2h), 7.95(dd,j=7.6,1.6hz,2h),7.87(dd,j=10.2,1.9hz,2h),7.70(q,j=1.0hz,2h),7.59
–ꢀ
7.44(m,5h),6.89(dd,j=2.2,1.1hz,2h),6.83(d,j=2.2hz,2h),5.94(s,1h),2.72(p,j= 8.3hz,1h),2.51(p,j=7.6hz,1h),2.39(d,j=4.7hz,13h),1.85
–
1.38(m,16h).
[0295]
5.化合物5.rdp-42的合成
[0296]
步骤1:辅助配体rp-13的合成
[0297]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0298][0299]
步骤2:中间体ip-17的合成
[0300]
取一烧瓶,向其中加入镁屑(9.55g)和一粒碘,氮气置换后,冰水浴下边搅拌边滴加1-溴-4-氟-6-异丙基萘(100.00g)的四氢呋喃(500ml)溶液,滴加完毕后继续在冰水浴下搅拌30min,然后快速滴加hplc级dmf(30.10g),控制温度不超过30℃,滴加完毕后撤去冰水浴,室温下继续搅拌1h,加水淬灭反应。使用饱和碳酸氢钠溶液和乙酸乙酯萃取,收集有机相,柱层析分离得到白色固体68.54g,产率84.67%。
[0301]
步骤3:中间体ip-18的合成
[0302]
取一烧瓶,向其中加入中间体ip-17(65.00g)和氨基乙缩醛(48.04g),然后向其中滴入5ml浓盐酸,加热至100℃,搅拌2h,然后加入甲苯旋蒸,重复至少3次,抽干溶剂后得到棕色固体,不经任何处理直接参与下一步反应。
[0303]
步骤4:中间体ip-19的合成
[0304]
向步骤3所得的固体(ip-18)中加入三氟乙酸酐(505.04g),然后搅拌并加热至回流, 12h后停止加热,向所得混合物中加入正己烷,柱层析分离得到白色固体42.99g,产率72。 52%。
[0305]
步骤5:中间体ip-20的合成
[0306]
取一烧瓶,向其中加入中间体ip-19(40.00g)和二氯甲烷(400ml),氮气置换,冰水浴下搅拌并逐滴加入30%的三氯氧磷161.71g。然后向其中缓慢滴加dmf(7.28g),滴加完毕后撤去冰水浴,在室温下继续搅拌18h。反应完成后,加入饱和碳酸氢钠溶液和乙酸乙酯萃取,收集有机相,柱层析分离得到白色固体12.12g,产率26.49%.
[0307]
步骤6:配体rd-3-2的合成
[0308]
取一烧瓶,向其中加入中间体ip-20(10.00g)和3,5-二甲基苯硼酸(6.03g),加入甲苯(50ml)、乙醇(25ml)和水(25ml),氮气置换并搅拌,然后加入x-phos(200mg) 和醋酸钯(50mg),加热回流反应2h,检测反应结束,停止加热。加入水和乙酸乙酯萃取,收集有机相,柱层析分离,然后使用乙醇重结晶得到白色固体10.87g,产率86.64%。
[0309][0310]
步骤7:配合物rdp-42的合成
[0311]
取一烧瓶,向其中加入配体rd-3-2(2.34g)和三水合三氯化铱(1.00g),加入30ml 乙二醇乙醚和10ml水,氮气置换,然后搅拌并加热至回流,反应24h后停止加热。反应液冷却至室温后过滤,滤饼分别用水、乙醇、甲叔醚洗涤3次,收集滤饼。将收集到的滤饼加入烧瓶中,然后向其中加入碳酸钾(1.96g)和配体rp-13(5.36g),用30ml二氯甲烷溶解,氮气保护下搅拌18h,检测到反应完成,停止反应,柱层析分离,然后使用乙醇和正己烷打浆,得到红色固体2.06g。
[0312][0313]
化合物5的1h nmr:
[0314]1h nmr(400mhz,氯仿-d)δ8.75(d,j=10.1hz,2h),8.06(d,j=8.3hz,2h),7.88 (dd,j=10.1,2.0hz,2h),7.71(q,j=1.0hz,2h),7.49
–
7.43(m,2h),7.31(dd,j=8.4,2.1 hz,2h),6.89(dd,j=2.2,1.1hz,2h),6.83(d,j=2.1hz,2h),5.94(s,1h),3.01
–
2.89(m, 2h),2.72(p,j=8.3hz,1h),2.51(p,j=7.6hz,1h),2.39(d,j=4.7hz,13h),1.85
–
1.39 (m,17h),1.27(d,j=4.6hz,14h).
[0315]
6.化合物6:rdp-21的合成
[0316]
步骤1:辅助配体rp-13的合成
[0317]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0318][0319]
按照与化合物3合成中步骤2-5相同的方法(除了将步骤2中的3,4-二氟苯硼酸替换为2,4-二氟苯硼酸)合成rd-1-4,得到白色固体6.32g
[0320][0321]
按照与化合物1合成中步骤6相同的方法合成rdp-21,得到红色固体2.38g。
[0322][0323]
化合物6的1h nmr:
[0324]1h nmr(400mhz,氯仿-d)δ8.83(d,j=10.0hz,2h),8.60
–
8.52(m,2h),7.69(dd,j=9.1, 2.2hz,2h),7.57(t,j=2.2hz,2h),7.50(dd,j=9.1,0.7hz,2h),7.14(d,j=2.2hz,2h), 6.91
–
6.81(m,5h),5.94(s,1h),2.72(p,j=8.2hz,1h),2.51(p,j=7.6hz,1h),2.42
–
2.35 (m,15h),1.85
–
1.36(m,14h).
[0325]
7.化合物7:rdp-46的合成
[0326]
步骤1:辅助配体rp-13的合成
[0327]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0328][0329]
按照与化合物1合成中步骤2-5相同(除了将步骤2中的2-氟苯硼酸替换为4-氨基苯硼酸)的方法合成rd-1-5,得到淡黄色固体3.28g
[0330][0331]
按照与化合物1合成中步骤6的方法合成rdp-46,得到红色固体0.83g。
[0332][0333][0334]
化合物7的1h nmr:
[0335]1h nmr(400mhz,氯仿-d)δ8.81(d,j=9.7hz,2h),8.53(d,j=9.6hz,2h),8.00(d, j=8.2hz,2h),7.68(dd,j=8.9,2.2hz,2h),7.43(dd,j=8.9,0.7hz,2h),7.11(t,j=2.1 hz,2h),7.00(dd,j=8.2,2.2hz,2h),6.87(dd,j=2.2,1.0hz,2h),6.83(d,j=2.2hz,2h), 5.94(s,1h),4.83(d,j=5.4hz,2h),4.72(d,j=5.4hz,2h),2.72(p,j=8.3hz,1h),2.51(p, j=7.6hz,1h),2.42
–
2.35(m,14h),1.85
–
1.71(m,2h),1.76
–
1.54(m,4h),1.53(ddddd,j =8.7,7.7,5.9,3.2,1.5hz,5h),1.53
–
1.39(m,1h).
[0336]
8.化合物8:rdp-32的合成
[0337]
步骤1:辅助配体rp-13的合成
[0338]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0339][0340]
按照与化合物4合成中步骤2-6相同的方法(除了将步骤2中的1-溴-4-氟萘替换为 1-溴-5-三氟甲基萘),合成rd-3-3,得到白色固体10.90g。
[0341][0342]
按照与化合物1合成中步骤6相同的方法,合成铱配合物rdp-32,得到红色固体 2.71g。
[0343][0344]
化合物8的1h nmr:
[0345]1h nmr(400mhz,氯仿-d)δ8.81
–
8.73(m,2h),8.26
–
8.16(m,5h),8.13
–
8.05(m, 2h),7.94
–
7.86(m,2h),7.70(dd,j=9.0,1.5hz,2h),7.63(dd,j=9.1,6.9hz,2h),6.92
–ꢀ
6.86(m,2h),6.83(d,j=2.2hz,2h),5.94(s,1h),2.72(p,j=8.2hz,1h),2.51(p,j=7.6 hz,1h),2.42
–
2.35(m,14h),1.85
–
1.70(m,3h),1.75
–
1.55(m,4h),1.60
–
1.45(m,7h), 1.50
–
1.36(m,1h).
[0346]
9.化合物9:rdp-47的合成
[0347]
步骤1:辅助配体rp-13的合成
[0348]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0349][0350]
按照与化合物4合成中步骤2-6相同的方法(除了将步骤2中的1-溴-4-氟萘替换为 1-溴-5-甲氧基萘),合成rd-3-4,得到白色固体11.05g。
[0351][0352]
按照与化合物1合成中步骤6相同的方法,合成铱配合物rdp-47,得到红色固体 2.04g。
[0353][0354]
化合物9的1h nmr:
[0355]1h nmr(400mhz,氯仿-d)δ8.77(dd,j=10.0,0.6hz,2h),8.21(dd,j=8.0,1.2hz, 2h),8.16
–
8.08(m,2h),8.08
–
8.00(m,2h),7.83
–
7.76(m,2h),7.40(t,j=7.8hz,2h), 7.02
–
6.95(m,2h),6.92
–
6.85(m,2h),6.83(d,j=2.2hz,2h),5.94(s,1h),3.90(s,6h), 2.71(q,j=8.3hz,1h),2.50(q,j=7.6hz,1h),2.42
–
2.35(m,14h),1.85
–
1.64(m,5h), 1.66(s,0h),1.68
–
1.60(m,1h),1.64
–
1.55(m,1h),1.60
–
1.49(m,6h),1.54
–
1.48(m,1h), 1.53
–
1.36(m,1h).
[0356]
10.化合物10:rdp-48的合成
[0357]
步骤1:辅助配体rp-13的合成
[0358]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0359][0360]
按照与化合物5合成中步骤2-6相同的方法(除了将步骤2中的1-溴-4-氟-6-异丙基萘替换为1-溴-6-异丙基-7-氟萘),合成rd-3-5,得到白色固体11.74g。
[0361][0362]
按照与化合物1合成中步骤6相同的方法,合成铱配合物rdp-48,得到红色固体 2.82g。
[0363][0364]
化合物10的1h nmr:
[0365]1h nmr(400mhz,氯仿-d)δ8.77(d,j=10.0hz,2h),8.28
–
8.20(m,2h),8.09(s, 2h),7.88
–
7.76(m,5h),7.42
–
7.35(m,2h),6.92
–
6.85(m,2h),6.83(d,j=2.3hz,2h), 5.94(s,1h),3.40(heptd,j=4.5,0.7hz,2h),2.71(q,j=8.3hz,1h),2.50(q,j=7.6hz,1h), 2.42
–
2.35(m,13h),1.85
–
1.40(m,15h),1.33(d,j=4.5hz,14h).
[0366]
11.化合物11:rdp-49的合成
[0367]
步骤1:辅助配体rp-13的合成
[0368]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0369][0370]
按照与化合物10合成中步骤2-6相同的方法(除了将步骤2中的1-溴-6-异丙基-7-氟萘替换为1-溴-6-异丙基-7-甲基萘),合成rd-3-6,得到白色固体10.36g。
[0371][0372]
按照与化合物1合成中步骤6相同的方法,合成铱配合物rdp-49,得到红色固体 2.67g。
[0373][0374]
化合物11的1h nmr:
[0375]1h nmr(400mhz,氯仿-d)δ8.81
–
8.73(m,2h),8.17(d,j=1.0hz,2h),8.14
–
8.06 (m,2h),7.81
–
7.72(m,2h),7.70
–
7.62(m,2h),7.27(dd,j=2.2,0.7hz,2h),6.88(dt,j= 1.9,1.0hz,2h),6.83(d,j=2.2hz,2h),5.94(s,1h),3.36(heptd,j=4.2,0.7hz,2h),2.71 (q,j=8.3hz,1h),2.51(p,j=7.6hz,1h),2.43
–
2.35(m,19h),1.85
–
1.40(m,13h),1.51 (s,4h),1.29(d,j=4.1hz,13h).
[0376]
12.化合物12:rdp-50的合成
[0377]
步骤1:辅助配体rp-13的合成
[0378]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0379][0380]
按照与化合物4合成中步骤2-6相同的方法(除了将步骤2中的1-溴-4-氟萘替换为 2-溴-4-三氟甲基萘),合成rd-2-1,得到淡黄色固体5.91g。
[0381][0382]
按照与化合物1合成中步骤6相同的方法,合成铱配合物rdp-50,得到红色固体 2.07g。
[0383][0384][0385]
化合物12的1h nmr:
[0386]1h nmr(400mhz,氯仿-d)δ8.74(s,5h),8.70
–
8.62(m,2h),7.91(dt,j=7.7,1.6hz, 2h),7.75(d,j=1.9hz,2h),7.47
–
7.31(m,5h),6.94(d,j=2.2hz,2h),6.90
–
6.84(m, 2h),5.94(s,1h),2.72(p,j=8.2hz,1h),2.51(p,j=7.6hz,1h),2.42
–
2.35(m,14h),1.85
ꢀ–
1.36(m,14h).
[0387]
13.化合物13:rdp-51的合成
[0388]
步骤1:辅助配体rp-13的合成
[0389]
按照与化合物1合成中步骤1相同的方法合成rp-13。
[0390][0391]
按照与化合物4合成中步骤2-6相同的方法(除了将步骤2中的1-溴-4-氟萘替换为 1-溴-4-甲氧基萘),合成rd-2-2,得到淡黄色固体4.56g。
[0392][0393]
按照与化合物1合成步骤6相同的方法,合成铱配合物rdp-51,得到红色固体2.54g。
[0394][0395]
化合物13的1h nmr:
[0396]1h nmr(400mhz,氯仿-d)δ8.61(d,j=9.8hz,2h),8.40
–
8.32(m,2h),7.96
–
7.85 (m,2h),7.69
–
7.59(m,2h),7.59
–
7.53(m,2h),7.48
–
7.37(m,5h),6.91
–
6.84(m,2h), 6.76
–
6.70(m,2h),5.94(s,1h),4.13(s,6h),2.71(q,j=8.3hz,1h),2.50(q,j=7.6hz, 1h),2.42
–
2.35(m,14h),1.85
–
1.74(m,1h),1.79
–
1.60(m,5h),1.64
–
1.55(m,1h),1.54 (ddddd,j=10.6,8.8,5.0,2.0,1.0hz,7h),1.53
–
1.36(m,1h).
[0397]
14.化合物14:rdp-52的合成
[0398]
步骤1:中间体ip-52的合成
[0399]
将中间体ip-51(20.00g)溶于四氢呋喃(50ml),氮气置换后,冰水浴下滴加甲基锂 (1.60mol/l,178.30ml),滴完后升温至30℃,继续搅拌12h,停止反应。加水和正己烷萃取,蒸干溶剂,得到淡黄色油状液体15.20g,产率82.26%。
[0400][0401]
步骤2:辅助配体rp-19的合成
[0402]
取一单口烧瓶,加入dmf(100ml),然后在搅拌下分批加入叔丁醇钾(21.66g),加热至60℃,然后在氮气保护下滴加ip-52(15.00g),滴加完毕后继续搅拌20min,然后滴加ip-51(24.35g),ip-51滴加完毕后,60℃下继续搅拌30min,停止加热。加水和正己烷萃取并洗涤多次,收集有机相,有机相旋蒸除去溶剂,柱层析分离得到白色固体25.43g,产率88.42%。
[0403][0404]
按照与化合物1合成中步骤2-5的方法合成rd-1-1,得到白色固体10.92g。
[0405][0406]
按照与化合物1合成中步骤6相同的方法,合成铱配合物rdp-52,得到红色固体 3.02g。
[0407][0408]
化合物14的1h nmr:
[0409]1h nmr(400mhz,氯仿-d)δ8.81(d,j=10.0hz,2h),8.62
–
8.54(m,2h),7.90(d,j= 8.9hz,2h),7.80
–
7.72(m,2h),7.54
–
7.43(m,4h),7.26(dd,j=7.8,1.1hz,2h),6.91
–
6.81(m,4h),5.93(s,1h),2.80
–
2.66(m,1h),2.56
–
2.44(m,1h),2.42
–
2.35(m,12h),1.86
ꢀ–
1.37(m,37h).
[0410][0411]
实施例:分别使用化合物1-化合物14制备oled器件,相应的记为实施例1-实施例 14,器件制备步骤如下所述:
[0412]
(1)将透明导电ito玻璃基片110(上面带有阳极120)(中国南玻集团股份有限公司)在商用清洗剂中超声处理,在去离子水中冲洗,再依次经过乙醇、丙酮和去离子水洗净,在洁净环境下烘烤至完全除去水分,用紫外光合臭氧清洗,再用氧等离子处理30秒;
[0413]
(2)把上述带有阳极的玻璃基片置于真空腔内,抽真空,在ito玻璃基片上面蒸镀 hil(10nm)作为空穴注入层130,蒸镀速率为0.1nm/s;
[0414]
(3)在空穴注入层上面蒸镀化合物ht,形成100nm厚的空穴传输层140,蒸镀速率为0.1nm/s,蒸镀eb,形成50nm厚的电子阻挡层150。蒸镀速率为0.1nm/s;
[0415]
(4)在电子阻挡层上蒸镀35nm厚的发光层160,其中,rh为主体发光材料,而以 5%重量比的铱配合物作为磷光掺杂客体材料,蒸镀速率为0.1nm/s;
[0416]
(5)在发光层上蒸镀35nm厚的化合物et:liq(重量比:50:50)作为电子传输层 170。蒸镀速率为0.1nm/s,蒸镀1nm liq为电子注入层180和100nm al作为器件阴极 190。
[0417][0418]
对比例1:与实施例1的区别仅在于,制备器件时,将化合物1替换为ir-1。
[0419]
对比例2:与实施例1的区别仅在于,制备器件时,将化合物1替换为ir-2。
[0420]
用photo research pr650光谱仪测量所制备的器件在10ma/cm2的电流密度下的工作电压、电流效率、cie坐标以及在50ma/cm2电流密度下工作150小时亮度变成初始亮度的衰减比例即lt(150)值,用于表征器件的稳定性。
[0421]
表1
[0422][0423]
通过实施例1-14与对比例1-2的工作电压、电流效率、cie坐标、发光波长以及lt (150)值的数据对比可以看出,异喹啉进一步稠合芳环并且跟含有环烷烃的辅助配体结合在一起,在10ma/cm2的电流密度下的工作电压可以降至3.5v以下,发光效率可提升至20cd/a以上,发光波长有一定红移,并且lt(150)值可达到88以上,提升了器件的稳定性,延长器
件寿命。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1