盐单胞菌及其在联产四氢嘧啶和聚羟基脂肪酸酯的应用的制作方法
1.本发明涉及合成生物技术领域,具体涉及一种盐单胞菌及其在联产四氢嘧啶和聚羟基脂肪酸酯的应用。
背景技术:
2.四氢嘧啶是一种环状氨基酸衍生物,具有亲水性和两性离子特征,是典型的微生物相容溶质之一。它除了可以作为渗透压补偿性溶质平衡细胞内外的渗透压力外,还帮助细胞内的蛋白酶、核酸、生物膜甚至整个细胞对抗高温、冷冻、干燥、氧自由基辐射、尿素等变性剂的有害作用,并且还能够在细胞内协助蛋白质正确组装和折叠,担当分子伴侣的角色。由于四氢嘧啶具有强大的生物大分子(胞外多糖、酶、dna和抗体等)和细胞稳定作用,能够保护细胞免受高渗透压及高温等极端环境的影响,因此在精细化工、环境治理、农业生物技术和生物医学等领域具有良好的应用潜力。
3.最早报道了盐单胞菌内存在天然合成四氢嘧啶的代谢途径。经过几十年的研究,四氢嘧啶的合成途径已在基因水平、酶水平和调控水平上有了较为深入的发展。在四氢嘧啶的所有合成代谢途径中,以赖氨酸生物合成途径中的天冬氨酸半醛(l-aspartate-b-semialdehyde)为前体,依赖于进化高度保守的连锁ectabc基因簇操纵子。结构基因ectb、ecta和ectc分别编码l-二氨基丁酸转氨酶(ectb)、l-二氨基丁酸乙酰转移酶(ecta)和四氢嘧啶合酶(ectc),经3步催化合成四氢嘧啶。
4.本技术发明人利用在进行盐湖淤泥采样后进行宏基因组测序分析,并通过序列比对筛选获得全新序列的ectabc基因簇,相对于传统的ectabc基因簇操纵子,其可以实现一步法催化合成四氢嘧啶,但是在产量方面还有很大的上升空间,发明人对ectabc基因簇进行突变设计,增强了活性,进一步提高了四氢嘧啶的转化效率,从而提高产量。
5.另一方面,聚羟基脂肪酸酯(polyhydroxyalkanoates,pha)是由很多细菌合成的一种胞内聚酯,在生物体内主要是作为碳源和能源的贮藏性物质而存在,它具有类似于合成塑料的物化特性及合成塑料所不具备的生物可降解性、生物相容性、光学活性、压电性、气体相隔性等许多优秀性能。聚羟基脂肪酸酯在可生物降解的包装材料、组织工程材料、缓释材料、电学材料以及医疗材料方面有广阔的应用前景。
6.发明人发现盐单胞菌halomonas sp.yl01内自身存在pha生物合成途径,主要通过乙酰辅酶a途径合成,它由两分子乙酰辅酶a依次经β-酮基硫解酶(phaa),经nadph依赖的乙酰辅酶a还原酶(phab)和phb合成酶(phac)的催化形成聚3-羟基丁酸酯(poly-3-hydroxybutyrate,phb)。然而,虽然含有上述生产pha的代谢通路,但产率很低,限制了其产业化应用。
7.发明人进一步研究发现,在该盐单胞菌株halomonas sp.yl01中,四氢嘧啶在胞外运输效果好,可以达到60%以上,因为这一优势,完全可以考虑同时实现四氢嘧啶和聚羟基脂肪酸酯的联产。因此,发明人考虑直接采用该盐单胞菌株halomonas sp.yl01为底盘菌,联产四氢嘧啶和聚羟基脂肪酸酯,并通过过表达四氢嘧啶合成基因簇以及引入外源phb合
成途径,同时提高这两种产物的收率,从而更好的实现四氢嘧啶和聚羟基脂肪酸酯大规模产业化。
技术实现要素:
8.本发明所要解决的技术问题是提供一种盐单胞菌株halomonas sp.yl01,通过以该菌株为底盘菌,采用分子手段过表达四氢嘧啶合成基因簇以及引入外源phb合成途径,能够实现联产四氢嘧啶和聚羟基脂肪酸酯,并大幅提高两者的产量。
9.基于此,本发明提供一种盐单胞菌株halomonas sp.yl01在联产四氢嘧啶和聚羟基脂肪酸酯中的应用。
10.所述盐单胞菌株halomonas sp.yl01,其保藏于广东省科学院微生物研究所(广东省微生物分析检测中心),保藏日期为2022年4月24日,保藏编号为gdmcc.no62420。
11.所述盐单胞菌株halomonas sp.yl01包含基因簇ectabc,其至少包括3个基因,分别为:
12.ecta基因,核酸序列如seq id no.1所示;
13.ectb基因,核酸序列如seq id no.2所示;
14.ectc基因,核酸序列如seq id no.3所示。
15.本发明提供一种盐单胞菌株halomonas sp.yl01-1,通过在盐单胞菌株halomonas sp.yl01上过表达ectabc基因簇获得。
16.本发明还提供一种盐单胞菌株halomonas sp.yl01-1的制备方法,其包括:
17.第一步,携带基因簇ectabc自杀质粒pre112-ectabc的构建;
18.第二步,自杀质粒pre112-ectabc转化至大肠杆菌s17-1;
19.第三步,接合至底盘菌halomonas sp.yl01,得到ectabc基因簇过表达的菌株,命名为halomonas sp.yl01-1。
20.本发明提供一种盐单胞菌株halomonas sp.yl01-2,通过在底盘盐单胞菌株halomonassp.yl01-1上采用pct540基因异源表达获得。
21.本发明提供一种盐单胞菌株halomonas sp.yl01-2的制备方法,其包括:
22.第一步,自杀质粒pre112-pct540的构建;
23.第二步,自杀质粒pre112-pct540转化至大肠杆菌s17-1;
24.第三步,接合至前述halomonas sp.yl01-1,得到pct540基因异源表达表达的halomonassp.yl01菌株,命名为halomonas sp.yl01-2。
25.本发明还提供一种联产四氢嘧啶及聚羟基脂肪酸酯的方法,其包括:
26.第一步,halomonas sp.yl01-2种子液的制备;
27.第二步,发酵液制备;
28.第三步,发酵培养,联产四氢嘧啶及聚羟基脂肪酸酯。
29.本发明具有的有益技术效果:提供一种盐单胞菌株halomonas sp.yl01,通过以该菌株为底盘菌,采用分子手段过表达四氢嘧啶合成基因簇以及引入外源phb合成途径,能够实现联产四氢嘧啶和聚羟基脂肪酸酯,并大幅提高两者的产量。
附图说明
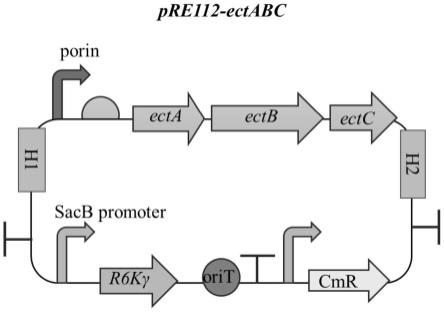
30.图1为实施例1中从青海省盐湖淤泥样获得含有ectabc基因簇的盐单胞菌pcr图;
31.图2为基因簇ectabc的重组表达图谱示意图;
32.图3为大肠杆菌诱导产四氢嘧啶示意图;
33.图4为基因簇ectabc的自杀质粒图谱示意图;
34.图5为基因pct540自杀质粒图谱示意图。
35.生物材料保藏信息
36.yl01,分类命名为halomonas sp.yl01,保藏于广东省科学院微生物研究所(广东省微生物分析检测中心),菌种保藏号为gdmcc.no62420,保藏日期为2022年04月24日,保藏地址为广东省科学院微生物研究所(广东省微生物分析检测中心)
具体实施方式
37.下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
38.下文的公开提供了许多不同的实施例或例子用来实现本发明的不同实施方式。为了简化本发明的公开,下文中对特定实施例或示例进行描述。当然,他们仅仅为示例,并且目的不在于限制本发明。此外,本发明提供的各种特定工艺和材料的例子,本领域普通技术人员可以意识到其他工艺的可应用性和/或其他材料的使用。除非另有说明,本发明的实施将采用本领域技术人员的能力范围之内的化学、分子生物学等领域的传统技术。
39.下面通过说明性的具体实施例对本发明进行描述,这些实施例并不以任何方式限制本发明的范围。特别说明的是:本发明所用到的试剂除特别说明外均有市售。
40.其他需要说明的是,除非另外定义,本发明实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。
41.实验材料和试剂
42.1、重组大肠杆菌dh5α的培养基及批次补料发酵营养物组分
43.(1)lb培养基(g/l):蛋白胨5-20,酵母粉3-10,氯化钠10-30,ph调制6-10,用于重组大肠杆菌jm109的培养;配置平板即需加入1.5-2%的琼脂糖。
44.(2)mm培养基(g/l):葡萄糖10-30,尿素0.5-10,天冬氨酸0-10,酵母粉1-20,无水硫酸镁0.05-0.6,磷酸二氢钾1.5-5.5,氯化钠5-30,fe(iii)-nh
4-citrate 0.05-0.1,cacl2·
2h2o0.02-0.2,znso4·
7h2o 0.1-0.2,mncl2·
4h2o 0.03-0.09,h3bo
3 0.3-1,cocl2·
6h2o 0.2-0.8,cuso4·
5h2o 0.01-0.08,nicl2·
6h2o 0.02-0.1,namoo4·
2h2o 0.03-0.12,用于重组大肠杆菌jm109的发酵。
45.(3)补料ⅰ(g/l):葡萄糖300-1000,尿素20-100,天冬氨酸0-15;补料ⅱ(g/l):葡萄糖500-1000,尿素2-20。
46.2、halomonas sp.yl01的培养基
47.(1)60lb培养基(g/l):蛋白胨5-20,酵母粉3-10,氯化钠60-80,ph调制8-10,用于halomonas sp.yl01的筛分和培养;配置平板即需加入1.5-2%的琼脂糖。
48.实施例1盐单胞菌halomonas sp.yl01的获取
49.取青海省盐湖淤泥样1g后用无菌水连续稀释,涂布于含有nacl(60g/l)的lb平板上,37℃培养48h,待菌落长出后挑取单菌落,继续划线传代培养30d,驯化筛选直至获得纯菌。将得到的纯菌16s rdna扩增、测序以及序列比对后,即获得本发明的盐单胞菌halomonas sp.yl01,生物保藏号为:gdmcc.no62420。随后将其基因组送至广州华大生物公司测序分析,得到一条ectabc基因簇,如图1所示。
50.所述ectabc基因簇包含
51.ecta基因,核酸序列如seq id no.1所示;
52.ectb基因,核酸序列如seq id no.2所示;
53.ectc基因,核酸序列如seq id no.3所示。
54.seq id no.1:ecta
55.atgacaatgaacgcaaccaccgagcccttcacaccctccgccgacctggcacgccccaccgtggcggacgccgtggtcggtcacgaggcctatccgctgttcatccgcaagcccaaccccgatgacggctggggcatctacgagctggtcaagtcctgccccccgctggacgtcaactccgcctatgcctacctgctgctggcgacccagttccgcgacagttgtgccgtggccaccaacgaggagggcgagatcgtcggtttcgtctccggctacgtgaagagcaacgccccggacacctacttcctgtggcaggtggcggtcggcgagaaggcgcgcggcaccggcctggcccggcgcctggtggaagccgtgatgacccgcccggagatggccgaggtccaccacctcgagaccaccatcacccccgacaaccaggcctcctggggcctgttccggcggcttgccgaacgctggcaggcgccgctcaacagccgcgagtacttctccaccgaccagctcggtggcgagcacgacccggaaaacctcgtgcgcatcggccccttccagaccgatcgcatctga
56.seq id no.2:ectb
57.atgcagacccagatcctcgaacgcatggagtccgaagttcggacctattcccgctcctttccggtggtcttcaccaaggcccggaatgcccgtctgaccgacgaggacggccgcgagtacatcgacttcctggccggtgccggcaccctgaactacggccacaacaacccgcacatcaagcaggcgctgctcgactacctggccgaggacaacatcatccatggcctggacttctggaccgccgccaagcgtgactacctcgaggccctcgacgaggtgatcctcaagccgcgcggcctggactacaaggtccagttccctggaccgaccggcaccaatgccgtcgaggcggccatccgcctggcccgcaacgccaagggccgccacaacatcgtcaccttcaccaacggcttccacggcgtgaccatgggggcgctggccaccaccggtaaccgcaagttccgcgaggccacgggcggcgtgcccacggtcggcgggagcttcatgcccttcgacggctacctgggcgagggcgccgacaccctggattacttcgagaagctgctcggcgacaagtccggcggcctggacatcccggcgggggtgatcgtcgagaccgtgcagggcgagggcggtatcaacgtcgctggcctcgactggctcaagcgcctcgagggcatctgccgcgcccatgacatcctgctgatcgtcgacgacatccaggccggctgcggccgcaccggcaagttcttcagcttcgaacacgccgacgtcgttcccgatatcgtcaccaactccaagtcgctctccggcctcggcctgccgttctcccaggtgctgatgcgtcctgaactcgatgtctggaagccgggccagtacaacggcaccttccgcggcttcgcgcttgccttcaccaccgcggccgccgccttgcgccactattggagcgacgacgccctggcccaggacgtggcgcgcaagggcgaggtggtcgccaagcgcttccagaagatcgccggcatgctcggcgaactgggcatcgaggcctccgagcgtggccgcggcctgatgcgcgggatcgacgtgggtagcggtgacatcgccgacaagatcacccacaaggcctttgagaacgggctggtcatcgagaccagcggtcaggacggcgaggtagtcaagtgcctctgcccgctgaccatcaccgatgaggagctggacatgggcctcgatattctcgagaccagcaccaagcaggcgcttagctga
58.seq id no.3:ectc
59.atgatcgttcgcaatctcgatgacgcccgcaagaccgaccgcctggtcaaggccgaaaacggcaactgggacagcacccgcctgagtctggccgatgatggcggcaactgctccttccatatcacgcgtatctacgaaggcaccga
gacccacatccactacaagcatcacttcgaggccgttttctgcatcgaaggcgagggcgaggtggaaaccctggccgacggcaagatctggccgatcaagccgggtgacatctacatcctcgaccagcacgacgagcacctgctgcgcgccagcaagaccatgcacctggcctgcgtgttcacgccgggcctgaccggcaacgaggtgcaccgcgaggatggctcctacgcgccggccgaggccgacgacaagaagccgctctga
60.实施例2基因簇ectabc的重组表达
61.图2给出了基因簇ectabc的重组表达图谱示意图,具体如下:
62.1、halomonas sp.yl01基因组提取
63.将halomonas sp.yl01接种于60lb无抗平板上,37℃,倒置培养24h后,挑选单克隆至5ml 60lb培养液的摇菌管中,37℃、180rpm振荡培养12h;取2ml菌液,按照细菌基因组dna提取试剂盒(购自天根生化科技有限公司)提取halomonas sp.yl01基因组。
64.2、表达载体pseva321骨架及基因簇ectabc序列的pcr扩增
65.根据表达载体pseva321以及基因簇ectabc序列信息,利用snapgene软件(version 8.02)设计引物,引物序列如下:
66.表达载体-f:cccgcgggtg agtaatgata ctagtagcgg ccgctc
67.表达载体-r:tattggcgta ctcatctagt atttcccctc tttctctagt attaaacaaa attatttgt
68.ectabc基因簇-f:gaggggaaat actagatgag tacgccaata acacctttta ccc
69.ectabc基因簇-r:ccgctactag tatcattact cacccgcggg tgc
70.以载体pseva321以及上述1得到的halomonas sp.yl01基因组分别作为模板,反应总体积为50μl,在0.2ml pcr管中依次加入表1所示下列成分:
71.表1
[0072][0073][0074]
混匀后瞬时离心,反应参数为:98℃变性30sec;98℃变性10sec,65℃退火30sec,72℃延伸1.5min,35个循环后72℃终延伸2min。使用通用性dna纯化试剂盒(购自天根生化科技有限公司)回收上述pseva321骨架及基因簇ectabc,操作按产品说明书提供的步骤进行。
[0075]
3、重组表达质粒的构建
[0076]
①
将上述2得到的pseva321骨架及基因簇ectabc连接构建重组表达质粒:通过t4dna ligase(购自new england biolabs)进行连接,反应总体积为20μl,在0.2ml pcr管中依次加入表2所示下列成分:
[0077]
表2
[0078][0079]
混匀后,瞬时离心,16℃下过夜连接,获得连接产物。
[0080]
②
大肠杆菌dh5α化学转化感受态细胞的制备
[0081]
1)使用lb平板培养基,用接种环挑取大肠杆菌(-20℃甘油保藏菌株),在平板上分级划线,于37℃倒置培养14-16h;
[0082]
2)从lb平板上挑取活化的e.coli dh5α单菌落,接种于5ml lb液体培养基中,37℃振荡培养12h;
[0083]
3)将上述培养物以1:100的比例接种于100ml的lb液体培养基中,37℃振荡培养至od
600
=0.5左右,放置冰上停止培养;
[0084]
4)取上述菌液1ml转入1.5ml离心管中,4000rpm,4℃离心10min,弃去上清;之后按competent cell preparation kit(takara公司制备大肠感受态的试剂盒)说明书进行;
[0085]
5)冰上将感受态细胞分装成50μl/管,-80℃保存,获得感受态细胞dh5α。
[0086]
③
连接产物转化大肠感受态细胞dh5α
[0087]
从-80℃冰箱中取上述
②
的感受态细胞dh5α,迅速冰浴解冻。取上述步骤
①
获得连接产物加入大肠杆菌感受态细胞dh5α中,轻轻混匀,冰浴30min,42℃水浴热击90s后,立即冰浴2min,加入0.75ml lb液体培养基,37℃复苏2h。取100μl菌液涂布于含有cm抗性(终浓度为100μg/ml)的lb平板上,37℃倒置培养12~16h。
[0088]
挑取阳性单菌落接种到含有cm抗性(终浓度为100μg/ml)的5ml lb液体培养基中,37℃、180rpm过夜培养,通过菌液pcr验证阳性单菌落和测序分析表明重组质粒构建成功。
[0089]
实施例3发酵生产四氢嘧啶
[0090]
1.种子液制备
[0091]
①
取接种环在超净工作台上将上述重组大肠杆菌dh5α菌株划线至lb平板(cm)上,37℃活化24h,待其长出单克隆;
[0092]
②
挑选上述1中单克隆接种于装有5ml种子培养基(lb)的摇菌管中,37℃,200rpm培养12h;
[0093]
③
取上述2中200μl菌液,接种于装有20ml种子培养基(lb)的150ml锥形瓶中,37℃,200rpm培养12h。
[0094]
2.四氢嘧啶摇瓶发酵生产
[0095]
500ml锥形瓶中加入50ml lb,50μl的氯霉素,用naoh调整ph为7-10,按2.5-5%体积比接入种子液,发酵过程中温度控制在35-38℃,转速控制不高于220rpm,通过改变发酵体系中诱导物的浓度(10-4-10-2
m),发酵培养48h,发酵结束后测量其od、四氢嘧啶及干重(dcm)。
[0096]
从图3可以看出,基因簇ectabc能在四氢嘧啶合成中发挥作用,通过在发酵体系中添加不同浓度的诱导物阿拉伯糖均表明该启动子能正常表达ectabc,当诱导物浓度为10-3
m时,整个菌体的生长,四氢嘧啶的含量以及菌体的干重呈现最佳水平。
[0097]
实施例4过表达基因簇ectabc实现四氢嘧啶增产
[0098]
1、携带基因簇ectabc自杀质粒的构建(pre112-ectabc)
[0099]
表达载体pre112骨架及基因簇ectabc序列的pcr扩增
[0100]
表达载体-f:ggcaccggac gctaaggtga tatagagtgt atcgcgcaaa
[0101]
表达载体-r:gcggtgtgga ggcatgatag tctcgaatct tccgaccaat ga
[0102]
ectabc基因簇-f:
[0103]
agattcgaga ctatcatgcc tccacaccgc tcgtcacatc ctgttgcgtt cactggaatc ccagtataaa gt
[0104]
ectabc基因簇-r:ccgctactag tatcattact cacccgcggg tgc
[0105]
质粒的构建步骤同实施例2。
[0106]
2、自杀质粒pre112-ectabc转化至大肠杆菌s17-1并接合至halomonas sp.yl01
[0107]
①
将本实施例1中构建的质粒使用质粒小提试剂盒(购自天根生化科技有限公司)提取pre112-ectabc,操作按产品说明书提供的步骤进行,提取的质粒放置-20℃保存至转化备用。
[0108]
②
大肠杆菌s17-1化学转化感受态细胞的制备(同实施例2)
[0109]
③
连接产物转化大肠感受态细胞s17-1(同实施例2)
[0110]
挑取阳性单菌落接种到含有cm抗性(终浓度为100μg/ml)的5ml lb液体培养基中,37℃、180rpm过夜培养,通过菌液pcr验证阳性单菌落和测序分析表明重组质粒构建成功。
[0111]
④
接合
[0112]
将供体菌(s17-1)和受体菌(halomonas sp.yl01)分别在带有对应抗性的lb和60lb液体培养基中37℃过夜培养12-14h,按1:100~3:100的体积比分别稀释,培养2-3h至指数前期,分别取1ml培养液置于1.5ml离心管中,5000rpm离心2min,弃去上清液,留100μl上清液重悬菌体,然后混合供体菌和受体菌,滴加在具有抗性的60lb固体培养基上,放入37℃培养箱中正置培养3h左右平板会生长出菌苔。在菌苔上滴加200μl无抗60lb液体培养基,将菌苔涂开,将平板倒置放入37℃培养箱培养48h,长出单克隆。
[0113]
⑤
同源重组
[0114]
将上述
④
中的单克隆继续划线传代培养一周,得到ectabc基因簇过表达的菌株,命名为halomonas sp.yl01-1。
[0115]
将构建好的菌株halomonas sp.yl01-1与菌株halomonas sp.yl01分别在500ml摇瓶及6l发酵罐体系内进行发酵,对比产生的四氢嘧啶及phb含量
[0116]
实施例5过表达菌株halomonas sp.yl01-1和菌株halomonas sp.yl01发酵生产四氢嘧啶和phb
[0117]
(1)halomonas sp.yl01摇瓶种子液制备
[0118]
①
菌种活化
[0119]
于实验室-80℃冰箱取菌种,用枪头挑取菌液划线接种于平板固体培养基(酵母粉5g/l;胰蛋白胨10g/l;氯化钠60g/l,ph为8.5)上,37℃培养24h。
[0120]
②
一级种子培养:
[0121]
挑取单菌落接种于12ml摇菌管(5ml 60lb培养基:酵母粉5g/l;胰蛋白胨10g/l;氯化钠60g/l;ph为8.5)中,将培养液置于摇床37℃、220rpm培养12h。
[0122]
③
二级种子培养:
[0123]
吸取一级菌液(1-2%接种量),接种于150ml锥形瓶(20ml 60lb培养基)中,将置于摇床37℃、220rpm培养12h。
[0124]
(2)halomonas sp.yl01-1摇瓶种子液制备
[0125]
①
菌种活化
[0126]
于实验室-80℃冰箱取菌种,用枪头挑取菌液划线接种于平板固体培养基(酵母粉5g/l;胰蛋白胨10g/l;氯化钠60g/l,ph为8.5,氯霉素1
‰
)上,37℃培养24h。
[0127]
②
一级种子培养:
[0128]
挑取单菌落接种于12ml摇菌管(5ml 60lb培养基:酵母粉5g/l;胰蛋白胨10g/l;氯化钠60g/l;ph为8.5;氯霉素1
‰
)中,将培养液置于摇床37℃、220rpm培养12h。
[0129]
③
二级种子培养:
[0130]
吸取一级菌液(1-2%接种量),接种于150ml锥形瓶(20ml 60lb培养基;氯霉素1
‰
)中,将置于摇床37℃、220rpm培养12h。
[0131]
(3)halomonas sp.yl01发酵罐种子液制备
[0132]
①
菌种活化及一级种子液培养同上(1)
[0133]
②
二级种子液培养:
[0134]
吸取一级菌液(1-2%接种量),接种于500ml锥形瓶(100ml 60lb培养基)中,将置于摇床37℃、220rpm培养12h。
[0135]
(4)halomonas sp.yl01-1发酵罐种子液制备
[0136]
①
菌种活化及一级种子液培养同上(2)
[0137]
②
二级种子液培养:
[0138]
吸取一级菌液(1-2%接种量),接种于500ml锥形瓶(100ml 60lb培养基;氯霉素1
‰
)中,将置于摇床37℃、220rpm培养12h。
[0139]
(5)发酵液准备
[0140]
组分i:mgso
4 10g/l;co(nh2)
2 30g/l;
[0141]
组分ii:kh2po
4 175g/l
[0142]
组分iii:将5g/l fe(iii)-nh
4-citrate和2g/l cacl2·
2h2o取100ml;取10ml溶液(含znso4·
7h2o 0.1g/l;mncl2·
4h2o 0.03g/l;h3bo30.3g/l;cocl2·
6h2o 0.2g/l;cuso4·
5h2o
[0143]
0.01g/l;nicl2·
6h2o 0.02g/l;namoo4·
2h2o 0.03g/l)且加入90ml去离子水混合,最后用5m的naoh调ph值到4.5-5.5
[0144]
底料:氯化钠50g/l;酵母膏1g/l
[0145]
碳源:葡萄糖30g/l
[0146]
(6)发酵培养
[0147]
将种子液按2.5-5%接种于500ml锥形瓶(底料45ml;组分i1ml;组分ii 1ml;组分iii 1ml;葡萄糖1ml;5m的naoh调ph值到8.5-9.5)内,置于摇床37℃、220rpm培养48h。
[0148]
将种子液按2.5-5%接种于6l发酵罐(培养基总体积为3.6l)发酵时间为40-48h。
[0149]
注:含质粒的菌株halomonas sp.yl01-1发酵时需要加入1
‰
氯霉素。
[0150]
(7)四氢嘧啶产品的提取及测定
[0151]
细胞干重(cdw):将15ml发酵后菌液置于50ml离心管中,8000rpm室温下离心6min,去上清液;去离子水水洗两次;冻干机冷冻干燥15小时;称重。
[0152]
四氢嘧啶产品的提取:取发酵后剩余的菌液5ml于50ml离心管中(并加入ddh2o或去离子水将菌液稀释10倍),用高压细胞破碎机破碎细胞后,以12000rpm室温离心10min;将上清液经0.22μm滤膜过滤于存放于液相色谱进样瓶。
[0153]
四氢嘧啶含量测定:用高效液相色谱法(hplc)采用c18色谱柱;流动相为乙腈(a液)和纯水(b液)且a:b=70:30;进样量10μl;流速1ml/min;检测波长210nm。经hplc检测。
[0154]
(8)phb的提取及含量的测定
[0155]
细胞干重(cdw):将15ml发酵后菌液置于50ml离心管中,8000rpm室温下离心6min,去上清液;去离子水水洗两次;冻干机冷冻干燥15小时;称重。
[0156]
测定phb含量:然后在40mg冻干细胞中加入2ml酯化液(包含甲醇、3%(v/v)浓硫酸(98%,w/w)和1g/l苯甲酸)及2ml氯仿,100℃下酯化约4h。phb标品40mg采用同样处理为参照。
[0157]
甲醇分解后,样品在gc-2014气相色谱仪(日本岛津)上测定phb含量。初始温度维持在80℃,1.5min;
[0158]
在第一阶段,温度以30℃/min的速度增加到140℃;
[0159]
在第二阶段,以40℃/min的速度增加到240℃,此过程耗时2min;
[0160]
总的分析时间是8min;
[0161]
注射温度为240℃和检测器温度为250℃
[0162]
(9)发酵结果
[0163]
经不同仪器进行不同产物含量的测定,将结果列于表3中。
[0164]
表3不同发酵体系下四氢嘧啶及phb含量的测定
[0165][0166]
由表3中结果可看出,过表达基因簇ectabc的菌株halomonas sp.yl01-1生产四氢嘧啶的含量显著增大,细胞干重也有一定的提高,但是phb的生产能力有待提高。
[0167]
实施例6pct540基因在halomonas sp.yl01-1菌株中的过表达
[0168]
pct540是来自菌株clostridium propionicum的丙二烯基辅酶a转移酶(pct在v193a进行基因突变及四个核苷酸突变t78c,t669c,a1125g,and t1158c)(choi et al.,2016)。它可以特异性的得到3hb-coa,极大的增大产生phb的含量。
[0169]
自杀质粒pre112-pct540的构建
[0170]
表达载体pre112骨架及pct540序列的pcr扩增
[0171]
表达载体-f:
[0172]
gctggcattg aacacatgcc tccacaccgc tcgtcacatc ctgttgcgtt cactggaatc ccagtatagc at
[0173]
表达载体-r:ctacgcgagc agtaacccct aactcccccc tg
[0174]
pct540-f:atgagaaagg ttcccattat taccgcagat gaggctg
[0175]
pct540
‑‑
r:tcaggacttc atttccttca gacccattaa gccttctgca
[0176]
质粒的构建步骤同实施例2。
[0177]
自杀质粒pre112-pct540转化至大肠杆菌s17-1并接合至halomonas sp.yl01-1(同实施例3),得到pct540基因异源表达表达的halomonas sp.yl01菌株,命名为halomonas sp.yl01-2。
[0178]
实施例7halomonas sp.yl01-1、halomonas sp.yl01-2与halomonas sp.yl01发酵对比
[0179]
(1)种子液的制备
[0180]
同实施例5中。
[0181]
(2)发酵液制备
[0182]
组分i:mgso
4 10g/l;co(nh2)
2 30g/l;
[0183]
组分ii:kh2po
4 175g/l
[0184]
组分iii:将5g/l fe(iii)-nh
4-citrate和2g/l cacl2·
2h2o取100ml;取10ml溶液(含znso4·
7h2o 0.1g/l;mncl2·
4h2o 0.03g/l;h3bo30.3 g/l;cocl2·
6h2o 0.2g/l;cuso4·
5h2o
[0185]
0.01g/l;nicl2·
6h2o 0.02g/l;namoo4·
2h2o 0.03g/l)且加入90ml去离子水混合,最后用5m的naoh调ph值到4.5-5.5
[0186]
底料:氯化钠50g/l;酵母膏1g/l
[0187]
碳源:葡萄糖50g/l
[0188]
(3)发酵培养
[0189]
将种子液按2.5-5%接种于500ml锥形瓶(底料45ml;组分i1ml;组分ii 1ml;组分iii 1ml;葡萄糖3ml;5m的naoh调ph值到8.5-9.5;含质粒的菌株需要加入1
‰
氯霉素)内,置于摇床37℃、220rpm培养48h。
[0190]
(4)四氢嘧啶及phb的提取测定
[0191]
同实施例5中的步骤相同。
[0192]
(5)发酵结果
[0193]
对比在相同培养条件下,不同菌株产生的四氢嘧啶及phb含量列于表2。
[0194]
表2不同菌株发酵结果表
[0195][0196]
通过引入pct540基因显著增大了phb的含量,同时基本四氢嘧啶的产量没有明显降低。
[0197]
实施例8halomonas sp.yl01-2与其他盐单胞菌发酵对比
[0198]
通过上述案例相同技术方案,以不同底盘halononas sp.dsm2581、halomonas sp.td01、halomonas sp.b01经实施例4和实施例6相同分子改造后得到的联产四氢嘧啶和phb的菌株,其代号分别为halononas sp.dsm2581-2、halomonas sp.td01-2、halomonas sp.b01-2。采用实施例7相同培养条件下,不同菌株产生的四氢嘧啶及phb含量列于表3。
[0199]
表3不同菌株发酵结果表
[0200][0201]
通过对不同底盘进行改造,可以看到halomonas sp.yl01-2联产四氢嘧啶以及phb的效果较好,其细胞干重、四氢嘧啶以及phb含量均处于上游水平。
[0202]
所有上述的首要实施这一知识产权,并没有设定限制其他形式的实施这种新产品和/或新方法。本领域技术人员将利用这一重要信息,上述内容修改,以实现类似的执行情
况。但是,所有修改或改造基于本发明新产品属于保留的权利。
[0203]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1