狼疮性肾炎疗效评估用标志物及应用
1.本发明涉及狼疮性肾炎诊断治疗领域,尤其涉及狼疮性肾炎疗效评估用标志物及应用。
背景技术:
2.狼疮性肾炎(ln)是系统性红斑狼疮(sle)最严重的表现之一,影响50~80%的sle患者。尽管采用了先进的免疫抑制疗法,但仍有高达60%的ln患者无法获得完全缓解,而这些患者中有10~20%在10年内发展为终末期肾病(eskd)。即使有精心设计的临床试验,也难以实现新的治疗性策略。这些不令人满意的情况增加了进一步研究疾病进展和个体异质性背后的致病机制的需要。
3.目前关于ln发病机制的知识表明,该疾病涉及多种细胞类型以及免疫和非免疫机制。b细胞可通过分泌直接针对结构细胞的自身抗体诱导肾损伤,而细胞毒性cd8
+ t细胞和cd4
+ t辅助(th)细胞通过直接细胞毒性或促进b细胞分化和活化来驱动肾脏炎症。然而,小鼠研究表明,尽管有ic沉积,但fcγ受体的缺乏或树突状细胞(dc)耗竭会消除ln肾脏中的t细胞活化和白细胞聚集,这意味着先天免疫细胞在人类疾病的免疫发病机制中的关键作用尚未明确。此外,肾结构细胞诸如内皮细胞、足细胞和肾小管上皮细胞被认为不仅是被动的受害者,而且是局部炎症的积极参与者。它们可在炎症状态期间通过免疫原性基因表达和细胞因子产生重塑肾脏微环境。尽管有多种细胞类型被认为与ln有关,并且它们复杂的细胞相互作用的结果与肾损伤程度密切相关,并可能影响ln患者的治疗结果,但它们的确切表型和在疾病进展中的作用仍不清楚。因此,对ln肾脏进行全面、深入的细胞分析,以鉴定出疾病相关联细胞类型,将有助于更好地理解致病机制,并为治疗性决策提供更精确的患者分层。
4.最近的高维转录组学和蛋白质组学分析重新鉴定了人类血液dc,并揭示了2型常规dc(cdc2)谱系中的炎性dc3亚群。这类dc3在sle的血液中累积并与其疾病活动性相关。然而,dc3亚群是否存在于ln患者的肾脏中尚不清楚。
5.另外,单细胞测序可精准剖析样本中的细胞组分,揭示微环境中的细胞类型和不同细胞之间复杂的相互作用关系,既往已有研究通过对肾穿刺样本进行scrnaseq探究了正常情况下固有细胞与免疫细胞的crosstalk,并有scrnaseq解析了ln肾脏免疫细胞及肾小管上皮细胞的功能状态,但是,对ln肾脏微环境的全面解构仍然缺乏,细胞之间如何互作调控免疫网络仍有待探索。
技术实现要素:
6.本发明主要的目的是解决背景技术中存在的问题,为实现该目的,本发明提供以下技术方案:本发明提供了标志物为dc3,所述dc3为 cd1c
+
cd163
+
或cd11c
+
cd163
+
树突细胞,定量检测这些标志物的试剂应用在制备预后评估、诊断或监测肾脏疾病产品中。
7.作为一个具体实施例,所述dc3为 cd88-cd1c
+
cd163
+
树突细胞。
8.作为一个具体实施例,所述dc3为 cd88-cd11c
+
cd163
+
树突细胞。
9.可以理解的是,本发明中定量检测这些标志物是指任何可以检测这些标志物的方法或步骤中所使用的试剂,包括但是不限于对照物,标准品和检测试剂等,也可以理解的是检测这些标志物试剂形成的产品是指市场上一切包含检测该标志物的产品,包括但是不限于试剂盒。
10.在一些具体的实施例中,所述标志物还包括ipt(受损的近端肾小管上皮细胞)、th17、th1、gzmb+或gzmk+活化的细胞毒性t细胞中的一种或多种。
11.作为一些优选的实施例,所述标志物选自以下任一细胞群: dc3、th1和th17组合;dc3和ipt组合;dc3、gzmb+或gzmk+活化的细胞毒性t细胞。
12.作为一种实施方式,所述th1的标记基因为ifng。
13.作为一种实施方式,所述th17的标记基因为il17a。
14.作为一种实施方式,所述ipt的标记基因为sox9和/或vcam1。
15.作为一种区分所述dc3与cdc2的其他亚群及血液中的dc3的方法,可选的,在一些实施例中,可以进一步的检测相对比差异性表达下列标记基因中的一种或者多种:促炎基因、募集t细胞的趋化因子基因、mhc-ii分子、共刺激分子,所述促炎基因包括tnf或il1b;所述募集t细胞的趋化因子基因包括ccl17或ccl22,所述mhc-ii分子包括hla,所述共刺激分子包括cd40、cd80或cd86。
16.作为另一种区分所述dc3与cdc2的其他亚族的方法,可选的,在一些实施例中,进一步检测,相对比成熟过程中上调下列标记基因中的一种或者多种:stat4、relb。
17.在一些实施例中,所述免疫性肾病可选的,为狼疮性肾炎、紫癜性肾炎、iga肾病或anca相关性肾小球肾炎。优选的,所述肾脏疾病为狼疮性肾炎。
18.在各种实施方案中,由于在受试者的样品中表征上述任一所述的标志物,通过鉴定/测量在受试者的样品中的存在/数量/水平/比例,可以给出在所述受试者中身体应答,例如狼疮性肾炎的水平/严重度/程度/负荷/攻击性/疾病阶段/疾病状态的指示,具体的,如在受试者中诊断身体应答和/或疾病,确定在所述受试者中身体应答和/或疾病的预后,和确定在所述受试者中身体应答和/或疾病的改善和/或恶化。
19.具体的,在一些实施方式中,用于预后评估、诊断或监测狼疮性肾炎的方法为,测定在受试者的样品中所述标志物至少一种的数量,其中所述数量与所述受试者中狼疮性肾炎的严重程度呈正相关。应当可以理解的是此处的正相关与负相关是相对于的,而此处所表达的是本发明所提供的标志物是疾病越严重,标志物的数量越多。
20.在一些实施方式中,可选的,通过测定受试者样品中至少一种标志物的数量,当其数量大于源自对照样品的阈值时,判断受试者疾病存在或者病理分级。
21.可选择的,对照样品可以是满足未患有狼疮性肾炎的临床诊断相关标准的样本(如正常人样本)或已经确定患有狼疮性肾炎的样本中的标志物的表达水平的关键值(如中值、最小值、最大值或其倍数值)为阈值,因对照样品的不同,具体应用时,在一些实施例中,当在测试样品中至少一种标志物的数量大于在来自相同受试者的早期样品中的数量时,鉴定出在受试者疾病的恶化,当在测试样品中标志物数量低于在早期样品中的数量时,鉴定出在受试者中疾病的改善。
22.可以理解的是,病理分级可以采用现有国际分级标准,也可以是自定义的某种分级标准,目前优选的,所述病理分级采用2003年国际肾脏病学会和国际病理学学会的分类标准,主要是分为六型,包括ⅰ型指轻微系膜性狼疮肾炎、ⅱ型是系膜增生性狼疮肾炎、ⅲ型是局灶增生性狼疮肾炎、ⅳ型是弥漫增生性狼疮肾炎、
ⅴ
型指膜性狼疮肾炎、ⅵ型指硬化性狼疮肾炎。
23.作为本发明标志物可预期的一种延伸应用,本发明还提供了一种治疗狼疮性肾炎的药物筛选方法,所述方法为在受试者服用药物前后,测试受试者样品中任一所述标志物至少一种的数量,当样品中标志物的数量低于服药前的数量,鉴定出在受试者中疾病的改善,药物有效。
24.另外,本发明还提供了上述狼疮性肾炎标志物的筛选方法,包括以下步骤:(1)对来自ln患者和健康肾脏的肾活检样本进行单细胞rna测序(scrna-seq);(2)用统一流形近似和投影(umap)对所有捕获的细胞进行降维和聚类,并根据特征基因的表达鉴定和注释各个细胞类型,获得在狼疮性肾炎肾脏中比例显著高于健康肾脏样本的细胞群;(3)通过不同细胞与24小时尿蛋白(24h-upro)、估计的肾小球滤过率(egfr)的相关性分析,寻找与24h-upro呈正相关、与egfr呈负相关的细胞类型,筛选获得与疾病严重程度相关的标志细胞;(4)发现cdc2细胞与24h-upro、egfr相关性最强,对cdc2细胞进行进一步无监督亚聚类,获得4个cdc2细胞亚群;(5)根据特征基因的表达,对4个cdc2细胞亚群进行鉴定,当cdc2细胞被确定为cd88-、cd1c
+
和cd163
+
时,将其鉴定为dc3细胞;(6)通过4个cdc2细胞亚群与24h-upro、egfr的相关性分析,寻找与24h-upro呈正相关、与egfr呈负相关的cdc2细胞亚群,筛选获得与疾病严重程度相关的标志细胞dc3。
25.可以理解的是,上述标志物,在预后评估、诊断或监测疾病过程中,在各种实施方案中,测定和/或检测和/或定量是经由标记物细胞分选(例如,磁珠细胞分选、荧光激活细胞分选、流式细胞术、elisa、western印迹法、免疫组织化学、多重免疫组化技术等)来进行的。
26.介于本发明标志物检测过程中,需要使用电子设备来进行分析运算,本发明提供一种计算机可存储介质,所述计算机可读存储介质存储有计算机可执行指令,所述计算机可执行指令用于使计算机执行以下操作:步骤1:获取来自受试者样本中的任一所述的至少一种标志物的数量信息:步骤2:对所述数量或表达水平进行数学关联以获得评分;所述评分用于指示受试者狼疮性肾炎的患病风险或病理分级。
27.作为一种实施方式,本发明还提供了一种计算机,包括处理器和存储器,所述存储器上存储有可在处理器上运行的计算机程序,所述处理器在运行所述计算机程序时实现以下操作:步骤1:获取来自受试者样本中的任一所述的至少一种标志物的数量信息;步骤2:对所述数量进行数学关联以获得评分;所述评分用于指示受试者的狼疮性肾炎的患病风险或病理分级。
28.存储器作为一种非暂态计算机可读存储介质,可用于存储非暂态软件程序以及非暂态性计算机可执行程序,如本技术实施例描述的标志物筛选方法或对受试者的ln风险进行评估。处理器通过运行存储在存储器中的非暂态软件程序以及指令,从而实现上述的标志物筛选方法或对受试者的ln风险进行评估。
29.存储器可以包括存储程序区和存储数据区,其中,存储程序区可存储操作系统、至少一个功能所需要的应用程序;存储数据区可存储执行上述标志物筛选方法。此外,存储器可以包括高速随机存取存储器,还可以包括非暂态存储器,比如至少一个磁盘存储器件、闪存器件、或其他非暂态固态存储器件。在其中一些具体的实施方式中,存储器可选包括相对于处理器远程设置的存储器,这些远程存储器可以通过网络连接至该处理器。上述网络的实例包括但不限于互联网、企业内部网、局域网、移动通信网及其组合。
30.实现上述的标志物筛选方法所需的非暂态软件程序以及指令存储在存储器中,当被一个或者多个处理器执行时,执行上述的标志物筛选方法。
31.以上所描述的计算机实施例仅仅是示意性的,其中作为分离部件说明的单元可以是或者也可以不是物理上分开的,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部模块来实现本实施例方案的目的本领域普通技术人员可以理解,上文中所公开方法中的全部或某些步骤、系统可以被实施为软件、固件、硬件及其适当的组合。某些物理组件或所有物理组件可以被实施为由处理器,如中央处理器、数字信号处理器或微处理器执行的软件,或者被实施为硬件,或者被实施为集成电路,如专用集成电路。这样的软件可以分布在计算机可读介质上,计算机可读介质可以包括计算机存储介质(或非暂时性介质)和通信介质(或暂时性介质)。
32.本发明通过分析了ln患者肾活检组织的单细胞转录组学谱,并将其与器官供体的健康肾脏和患者外周血的转录组学谱进行了比较。鉴定出ln肾脏中dc3亚群的存在,并揭示了与外周血对应物相比,它们具有更高的促炎特征。我们发现,肾脏dc3与疾病严重程度相关,并预测接受6个月诱导疗法的ln患者的治疗效果,表明其在ln中的致病作用。ln肾脏dc3表现出可促进th1和th17活化的转录组学谱。细胞-细胞相互作用分析推断,受损的近端肾小管上皮细胞可募集和粘附dc3,这可进一步加剧肾脏炎症。我们的研究揭示了一个前所未有的参与ln进展的肾脏dc3亚群,这为疾病的发病机制和未来治疗性发展提供了新的见解。
附图说明
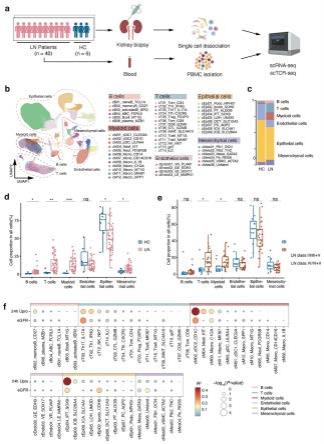
33.图1:hc和ln患者肾脏的研究设计、注释和细胞组成图a、用于处理肾活检和血样的研究和管道的设计。pbmc,外周血单核细胞;b、来自hcs和ln患者肾活检样本的268,942个细胞的umap,其中51个免疫和肾结构细胞亚簇。abc,年龄相关联b细胞;cdc,常规树突状细胞;pdc,浆细胞样树突状细胞;neut,嗜中性粒细胞;mono,单核细胞;macro,巨噬细胞;vr,直小血管;ge,肾小球内皮细胞;ve,小静脉内皮;le,淋巴管内皮;podo,足细胞;ipodo,受损的足细胞;pt,近端肾小管;ipt,近端肾小管损伤;loh,henle的环;dct,远侧肾曲小管;pc,主细胞;ica,a型闰细胞;icb,b型闰细胞;fib,成纤维细胞;afib,活化成纤维细胞;mesa,系膜细胞;pe,周细胞;vsmc,血管平滑肌细胞;c、显示hc和ln患者肾脏中免疫和肾结构细胞比例的条形图。hc,健康对照组;ln,
狼疮性肾炎;d、显示hc(n = 6)和ln患者(n = 40)肾脏中b细胞、t细胞、髓样细胞、内皮细胞、上皮细胞和间充质细胞的比例(相对于细胞总数)的箱线图。配对双侧wilcoxon检验。*p 《0.05,**p 《0.01,***p 《0.001,ns,不显著;e、显示iii/iii+v ln类(n = 11)和iv/iv+v ln类(n = 24)中b细胞、t细胞、髓样细胞、内皮细胞、上皮细胞和间充质细胞比例(相对于细胞总数)的箱线图。配对双侧wilcoxon检验。*p 《0.05,ns,不显著;f、显示ln患者中b、t、髓样、内皮、上皮和间充质亚簇的比例(相对于对应谱系中细胞总数)与24upo和egfr之间的pearson相关性的点图。
34.图2:cdc2亚簇的表征图a、来源于hc和ln患者的肾活检样本的cdc2的umap,有4个亚簇;b、显示标记基因表达的cdc2的umap;c、显示ln患者中每个cdc2亚簇的比例(相对于髓样细胞总数)与24upro和egfr之间的pearson相关性的点图;d、显示了c0_dc3比例(相对于髓样细胞总数)与24upo和egfr之间的pearson相关性的散点图;e、ln肾脏中dc3的门控策略:dc3被定义为活的、单一的、lin(cd3-cd19-cd56-)cd88-hla-dr
+
cd11c
+
cd1c
+
cd163
+
细胞;f、抗cd11c和cd163的ln患者肾活检切片的代表性mihc染色示例,显示肾脏中的dc3。箭头表示特定的细胞类型。原始放大倍数,20倍;比例尺,50 μm。
35.图3:ln肾脏中dc3的表征图a、来源于ln患者的肾活检和外周血样本的dc3的umap,由细胞簇(上)和组织起源(下)预测;b、显示每个cdc2亚簇的炎症反应特征(左)和抗原加工和呈递特征(右)的小提琴图;c、显示与细胞因子、趋化因子、抗原呈递和成熟相关的基因在每个cdc2亚簇中的表达水平的热图;d、显示每个cdc2子簇下tf活动的热图。tf,转录因子;e、显示通过cytotrace分析推断的cdc2亚簇的分化状态的umap;f、显示每个cdc2亚簇的伪时间的umap(上)和小提琴图(下);g、显示了9个功能基因沿图3f中的cdc2轨迹的表达趋势的图;h.显示ln肾脏中富含dc3的途径的点图。
36.图4:dc3对ln患者治疗反应的预测值效果图a、显示完全缓解(cr,n = 11)和非完全缓解(ncr,n = 8)ln患者肾脏中dc3、th1和th17细胞比例的箱线图。非配对双侧wilcoxon检验。cr,完全缓解;ncr,非完全缓解;b、显示独立队列中cr(n = 30)和ncr(n = 30)ln患者肾脏中dc3、th1和th17细胞数目的箱线图。非配对双侧wilcoxon检验;c、用抗cd11c和cd163对肾活检切片进行mihc染色的代表性示例显示了来自独立队列的有cr和ncr的ln患者中的dc3。原始放大倍数,20倍;比例尺,50 μm;
d、棒棒糖图显示了dc3计数、th1和th17细胞计数、人口统计学、临床和病理学特征在伴有cr和ncr的ln患者之间的单变量分析;e、dc3数目、24hupro、wbc、egfr和肾小管坏死的单变量逻辑回归模型的roc曲线。wbc,白细胞计数;f、棒棒糖图显示ln患者cr和ncr之间的多变量分析。
37.图5:ln肾脏中dc3和t细胞之间的相互作用示意图a、显示ln肾脏中cdc2亚簇与cd4
+
和cd8
+ t细胞之间的相互作用的网络。箭头宽度表示两个簇之间的l-r对的总和。l-r,配体受体;b、显示dc3与th1和th17细胞之间特异性相互作用的显著性(-log
10
p-值+10-4
)和强度(表达)的点图;顶部的直方图显示预测的配体-受体对的总计数;c、nichenet的配体-靶矩阵,表示dc3配体由簇ct02_cd4_ifng表达的th1分化途径中涉及的靶基因之间的调节潜力;左侧的热图显示了最能预测th1分化途径中涉及的靶基因的前20个dc3配体;d、nichenet的配体-靶矩阵,表示dc3配体和由簇ct03_cd4_il17a表达的th17分化途径中涉及的靶基因之间的调节潜力;左侧的热图显示了最能预测th17分化途径中涉及的靶基因的前20个dc3配体;e、条形图显示了cd4
+
(上)和cd8
+ t细胞(下)亚型中具有独特克隆型或不同克隆扩增程度的细胞数目。
38.图6:ln肾脏中ipt细胞和dc3之间的相互作用示意图a、来自hc和ln患者肾活检样本的肾结构细胞umap,共19个亚群;b、显示肾结构区室中每个亚簇的比例(相对于肾结构细胞总数)与ln肾脏中dc3的比例(相对髓样细胞总数)之间的pearson相关性的点图;c、显示了pt(cepi03_pt_aldob)和ipt(cepi04_ipt_sox9)细胞中的标记基因表达的小提琴图;d、显示了通过细胞-细胞相互作用分析推断的肾结构区室中每个亚簇与ln肾脏中dc3之间的l-r对总数的热图。l-r,配体受体;e、显示ln肾脏中pt细胞与dc3、ipt细胞和dc3之间特异性相互作用的显著性(-log
10
p值
+
10-4
)和强度(表达)的点图;f、具有抗cd11c、cd163、cd3、slc22a6和vcam1的来自ln患者肾活检切片的代表性mihc染色示例,显示肾小管间质空间中的dc3、ipt和t细胞。白色箭头表示dc3,红色箭头表示ipt细胞。原始放大倍数,20倍;比例尺,50 μm;g、显示pt和ipt细胞中趋化因子相关基因的表达水平的umap;h、dc3迁移测定。通过荧光活化细胞分选(facs)从健康对照的外周血中分离dc3和dc2,并与sle血清处理的hk-2细胞上清液一起培养。流式细胞术计数迁移的dc3和dc2。数据以平均值
±
s.e.m.呈现。非配对双尾t检验。*p 《0.05。
39.图7来源于hc和ln患者肾活检样本的细胞的标记基因表达和分布图a、显示肾脏中主要细胞类型的标准标记表达的umap;b、由样本来源预测的总共51个免疫和肾结构细胞亚簇的umap。hc,健康对照组;ln,狼疮性肾炎。
40.图8 51个免疫和肾结构细胞亚簇的典型基因表达点图。
41.图9 51个免疫和肾结构细胞亚簇在每个样本的细胞比例条形图。
42.图10 ln患者外周血样中cdc2的鉴定情况图a、来源于具有5个亚簇的ln患者的外周血样本的髓样细胞的umap;b、umap显示每个髓样细胞亚簇中的标准标记表达(上),点图显示每个髓样亚簇中其他选定标记基因(下);c、来源于具有2个亚簇的ln患者的外周血样本的cdc2的umap;d、显示cdc2亚簇中标记基因表达的热图。
具体实施方式
43.以下将结合实施例对本技术的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本技术的目的、特征和效果。显然,所描述的实施例只是本技术的一部分实施例,而不是全部实施例,基于本技术的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本技术保护的范围。
44.试验方法中购入商品,品牌标注在试剂名称后的括号内,如中未注明具体条件者,按照常规条件或制造商建议的条件进行,所使用的试剂或仪器未注明生产厂商者,均可以通过市售购买获得的常规产品。
45.除非本文另有定义,否则结合本发明公开使用的的科学和技术术语应具有本领域普通技术人员通常理解的含义,以下描述示例性方法和材料,但是与本文描述的那些类似或者等同的方法和材料也可以用于本公开的实践和测试中。
46.本文使用的以下词语和术语应具有所示出的含义:本文中的
ꢀ“
标志物”是指其水平变化与疾病,特别是肾病的发生和发展具有相关性的化合物和代谢物,换句话说,疾病患者与健康者的样品中标志物水平存在差异,疾病患者在各分期至少有一期与前期之间存在差异,特别是显著差异,标志物可以被例如抗体(或其抗原结合片段)或其他特异性结合蛋白所识别。特异性标志物还可以包括其同种型、前体形式(preform)、成熟形式、变体、其降解形式(例如其片段)及其代谢物。
47.在本文中所使用的术语“受试者”包括患者和非患者。术语“患者”是指罹患或可能罹患医学状况例如炎症或炎性疾病的个体,而“非患者”是指未罹患或可能不会罹患该医学状况的个体。“非患者”包括健康的个体,未患病的个体,和/或没有该医学状况的个体。术语“受试者”包括人和动物。动物包括鼠类等。“鼠类”是指任何来自鼠科(muridae)的哺乳动物,例如小鼠、大鼠等。
48.在本文中所使用的术语“预后评估”、“诊断”或“监测”是指从医学的角度对人们的精神和体质状态做出判断,具体来说是一种确定哪种疾病或病症可以解释受试者的症状和体征的过程,例如,通过测定本文中所公开的标志物水平来确定受试者中肾脏疾病的存在,对肾脏疾病分期,判断肾病的严重程度,确定肾病的具体类型和阶段。
49.如本文所使用的,当可以使用句子中列出的事项中的“至少一种或多种”时使用“或”。当在本文中明确地描述为“在两个值”的“范围内”时,该范围还包括这两个值本身。
50.本文引用的参考文献诸如科学文献、专利和专利申请通过引用并入本文,其程度与具体描述每个文献相同。
51.本文所用,“阈值”是指针对特定变量值确定的值,其中当变化值大于或小于该值时,该值给出某种含义。阈值在此也称为界限值。
52.在本文中,术语“定量检测标志物”与鉴定/测量在受试者的样品中的存在/数量/水平/比例为等同意思。
53.在本文中,术语“ipt”特指受损的近端肾小管上皮细胞;“pt”指近端肾小管上皮细胞。
54.本发明提供的标志物包括dc3与ipt、th17、th1、gzmb+或gzmk+活化的细胞毒性t细胞中的一种或多种,定量检测这些标志物的试剂应用在制备预后评估、诊断或监测免疫性肾病产品中。具体实施中,主要针对的肾脏疾病为狼疮性肾炎(ln)。
55.作为一个具体实施例,标志物为dc3,在肾穿刺活检样本中检测 cd1c
+
cd163
+
的树突细胞,并根据该树突细胞的数量与受试者早期样品,或与未患有该疾病的样品互相关联,以用于ln的诊断、评估、监测等应用。
56.作为另一个具体的实施例,标志物为dc3,在肾穿刺活检样本中检测cd88-cd1c
+
cd163
+
的树突细胞。
57.作为另一个具体的实施例,标志物为dc3,在肾穿刺活检样本中检测cd11c
+
cd163
+
的树突细胞。
58.作为另一个具体的实施例,标志物为dc3,在肾穿刺活检样本中检测cd88-cd11c
+
cd163
+
的树突细胞。
59.作为一个具体的实施例,th1的标记基因为ifng,th17的标记基因为il17a、ipt的标记基因为sox9和/或vcam1。应当可以理解的是,一种细胞在分类时是含有多种标记基因,不同标记基因选择,可以形成的群体分类会形成极大的差别。
60.作为另一些具体的实施例,可选的,标志物可形成包括但不限于以下组合:dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、th1(ifng标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、th17(il17a标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、th1(ifng标记)、th17(il17a标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、ipt(sox9和vcam1标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、ipt(sox9标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、ipt(vcam1标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、gzmb+活化的细胞毒性t细胞;dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、gzmk+活化的细胞毒性t细胞;dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、gzmb+活化的细胞毒性t细胞、gzmk+活化的细胞毒性t细胞;dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、th17(il17a标记)、ipt(sox9标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、th17(il17a标记)、ipt(vcam1标记);dc3(cd1c+cd163+或cd88-cd1c
+
cd163
+
)、th17(il17a标记)、ipt(sox9和vcam1标记);th17(il17a标记)、ipt(sox9标记)等。
61.如上所述,显示了优选的实施方案以便于理解。本发明的范围不限于本文具体描述的实施方案和实施例,并且仅受权利要求的范围限制。下文根据试验过程具体的展示本
发明的实施例。
62.实施例1:ln肾脏中单细胞图谱和疾病相关联细胞群的鉴定为了解构ln肾脏中的微环境并鉴定与疾病相关联的特定细胞类型,我们通过对来自40例ln患者和6例器官供体健康肾脏的肾活检样本进行了单细胞rna测序(scrna-seq),获得了ln肾脏的高分辨率转录组学细胞图谱(图1a)。此外,从7例ln患者中收集外周血样本并进行单细胞rna测序。经过严格的质量控制后,从肾活检样本中获得了总共268, 942个细胞,其中包括75, 643个cd45
+
免疫细胞和193, 299个cd45-肾脏固有细胞,用于后续分析。用统一流形近似和投影(umap)进行的初始细胞聚类和降维基于其典型标记表达鉴定出6个主要细胞区室[1,2],包括b细胞、t细胞、髓样细胞、内皮细胞、上皮细胞和间充质细胞(图1b,图7)。
[0063]
通过对所有细胞进行无监督聚类得到51簇细胞。基于细胞特征基因表达对每簇细胞进行注释(图1b,图8)。每个簇中的细胞均来自多个样本(图9),下文中列举了部分细胞,细胞名称结构为:细胞大群编号-细胞类型名字-代表基因,如cb01_naive_tcl1a,cb01为b细胞编号,naive是指幼稚b细胞,tcl1a为幼稚b细胞的代表基因。具体的,b细胞含有6个簇,包括cb01_naiveb_tcl1a、cb02_memoryb_cd27、cb03_activatedb_ier2、cb04_abc_fcrl5、cb05_bcell_mt1g和cb06_plasma_mzb1。t细胞由14个簇组成,其中5簇为cd4
+ t细胞(ct01_tcm_cd4、ct02_th1_ifng、ct03_th17_il17a、ct04_tfh_cxcr5和ct05_treg_foxp3),4个簇是cd8
+ t细胞(ct06_tcm_cd8、ct07_tem_gzmk、ct08_ctl_gzmb和ct09_mait_slc4a10)、自然杀伤t细胞(ct12_nk_nkt)、γ-δt(ct13_gdt)、先天性淋巴细胞(ct14_ilc)以及具有高表达mt1g(ct10_tcell_mt1g)和mki67(ct11_tcell_mki67)的t细胞。髓样细胞由12个簇组成,包括5个巨噬细胞亚簇(cm08_macro_il1b、cm09_macro_c1qa、cm10_macro_mt1g、cm11_macro_mki67和cm12_macro_spp1)、3个dc亚簇(cm01_cdc1_clec9a、cm02_cdc2_cd1c和cm03_pdc_lilra4)和2个单核细胞亚簇(cm06_mono_cd14和cm07_mono_cd14cd16)、肥大细胞(cm04_mast_kit)和中性粒细胞(cm05_neut_fcgr3b)。在肾结构区室内,我们鉴定了肾小球内皮细胞(cendo01_ge_edh3)、直小血管内皮细胞(cendo02_vr_plvap)、小静脉内皮细胞(cendo03_ve_sox17)和淋巴管内皮细胞(cendo04_le_mmrn1)、近端肾小管上皮细胞(pt)(cepi03_pt_aldob)、henle环上皮细胞(cepi05_loh_umod)和远曲肾小管上皮细胞(cepi06_dct_slc12a3)、足细胞(cepi01_podo_nphs1)、集合管两簇闰细胞(cepi08_ica_slc4a1和cepi09_icb_scl26a4)、集合管主细胞(cepi07_pc_aqp2)、成纤维细胞(cmes01_fib1_dcn和cmes02_fib2_tnc)、周细胞(cmes04_pe_rgs5)、血管平滑肌细胞(cmes05_vsmc_acta2)和系膜细胞(cmes03_mesa_gata3),还检测到高表达损伤和炎症相关基因的足细胞和近端小管上皮细胞,并因此分别被鉴定为受损的足细胞(cepi02_ipodo_cdh6)和受损的pt(ipt)细胞(cepi04_ipt_sox9)。
[0064]
与健康肾脏相比,ln肾脏中b细胞、t细胞、髓样细胞和间充质细胞的比例显著升高,而上皮细胞的比例较低(图1c-d)。此外,t细胞和髓样细胞的比例与疾病严重程度相关,在病理类型为iv/iv+v级ln患者中得分最高(图1e)。我们进一步分析了每种细胞类型与临床参数之间的相关性:th17(ct03_cd4_il17a)细胞、2型常规树突状细胞(cdc2)(cm02_cdc2_cd1c)和ipt细胞(cepi04_ipt_sox9)与24小时尿蛋白(24h-upro)呈正相关,与估计肾小球滤过率(egfr)呈负相关(图1f),表明它们与ln疾病严重程度相关,即th17、cdc2和ipt
细胞比例越高,肾脏病变越严重。值得注意的是,在这些细胞类型中,cdc2与24h-upro和egfr的相关性最强。与此同时,我们还观察到ct02_th1_ifng、cm04_mast_kit细胞比例与24h-upro呈正相关,cepi02_ipodo_cdh6与egfr呈负相关,cm09_macro_c1qa与24h-upro呈负相关且与egfr呈正相关(图1f)。
[0065]
实施例2:ln肾脏中致病性dc3的鉴定cdc2是前哨细胞,在启动和维持适应性免疫反应中发挥关键作用。它们可被细分为表型和功能异质性亚群。因此,我们对cdc2进行了亚聚类,以进一步揭示罪魁祸首。cdc2再进行无监督聚类后产生了四个亚簇(图2a)。经典cdc2标记物,包括cd1c、fcer1a、clec10a,在亚簇c0和c2中表达,而cd163也在c0中显著表达(图2b)。c2和c0的转录谱分别类似于新定义的dc2和dc3亚群,因此被注释为dc2和dc3。相比之下,单核细胞基因c5ar1(cd88)的表达仅限于亚簇c1,以及clec10a和cd1c的表达,表明它们是单核细胞衍生的dc(mo-dc)。在这些cdc2亚簇中,只有dc3的比例同时与24h-upro正相关(r=0.65,p=1.3x10-5
),以及与egfr负相关(r=-0.37,p=0.018)(图2c-d),这说明dc3可能是cdc2参与ln发病的关键成分。通过多重免疫组化(mihc)染色和独立活检样本的流式细胞术表型分析,进一步证实了dc3在ln肾脏中的存在(图2e-f)。我们流式细胞学的门控策略如下:首先圈出活的单个细胞,然后圈出免疫细胞(cd45+),从免疫细胞中圈出髓系细胞(cd3-cd19-cd56-),排除单核细胞(cd88-),圈出经典树突状细胞(cdcs)(cd11c+hla-dr+),再从cdcs中圈出cd1c+的cdc2,最后从cdc2中圈出cd163+的dc3(图2e)。
[0066]
实施例3:ln肾脏中的dc3被活化并高度促炎接下来,我们描述了ln肾脏中dc3的细胞状态和功能属性。将外周血中检测到的cdc2纳入后续分析中,血液cdc2被无偏地分为两个亚簇c4和c5,根据标记基因表达,它们分别被鉴定为血液中的dc2和dc3(图10)。整合来源于ln肾脏和血液的cdc2亚簇并产生总共6个亚簇(图3a)。我们比较了ln肾脏dc3与其他cdc2亚簇的转录组学谱。ln肾脏dc3显示了炎症反应和抗原加工和呈递的总体强信号(图3b)。特别是,它们具有促炎细胞因子基因tnf和il1以及t细胞吸引趋化因子基因ccl17和ccl22的最高表达(图3c)。肾脏dc3还表达了最高水平的与主要组织相容性复合体(mhc)-ii分子(hla-dqa1和hla-dqb1)和共刺激因子(cd40、cd80和cd86)相关联的基因,表明它们具有向t细胞呈递抗原的引发能力。通过分析scenic的调节网络,鉴定出每个cdc2亚簇的转录因子(图3d)。与其他亚簇相比,与dc成熟相关联的转录因子(tf)在活化刺激转导后上调,包括stat4和relb,在肾脏dc3中是活跃的。我们进一步整合了多轨迹计算方法来预测它们的细胞状态。cytotrace推断血液cdc2处于分化程度最低的状态,而肾脏cdc2分化程度更高(图3e)。基于这一观察,我们将血液cdc2视为monocle3生成的轨迹中的根状态,并根据推断的伪时间绘制细胞图,进而预测ln肾脏dc3为终点(图3f)。此外,成熟、mhc-ii分子和促炎基因表达的上调趋势沿着伪时间被证实,这表明ln肾脏中的dc3与它们的血液对应物相比是成熟的、活化的,具有高度促炎作用的(图3g)。与这些发现一致,途径分析显示,t细胞活化在该亚群中最为上调(图3h)。
[0067]
实施例4:肾脏dc3预测ln患者的治疗效果肾脏dc3在疾病严重程度中的临床意义促使我们研究dc3浸润程度是否与ln患者的治疗效果相关联。在本研究中,在肾活检后接受免疫抑制剂联合糖皮质激素诱导疗法的ln患者中,13例患者完全缓解,6例患者未完全缓解。不完全缓解患者中的肾脏dc3比例显著
较高(图4a)。我们还比较了不同缓解组之间th1和th17细胞的比例,因为它们是与疾病严重程度相关的两个其他细胞群,并观察到相同的趋势。然而,当我们通过肾活检石蜡切片的mihc染色在独立ln队列中验证这些发现时,在不完全缓解的患者中,只有dc3显著富集(图4b-c)。为了进一步检验肾脏dc3在治疗效果中的预测能力,首先进行了使用人口统计学特性、临床病理学参数、肾脏中的dc3、th1和th17细胞计数的单变量分析。24h-upro、外周血白细胞计数、血小板计数、肾脏病理中肾小管坏死、mihc染色中th1细胞计数和dc3计数与治疗无效性呈正相关,而egfr与治疗无效性呈负相关(图4d)。此外,对这些变量的受试者操作特性(roc)曲线进行比较,发现dc3计数具有最高的曲线下面积(auc)0.84(图4e)。在多因素logistic回归分析中,仅肾脏中的dc3计数具有统计学差异(图4f)。这些结果强调肾脏dc3是接受诱导疗法的ln患者治疗效果的预测标志,其可用于临床实践中的患者分层。
[0068]
实施例5:ln肾脏中的dc3表现出促进t细胞活化的表达谱。
[0069]
我们下一步的工作是研究肾脏dc3在ln发病机制中的意义。ln肾脏dc3显示与t细胞活化相关联的表达特征。因此,我们应用配体-受体算法来推断dc3和t细胞之间的潜在相互作用。首先计算每个cdc2亚群与cd4
+
和cd8
+ t细胞之间的配体-受体(l-r)对的总数。我们观察到,dc3与cd4
+
和cd8
+ t细胞均具有很强的相互作用可能性(图5a)。关于t细胞亚型,预测dc3主要与th17、th1、gzmk
+
和gzmb
+
活化的细胞毒性t细胞相互作用(图5b)。它们可经由共刺激分子cd86、cd58和cd40(cd86-cd28、cd58-cd2和cd40-cd40lg)以及经由细胞因子肿瘤坏死因子(tnf-tnfrsf1a)和白细胞介素-15(il-15-il-15受体)向t细胞提供活化信号,表明它们在t细胞活化中的关键作用(图5b)。除活化外,dc3还可经由ccl2-ccr2、ccl3-ccr5、cxcl16-cxcr6、ccl17-ccr4和ccl22-ccr6轴募集多种t细胞。
[0070]
人类血液dc3能够在体外极化th1和th17细胞。我们进行了nichenet分析,以探讨dc3对ln肾脏中这些亚型的免疫调节作用。在调节th1细胞的dc3配体中,优先考虑il-1家族细胞因子编码基因il1b和il18(图5c),它们是参与th1分化的细胞因子。相比之下,转化生长因子-β(tgf-β),一种引发th17分化的基本细胞因子,被预测为由dc3在诱导th17特征基因表达时产生的活性配体(图5d)。此外,进行tcr测序以检查不同t细胞亚群之间的克隆扩增程度。在同一患者中共享相同tcr序列的两个或更多t细胞被视为克隆扩增t细胞。在cd4
+ t和cd8
+ t两大群细胞中,cd4+th1和cd8+gzmk
+
细胞毒性t细胞分别表现出最高程度的克隆扩增(图5e)。
[0071]
实施例6:受损的近端肾小管上皮细胞-dc3串扰可导致肾脏炎症值得注意的是,肾结构细胞是协调局部炎症中的积极参与者。通过解剖肾脏中复杂的微环境(图6a),我们发现ipt细胞在肾脏固有细胞中的比例与ln的疾病严重程度显著相关联。有趣的是,ipt细胞的比例也与ln肾脏dc3的比例呈正相关(r=0.44,p=0.0046)(图6b)。与正常pt细胞相比,ipt细胞表达一些文献报道参与炎症的基因,包括ccl2、sox9、cdh6和vcam1(图6c)。因此,我们假设这些ipt细胞可与dc3相互作用以放大ln中的炎症反应。我们的数据显示,基于受体配体对的总数,ipt细胞与dc3的相互作用在所有肾结构细胞亚簇中位居第二(图6d)。互作分析发现,ipt可以通过分泌趋化因子ccl2、cxcl12和cx3cl1经由ccl2-ccr2、cxcl2-cxcr4和cx3cl-cx3cr1轴与dc3相互作用,即可以通过这3条趋化因子轴募集dc3细胞(图6e和6g)。我们进行了趋化性分析,以研究受损肾细胞在体外募集dc3的能力。首先用来自活动性ln患者的血清处理人肾-2(hk-2)细胞以诱导细胞损伤。受损的hk-2
细胞上清液用于来自健康对照外周血中流式分选的cd1c
+
cd163
+ dc3和cd1c
+
cd163-非dc3的体外趋化性测定。迁移细胞的定量显示,与非dc3相比,响应于受损的hk-2上清液的反应,募集了显著增加的dc3(图6h)。
[0072]
此外,我们还发现ipt可以通过粘附分子和dc3相互作用,如ipt表达粘附分子vcam1,与dc3细胞表面的整合素a4b7或a4b1相互作用,增强dc3的粘附。除此之外,ipt还可以通过表达tnc或spp1,作用于dc3的整合素a4b1;ipt通过表达icam1,与dc3的整合素axb2、amb2、alb2相互作用,这种相互作用可增强细胞粘附。ln患者肾活检切片的mihc染色显示dc3聚集并接近ipt细胞(图6f)。这些数据表明,受损的近端肾小管上皮细胞可募集dc3并将其粘附在肾小管间质空间,随后在那里可诱导t细胞应答。
[0073]
论述ln仍然是sle发病率和死亡率的主要原因之一,但其发病机制仍不清楚。在此,本发明通过生成ln肾脏的免疫细胞和非免疫细胞的无偏单细胞转录组学谱,我们发现了患病肾脏中的致病性dc3亚群,并观察到肾dc3是预测ln治疗有效性的宝贵病理学标志,并提出,肾脏dc3是在人类ln发病期间连接肾脏固有细胞ipt和免疫t细胞的桥梁。
[0074]
单细胞转录组分析预示着ln发病机制研究方法的重大突。最近对ln患者肾活检组织的scrna-seq研究揭示了肾脏中免疫细胞和肾小管细胞的景观,重要的是,这些研究揭示了免疫细胞和上皮细胞衍生的干扰素信号在人类ln发病期间发挥了关键作用。这两项研究揭示了人类ln病理学的复杂性和异质性,然而,对ln发病机制的理解仍不明确。在我们目前的研究中,我们使用高通量液滴测序(10x基因组学平台)技术同时对肾活检的免疫细胞和结构细胞进行测序,从而能够对ln肾脏中的微环境和细胞间通信进行全局表征。我们鉴定出ln患者中的肾脏dc3亚群,并提出了一种dc3介导的ln发病机制的炎症网络的新型范式:(i)受损的近端上皮细胞上调ln肾脏中促炎细胞因子和趋化因子,诸如ccl2、cxcl12、cx3cl1;(ii)这些受损的上皮细胞促进血液dc3向肾脏的募集;(iii)肾脏dc3被重新编程并变成促炎性的以活化适应性t细胞应答;(iv)扩增的免疫细胞浸润进一步损害肾结构细胞,包括肾小管上皮细胞。上述ipt-dc3-t细胞通信将建立正反馈回路,进一步加重组织损伤并使肾脏炎症长期存在。我们认为,我们的数据可最好地解释为肾脏dc3作为连接肾实质损伤和适应性免疫细胞浸润的桥梁,这可代表人类ln发病机制的新型疾病范式,并可能为治疗性开发开辟新途径。
[0075]
dc3代表首次在健康人类血液中发现的cdc2谱系的亚群[3]。在狼疮患者中,血液dc3通过上调细胞因子-趋化因子相关转录物而变成促炎因子[4]。使用scrna-seq、流式细胞术和mihc染色方法,我们报道了ln患者中肾脏dc3的存在。与ln中的血液dc3相比,肾脏dc3中mhc-ii和共刺激分子的上调表达指示它们的成熟和活化状态,表明它们获得了局部激活组织内t细胞的能力。th1和th17亚型在ln病理学中起关键作用,并与疾病进展相关。值得注意的是,肾脏dc3显示了tnf、il1b、ccl17和ccl22的显著特征,表明它们可能是驱动组织损伤并促进t细胞运输的炎性细胞因子和趋化因子的有效产生者。事实上,我们的细胞-细胞相互作用分析显示,ln肾脏dc3与th1和th17细胞强烈相互作用,并可能分别经由il-1b和tgf-β诱导th1和th17反应。肾脏dc3的这些转录特征突出了dc3在放大炎症方面的多种潜力。
[0076]
诱导治疗不能达到完全缓解与ln患者的肾预后不良相关。事实上,在初始阶段对
标准免疫抑制方案无反应的高风险患者进行分层是非常值得关注的。一些临床病理学特征或生物标记物已被提出与ln中的治疗反应相关联,诸如尿蛋白肌酐比(尿蛋白/肌酐比值的全称是尿蛋白/肌酐比值测定,是用于监测尿蛋白排出情况的一种新的可靠方法)、狼疮肾炎慢性指数评分和尿tgf-β,但这些候选物均不能作为独立的预测标记物[5-7]。我们的数据显示,肾脏dc3对ln的治疗反应具有最佳预测价值,优于传统临床病理学参数和ln肾脏中的疾病相关联t细胞亚型th1和th17细胞。这些结果提供了证据,证明肾脏dc3可为鉴定可对免疫抑制剂有反应或无反应的ln患者的有效标记物,如果这一观察结果在大量临床研究队列中得到进一步验证,则它可用于患者分层,指导临床实践中的个性化治疗修改。
[0077]
试验方法样本采集肾活检样本收集自在五个临床中心接受诊断性肾活检的ln患者。有两个独立的队列;一个是儿童ln的随机对照试验(chictr2100053545),而另一个是成人ln的前瞻性队列。正常人肾组织从供肾移植前肾穿刺活检获得。该研究得到了中山大学附属第一医院机构审查委员会的批准,并获得了所有患者的知情同意。
[0078]
将所有肾活检样本在采集后置于macs
®
组织储存溶液(miltenyi biotec)中,并在2至3小时内新鲜处理用于测序。
[0079]
组织加工和单细胞解离(参考:文献arazi, a., et al., the immune cell landscape in kidneys of patients with lupus nephritis. nat immunol, 2019. 20(7): p. 902-914. +联川生物公司提供的方法;)新鲜肾活检标本切片约1 mm3,并在消化前用磷酸盐缓冲盐水(pbs,gibco)洗涤2至3次。将切片和洗涤后的样本放入5 ml离心管中,用多组织解离试剂盒(miltenyi biotec)的2.5 ml消化酶溶液消化,并在振动筛(125 r.p.m)上于37℃下孵育30分钟,用3 ml移液管每10分钟上下吸取悬浮液5至10次,以促进细胞解离。消化后,所得单细胞悬浮液通过30 μm macs
®
智能过滤器(miltenyi biotec)过滤,残余组织用pbs(gibco)洗涤2至3次,并且悬浮液也过滤,将两种悬浮液收集在15 ml锥形管中,于4℃下以400 g离心6分钟。沉淀物用200 μl pbs(gibco)再悬浮,并与2 ml红细胞(rbc)裂解缓冲液(ebioscience
™ꢀ
10x rbc裂解缓冲液)于4℃下孵育5分钟。rbc裂解后,悬浮液以400 g于4℃下离心6分钟,沉淀物用rpmi-1640培养基(invitrogen)再悬浮以进行进一步操作。使用双荧光ao/pi方法,通过自动细胞计数器(countstar rigel)对产生的单细胞进行定量和生存力分析。通过这种方法产生的单细胞悬液的存活力大于80%。
[0080]
外周血单核细胞的分离(参考:密度梯度离心法分离人外周血单个核细胞)血样首先用pbs(gibco)稀释至1:2,然后在50 ml锥形管中用15 ml ficoll-paque小心分层,并于室温下以1800 r.p.m离心30分钟并制动。离心后,抽吸外周血单核细胞(pbmc)层并用pbc(gibco)洗涤两次。
[0081]
多重免疫组织化学染色(染色参考:ihc一抗染色方法+pano试剂盒提供的染色方法;病理切片扫描和分析参考:tissuegnostics公司提供的扫描仪及分析软件)根据制造商的方案,使用pano 7-plex ihc试剂盒(panovue)对4至5 μm福尔马林固定的石蜡包埋(ffpe)肾活检切片进行多重免疫组织化学(mihc)染色。载玻片在二甲苯中脱蜡,并用100%、95%、75%乙醇和双蒸馏水再水合。通过柠檬酸盐缓冲液(ph 6.0)回收抗原,
并在微波中加热至沸腾约20分钟,然后于室温下用5%牛血清白蛋白(bsa)封闭切片10分钟。依次应用抗cd163(abcam,ab182422)、抗cd11c(abcam,ab52632)和抗cd4(abcam,ab133616)、抗slc22a6(abcam,ab135924)、抗vcam1(abcam,ab134047)抗体。一级抗体于37℃下孵育30分钟,与辣根过氧化物酶结合的二级抗体于室温下孵育10分钟。用1:200的5% bsa双荧光团opal 520、540、570、620和650进行酪酰胺信号扩增,并于室温下孵育10分钟。一级抗体染色后,用dapi对细胞核进行染色。使用tissuefaxs平台(tissuegnostics)扫描染色载玻片,并使用strataquest软件(tissue gnostics)处理图像。
[0082]
采用抗体:抗体品牌货号克隆号抗cd11cabcamab52632ep1347y抗cd163abcamab182422epr19518抗cd4abcamab133616epr6855抗slc22a6abcamab135924/抗vcam1abcamab134047epr5047mihc染色切片上的细胞定量(参考:tissuegnostics公司提供的扫描仪及分析软件)根据“多重免疫组织化学染色”中描述的程序对肾活检切片进行mihc染色。应用的抗体为抗cd163(abcam,ab182422)、抗cd11c(abcam、ab52632)、抗cd4(abcam和ab133616)、抗ifng(abcam-ab231036)和抗il17((r&d系统,af-317-na)。用strataquest软件(tissuegnostics)进行细胞定量分析。计算整个载玻片中dc3(cd11c
+
cd163
+
)、th1(cd4
+
ifng
+
)和th17细胞(cd4
+
il17
+
)的总数。
[0083]
流式细胞术(参考:bd-biosciences公司提供的染色方案)根据“组织处理”中描述的程序制备单细胞悬浮液。对于表面染色,将在pbs(gibco)染色缓冲液中的2%胎牛血清(fbs)中稀释的选定抗体添加到细胞中,并于室温下孵育20分钟。对于细胞因子的胞浆内染色,首先将细胞与含有bd golgiplug
™
(bd biosciences)的白细胞活化混合物于37℃下孵育4-6小时。然后将细胞固定并用bd cytofix/cytoperm ((bd-biosciences)于4℃下渗透20分钟。将在bd perm/washtm(bd-biosciences)中稀释的抗体添加到细胞中,并于4℃下孵育60分钟。染色后,洗涤细胞并用200 μl 1%多聚甲醛(pfa)溶液固定。使用spectroflo(cytek)对aurora/nl进行流式细胞术,并使用flowjo(tree star,版本10.4.0)分析数据。
[0084]
采用抗体:抗体通道品牌货号克隆号fvsaf700bd564997/cd45buv395bd563792hi30cd3bv510bd564713hit3acd19bv510bd562947sj25c1cd56bv711bd563169ncam16.2cd11capc-cy7bdcustom624355b-ly6hla-drbuv805bd748338g46-6
cd1cpe-cy7biolegend331516l161cd163bv421bd562643ghi/61cd88bv786bd742320d53-1473文库制备和scrna-seq(由联川公司进行测序和文库制备)使用chromium next gem单细胞5’试剂盒v2(10x基因组学)按照制造商的方案进行乳液中凝胶珠的生成和条形码、cdna扩增、5’基因表达文库构建、cdna的v(d)j扩增和v(d)j文库构建。用生物分析仪高灵敏度芯片(agilent)对构建的v(d)j富集和5’基因表达文库进行定量和评估。两个库均包含标准illumina配对末端构建体,以p5开始,以p7结束,并且包括在读段1开始时编码的16 bp 10x条形码。样本索引序列作为i7索引读段并入。最终文库在novaseq 6000(illumina)上测序,具有150 bp配对末端读段。
[0085]
scrna-seq数据的质量控制(使用10x genomics提供的cell ranger单细胞软件分析)使用由10x genomics提供的cell ranger单细胞软件套件(v5.0.1)对原始scrna-seq数据进行预处理,用于解复用细胞条形码、读段比对和在grch38人类参考基因组下生成基因-细胞矩阵。seurat r软件包(v4.0.5)生成并评估了详细的qc指标。在少于3个细胞中检测到的基因和其中检测到的转录物少于200或多于8000个基因,或大于70%的umi来源于线粒体基因或log
10
基因计数/log
10 umi计数》 0.80的细胞被滤出,并从后续分析中排除。由于免疫细胞和肾驻留细胞之间线粒体含量的差异,umi < 15%来源于线粒体基因的免疫细胞、umi < 30%来源于粒线基因的肾驻留细胞(近端肾小管细胞除外)被纳入进一步分析。对于主要细胞类型的亚聚类,检测到的基因小于500的细胞被进一步去除,但髓样细胞除外,其中检测到的基因《 200的截止值被保留,以避免去除中性粒细胞。通过簇标记基因表达鉴定双倍体:一个簇的细胞表达来自两个或多个不同细胞谱系的标记(例如ptprc和epcam、cd3d和cd79a)。我们仔细审查了典型标记基因的表达,并重复了上述步骤几次,以确保我们已经去除了与细胞双倍体相关联的大多数条形码。然后我们去除了细胞质基因,诸如线粒体、核糖体和血红蛋白基因。
[0086]
细胞聚类和注释(使用seurat r包进行数据分析,并参考文献进行注释)在去除劣质细胞和双倍体后,seurat r包(v4.0.5)应用于基因计数矩阵归一化、缩放和具有默认参数的高度可变基因鉴定。主成分(pc)由elbowplot函数鉴定。前2000个可变基因和前25个pc用于非监督聚类分析,分辨率设定为0.1。我们基于典型细胞类型特异性标记物鉴定出六种主要细胞类型,包括t细胞(cd3e)、髓样细胞(lyz)、b细胞(cd79a)、肾上皮细胞(epcam)、内皮细胞(pecam1)和间充质细胞(pdgfrb)。使用适当调整的参数对每个主要细胞类型进行第二轮亚聚类,以鉴定出主要细胞类型内的亚簇和细胞亚型注释(补充表2)。为了可视化,使用具有seurat的runumap函数的umap方法降低维数。经由findallmarkers函数鉴定簇特异性标记基因,这些标准如下:1)only.pos = true,2)min.pct = 0.25,3)log fc 》 0.25。
[0087]
基因集和通路分析(使用seurat r包和clusterprofiler r软件包分析)从分子特征数据库(msigdb v6.2, https://www.gsea-msigdb.org/gsea/msigdb/index.jsp)。使用seurat中的addmodulescore函数计算每个细胞的基因集得分。
[0088]
基于每个细胞簇的簇特异性标记基因,用clusterprofiler r软件包
(v4.3.0.991)进行基因本体(go)生物过程富集分析。显著的go项被鉴定为p值《 0.05。
[0089]
scenic分析(参考:方法学文献aibar, s., et al., scenic: single-cell regulatory network inference and clustering. nat methods, 2017. 14(11): p. 1083-1086.)使用scenic,以原始计数矩阵作为输入,分析每个cdc2亚簇中的活化调节子。共表达网络由grnboost2计算,调节子由rcistarget鉴定。每个细胞的调节子活性由aucell评分。双尾wilcoxon秩和检验用于鉴定每个cdc2亚簇中的差异活化调节子,并以来自其他亚簇的细胞作为对照。然后使用benjamini-hochberg程序校正多重假设。
[0090]
单细胞轨迹推断(参考:方法学文献gulati, g.s., et al., single-cell transcriptional diversity is a hallmark of developmental potential. science, 2020. 367(6476): p. 405-411;trapnell, c., et al., the dynamics and regulators of cell fate decisions are revealed by pseudotemporal ordering of single cells. nat biotechnol, 2014. 32(4): p. 381-386.)为了描述cdc2的发展过程,我们应用了具有默认参数的monocle 3算法。在降维和细胞排序后,使用monocle 3的缺省参数推断cdc2细胞的分化轨迹。
[0091]
我们还使用了cytotrace算法,该算法基于转录多样性在分化期间减少的假设,从scrna-seq数据预测分化状态。使用默认参数进行细胞示踪,以补充monocle 3算法推断的轨迹。
[0092]
细胞间相互作用分析(参考:方法学文献efremova, m., et al., cellphonedb: inferring cell-cell communication from combined expression of multi-subunit ligand-receptor complexes. nat protoc, 2020. 15(4): p. 1484-1506.)使用cellphonedb算法(https://www.cellphonedb.org/)推断dc3和其他细胞之间的细胞间相互作用。简而言之,该算法允许使用如前所述的统计框架检测scrna-seq数据中细胞类型之间的配体-受体相互作用。通过细胞类型1中的基因1和细胞类型2中的基因2的平均表达计算表达,然后归一化到相同的尺度。基于置换试验计算两种细胞亚型之间配体-受体相互作用的显著性。我们提取了p值《 0.05且表达细胞比例》 10%的配体-受体对作为显著相互作用。
[0093]
nichenet分析(参考:方法学文献browaeys, r., w. saelens, and y. saeys, nichenet: modeling intercellular communication by linking ligands to target genes. nat methods, 2020. 17(2): p. 159
‑ꢀ
162.)nichenet,一种预测驱动靶细胞转录组变化的配体的工具,被用来推断驱动t细胞分化的dc3的潜在配体。在dc3中,所有在其细胞簇内至少10%的细胞中具有非零值的表达基因被用作基因背景。分别下载来自kegg数据库的th1和th17分化基因集(th17细胞分化:hsa04659,th1/th2细胞分化:hsa04658)。配体活性分别使用th1和th17分化基因集评估。dc3配体与th1/th17分化基因之间的潜在调节相互作用是通过th1/th17中靶向th1/th17分化基因的表达受体构建的。
[0094]
单细胞t细胞受体(tcr)分析(参考:方法学文献borcherding, n., n.l. bormann, and g. kraus, screpertoire: an r-based toolkit for single-cell immune receptor analysis. f1000res, 2020. 9: p. 47.)
tcr库是通过运行10x genomics cellranger vdj管道(https://support.10xgenomics.com/single-cell-vdj/software/pipelines/latest/using/vdj)生成的。在获得过滤器重叠输出后,使用screpertoire软件包(v1.3.2)中的quantcontig函数结合cdr3核苷酸序列和vdjc基因鉴定tcr克隆型。克隆的大小根据具有相同tcr序列的细胞数目进行分选,包括大细胞(20至100个细胞)、中细胞(5至20个细胞)、小细胞(1至5个细胞)和单细胞(仅1个细胞)。
[0095]
统计分析除上述用于scrna-seq数据分析的生物信息学方法外,所有其他统计分析均使用统计软件r v4.0进行。使用非配对双尾wilcoxon秩和检验分析两组的细胞比例。双尾student t检验用于基因表达或apc评分的比较。进行pearson相关分析以评估两个连续变量之间的关系(例如,细胞比例与临床病理学表型)。使用ibm spss 26.0软件,使用单变量和多变量逻辑回归分析预测治疗效果的独立变量。auc曲线由jmp pro 16.0软件生成。结果在p值《 0.05时具有统计学意义。
[0096]
本文中“[
ꢀꢀ
]”内的数字表征引用的参考文献,具体本文中涉及的参考文献如下:1、arazi, a., et al., the immune cell landscape in kidneys of patients with lupus nephritis.nat immunol, 2019. 20(7): p. 902-914.2、stewart, b.j., et al., spatiotemporal immune zonation of the human kidney. science, 2019. 365(6460): p. 1461-1466.3、villani, a.c., et al., single-cell rna-seq reveals new types of human blood dendritic cells, monocytes, and progenitors. science, 2017. 356(6335).4、dutertre, c.a., et al., single-cell analysis of human mononuclear phagocytes reveals subset-defining markers and identifies circulating inflammatory dendritic cells. immunity, 2019. 51(3): p. 573-589 e8.5、helget, l.n., et al., development of a lupus nephritis suboptimal response prediction tool using renal histopathological and clinical laboratory variables at the time of diagnosis. lupus sci med, 2021. 8(1).6、hachiya, a., et al., the isn/rps 2016 classification predicts renal prognosis in patients with first-onset class iii/iv lupus nephritis. sci rep, 2021. 11(1): p. 1525.7、avihingsanon, y., et al., measurement of urinary chemokine and growth factor messenger rnas: a noninvasive monitoring in lupus nephritis. kidney int, 2006. 69(4): p. 747-53.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1