贝前列素钠中间体及其制备方法与流程
本发明属于药物化学领域,涉及贝前列素钠的制备方法,具体涉及贝前列素钠中间体及其制备方法。
背景技术:
1、贝前列素钠(商品名dorner)属于前列环素衍生物,化学名称为(±)-2,3,3a,8b-四氢-2-羟基-1-(3-羟基-4-甲基-1-辛烯-6-炔基)-1h-环戊并[b]苯并呋喃-5-丁酸钠,是由日本toray industries,inc.开发的抗血小板药物。
2、贝前列素是第一个生物学稳定具有口服活性的前列环素类似物,1992年贝前列素(beraprost)获得日本批准作为慢性动脉闭塞的药物在日本上市。贝前列素以外消旋体的形式用于治疗肺动脉高血压(pah)已被美国fda批准进入ⅱ期临床,2007年toray和astellas公司(前yamanouchi公司)的贝前列素钠缓释片(careload la)在日本获批用于治疗pah,成为前列环素类药物中第1个缓释剂。贝前列素钠是前列环素(pgi2)的衍生物,是花生四烯酸在体内代谢的最终产物,具有强力抑制血小板凝集和血管扩张的作用。
3、内源性pgi2主要由血管内皮细胞合成,是花生四烯酸(aa)的代谢产物。aa通过环氧酶(cox-1或cox-2)代谢成不稳定的前列腺素h2(pgh2)。pgh2是5种主要前列腺素的共同前体,包括血栓素a2(txa2)、前列腺素d2(pgd2)、前列腺素e2(pge2),pgi2和前列腺素f2a(pgf2a)。pgi2性质不稳定,经静脉注射后血浆半衰期短,约2min。pgi2与前列环素膜(ip)受体特异性结合。ip受体在血管、白细胞和血小板中均表达丰富,能被前列腺素迅速激活。ip受体与gs蛋白偶联并激活腺苷酸环化酶(ac),导致环磷酸腺苷(camp)水平升高,肺血管平滑肌舒张并抑制平滑肌增殖,促使内皮细胞释放一氧化氮(no)。no可促进pgi2生成增加,发挥其主要生物学效应。某些特定情况下,ip受体也可能与gq蛋白偶联,激活血管收缩通路。然而,前列环素并不仅仅选择ip受体,还可能激活位于细胞表面以及细胞核内的前列腺素e受体(ep),以及位于核内的过氧化物酶体增殖物激活受体(ppar)。pgi2还具有强大的抗炎症、抗血小板聚集、抑制肺纤维细胞产生胶原的作用。
4、贝前列素钠是一种外源性的前列环素类似物,与内源性前列环素结构相似,空腹吸收迅速,化学性质稳定,30min后达峰浓度,清除半衰期约35~40min。贝前列素钠与ip受体特异性结合,提高胞浆内camp浓度,抑制ca2+从胞内释放,发挥舒张血管平滑肌、抑制血小板聚集、抑制细胞增殖及炎症反应并保护血管内皮细胞的作用,从而抵抗tax2引起的缩血管效应,最终舒张肺小动脉,降低肺动脉压力并抑制肺动脉血管重构和原位血栓形成。
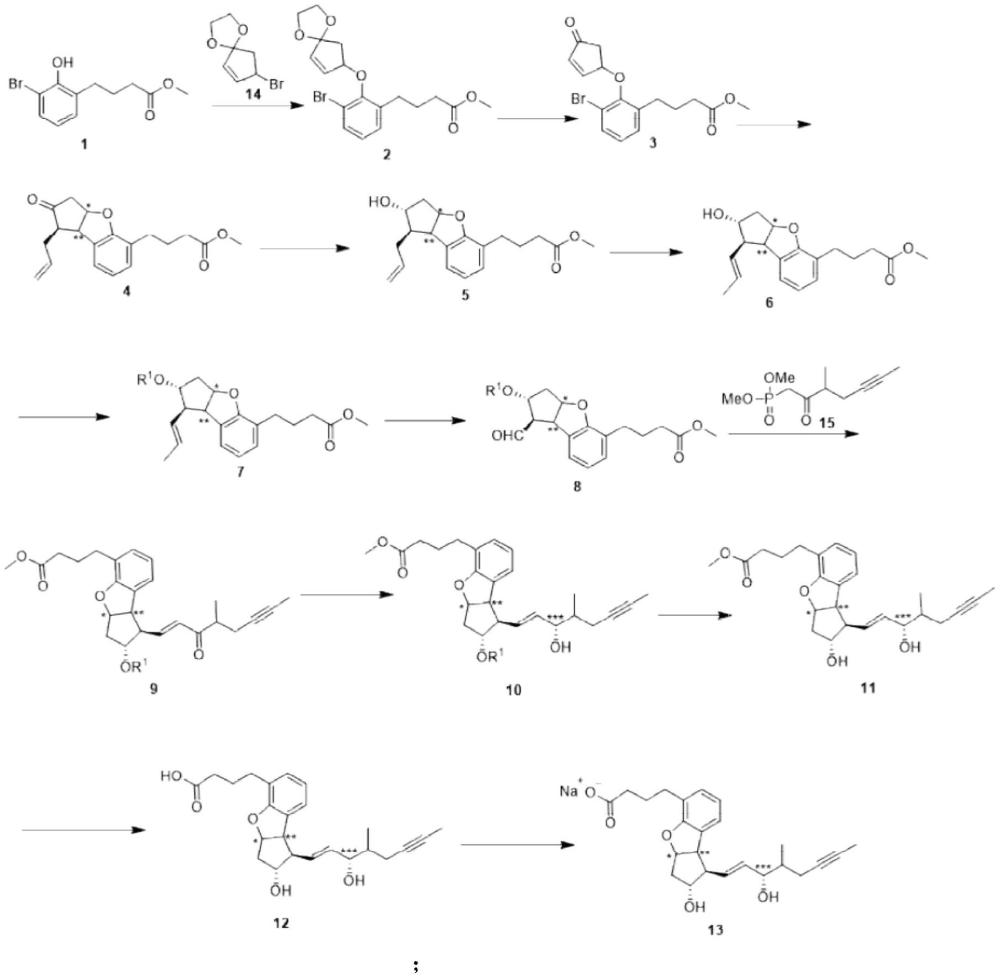
5、关于贝前列素钠的制备方法,专利us5202447、jp59134787和jp2003002885描述了贝前列素钠的合成方法(见路线1),该方法以环戊二烯为起始物,合成步骤多,收率极低。
6、路线1:
7、
8、专利wo2004/005274和jp07238046描述了另一条合成路线(见路线2),该路线以苯酚为起始物,经过溴化,溴丙烯保护后,与呋喃反应后经重排等一系列反应得到产物,该过程收率较路线1高,但其中1,4-加成反应的收率不高,且其中需要用到四氧化锇等毒性较大化学物质进行双键的断裂氧化,反应对合成人员的安全防护要求高、存在操作不便等缺点。
9、路线2:
10、
11、因此,本领域需要开发一种生产成本低、过程高效、操作方便、适合工业化生产的关键中间体化合物,这种中间体能够适用于贝前列素钠的合成路线。
技术实现思路
1、本发明针对现有技术存在的问题,提供了一种反应条件温和、操作简便、安全、产率较高的贝前列素钠的制备方法,并且提供了一种制备贝前列素钠的新的中间体及其制备方法。
2、为实现上述目的,本发明采用的技术方案如下:
3、第一方面,本发明提供了一种贝前列素钠的制备方法,制备路线如下:
4、
5、*和**同时为r构型,或*和**同时为s构型;当*和**同时为r构型时,***为s构型;当*和**同时为s构型时,***为r构型;
6、其中r1为r1-1r1-2r1-3si-、乙酰基或苯甲酰基,r1-1、r1-2和r1-3独立地选自c1-4烷基或苯基。
7、根据本发明的一个实施方式,所述方法的具体步骤包括:
8、(1)溶剂中,碱性条件下,化合物1和化合物14进行反应,生成化合物2;
9、(2)溶剂中,在催化剂的作用下,化合物2发生脱保护反应,生成化合物3;
10、(3)溶剂中,在偶氮二异丁腈的作用下,化合物3和三正丁基烯丙基锡进行反应,生成化合物4;
11、(4)溶剂中,在还原剂的作用下,将化合物4与还原剂进行反应,生成化合物5;
12、(5)溶剂中,在催化剂的作用下,化合物5发生双键移位,生成化合物6;
13、(6)溶剂中,在碱的作用下,将化合物6与羟基保护剂进行反应,生成化合物7;
14、(7)溶剂中,在氧化体系的作用下,化合物7发生双键氧化断裂反应生成化合物8;
15、(8)溶剂中,在碱的作用下,化合物8与化合物15发生反应,生成化合物9;
16、(9)溶剂中,在还原剂的作用下,化合物9发生还原反应,生成化合物10;
17、(10)溶剂中,在碱性条件下,化合物10进行反应,生成化合物11;
18、(11)溶剂中,在碱的作用下,化合物11进行反应,生成化合物12;
19、(12)溶剂中,在氢氧化钠的作用下,化合物12进行反应,生物化合物13,即贝前列素钠。
20、根据本发明的一个实施方式,步骤(1)中,所述溶剂为醚类溶剂或酰胺类溶剂;优选地,所述醚类溶剂为四氢呋喃、乙醚或1,4-二氧六环;所述酰胺类溶剂为n,n-二甲基甲酰胺或n,n-二甲基乙酰胺;
21、根据本发明的一个实施方式,步骤(1)中,所述碱为氢氧化钠,二异丙基氨基锂或氢化钠;优选二异丙基氨基锂;所述碱与化合物1的摩尔比为1~1.2:1.0;
22、根据本发明的一个实施方式,步骤(1)的反应温度为25℃~40℃。
23、根据本发明的一个实施方式,步骤(2)中,所述溶剂为酮类溶剂、醇类溶剂和水中的一种或多种;优选地,所述酮类溶剂为丙酮;所述醇类溶剂为甲醇、乙醇或异丙醇;进一步优选地,所述溶剂为丙酮与水的混合溶剂;
24、根据本发明的一个实施方式,步骤(2)中,所述催化剂为盐酸、硫酸、乙酸、三氟乙酸、对甲苯磺酸及其吡啶盐、樟脑磺酸,优选为对甲苯磺酸或吡啶对甲苯磺酸盐;所述催化剂与化合物2的摩尔比为0.1~2.0:1.0;
25、根据本发明的一个实施方式,步骤(2)的反应温度为30℃~100℃,优选60~80℃。
26、根据本发明的一个实施方式,步骤(3)中,所述溶剂为苯类溶剂或醚类溶剂;优选地,所述苯类溶剂为甲苯;所述醚类溶剂为四氢呋喃;
27、根据本发明的一个实施方式,步骤(3)中,所述偶氮二异丁腈与化合物3的摩尔比为0.2~0.5:1.0。
28、根据本发明的一个实施方式,步骤(4)中,所述溶剂为醇类溶剂或醚类溶剂;优选地,所述醇类溶剂为甲醇、乙醇或异丙醇;所述醚类溶剂为四氢呋喃、乙醚或1,4-二氧六环;
29、根据本发明的一个实施方式,步骤(4)中,所述还原剂为:硼氢化钠,硼氢化钾,硼氢化锂,二异丁基氢化铝锂,三叔丁基氢化铝锂,三乙基硼氢化锂或red-al;优选硼氢化钠;所述还原剂与化合物4的摩尔比为0.8~1.0:1.0。
30、根据本发明的一个实施方式,步骤(5)中,所述溶剂为甲苯;
31、根据本发明的一个实施方式,步骤(5)中,所述催化剂为grubbs催化剂(含第一、二代),hoveyda-grubbs催化剂(含第一、二代),羰基氯氢三(三苯基膦)钌,优选羰基氯氢三(三苯基膦)钌;所述催化剂与化合物5的摩尔比为0.01~0.5:1;优选0.01~0.05:1。
32、根据本发明的一个实施方式,步骤(5)的反应温度:90~110℃。
33、根据本发明的一个实施方式,步骤(6)中,所述溶剂为酰胺类溶剂、腈类溶剂、醚类溶剂或卤代烃类溶剂;优选地,所述酰胺类溶剂为n,n-二甲基甲酰胺或n,n-二甲基乙酰胺;所述腈类溶剂为乙腈;所述醚类溶剂为四氢呋喃或1,4-二氧六环;所述卤代烃类溶剂为二氯甲烷、氯仿、四氯化碳或二氯乙烷;
34、根据本发明的一个实施方式,步骤(6)中,所述碱为有机碱;优选地,所述碱为三乙胺;所述碱与化合物6的摩尔比为1.1~6.0:1.0;
35、根据本发明的一个实施方式,步骤(6)中,所述羟基保护剂为r1-1r1-2r1-3sicl、r1-1r1-2r1-3siotf、乙酸酐或苯甲酸酐,其中r1为r1-1r1-2r1-3si-、乙酰基或苯甲酰基,r1-1、r1-2和r1-3独立地选自c1-4烷基或苯基;优选地,所述r1-1、r1-2和r1-3独立地选自甲基、乙基、异丙基、叔丁基或苯基;
36、进一步优选地,所述羟基保护剂选自乙酸酐或苯甲酸酐;
37、所述羟基保护剂与化合物6的摩尔比为1.0~3.0:1.0。
38、根据本发明的一个实施方式,步骤(7)中,所述溶剂为四氢呋喃和水的混合物;
39、根据本发明的一个实施方式,步骤(7)中,所述氧化体系为锇酸钾/高碘酸钠,四氧化锇/高碘酸钠,臭氧/三苯基膦,优选锇酸钾/高碘酸钠;所述氧化体系中的氧化剂与化合物7三者的摩尔比为0.01~0.1:3~6:1;优选0.01~0.02:3~4:1;
40、根据本发明的一个实施方式,步骤(7)的反应温度为0℃~25℃。
41、根据本发明的一个实施方式,步骤(8)中,所述溶剂为醚类溶剂或酰胺类溶剂;优选地,所述醚类溶剂为四氢呋喃;所述酰胺类溶剂为n,n-二甲基甲酰胺或n,n-二甲基乙酰胺;
42、根据本发明的一个实施方式,步骤(8)中,所述碱为有机碱或无机碱;优选地,所述有机碱选自三乙胺、dbu、叔丁醇钾、正丁基锂、六甲基二硅基胺基钠、六甲基二硅基胺基钾或六甲基二硅基胺基锂;所述无机碱选自钠氢或氯化锂;
43、根据本发明的一个实施方式,步骤(8)中,所述碱与化合物8的摩尔比为1.0~3.0:1.0;化合物15与化合物8的摩尔比为1.0~3.0:1.0。
44、根据本发明的一个实施方式,步骤(9)中,所述溶剂为醚类溶剂或醇类溶剂;优选地,所述醚类溶剂为四氢呋喃;所述醇类溶剂为甲醇、乙醇或异丙醇;
45、根据本发明的一个实施方式,步骤(9)中,所述还原剂为:硼氢化钠/三氯化铈、硼氢化钾、硼氢化锂、硼烷乙醚复合物、硼烷二甲基硫醚复合物、氨基硼烷、叔丁基胺基硼烷、二异丁基氢化铝锂、(-)-二异松蒎基氯硼烷、(r)-cas-me、硼氢化钠/氯化钴或(r)-b-异松蒎基-9-硼烷双环[3.3.1]壬烷;所述还原剂与化合物9的摩尔比为2.0~6.0:1.0。
46、根据本发明的一个实施方式,步骤(10)中,所述溶剂为醇类溶剂;优选地,所述溶剂为甲醇、乙醇或异丙醇;
47、根据本发明的一个实施方式,步骤(10)中,所述碱为甲醇钠;所述碱与化合物10的摩尔比为1:1~4。
48、根据本发明的一个实施方式,步骤(11)中,所述溶剂为甲醇和水;
49、根据本发明的一个实施方式,步骤(11)中,所述碱为氢氧化钠;所述碱与化合物11的摩尔比为2~5:1。
50、根据本发明的一个实施方式,步骤(12)中,所述溶剂为甲醇和水。
51、第二方面,本发明提供了一种制备贝前列素钠的中间体化合物2及化合物2的制备方法。
52、所述化合物2的结构为:
53、
54、化合物2的制备方法包括如下步骤:
55、
56、碱性条件下,化合物1发生亲核取代生成化合物2;
57、具体地,化合物1与(化合物14)发生亲核取代生成化合物2;
58、优选地,所述碱为氢氧化钠,二异丙基氨基锂或氢化钠;优选二异丙基氨基锂;所述碱与化合物1的摩尔比为1~1.2:1.0;优选地,反应温度为25℃~40℃。
59、第三方面,本发明提供了一种制备贝前列素钠的中间体化合物3及化合物3的制备方法。
60、所述化合物3的结构为:
61、
62、化合物3的制备方法包括如下步骤:
63、
64、在催化剂的作用下,化合物2发生脱保护反应,生成化合物3;
65、优选地,所述催化剂为盐酸、硫酸、乙酸、三氟乙酸、对甲苯磺酸及其吡啶盐或樟脑磺酸,优选为对甲苯磺酸或吡啶对甲苯磺酸盐;所述催化剂与化合物2的摩尔比为0.1~2.0:1.0;
66、优选地,脱保护的反应温度为30℃~100℃,优选60~80℃。
67、第四方面,本发明提供了一种制备贝前列素钠的中间体化合物4及化合物4的制备方法。
68、所述化合物4的结构为:
69、
70、*和**同时为r构型或*和**同时为s构型;
71、化合物4的制备方法包括如下步骤:
72、
73、在自由基引发剂的作用下,化合物3发生自由基串联反应生成化合物4;
74、优选地,所述自由基引发剂为偶氮二异丁腈;进一步优选地,该步骤具体为,在偶氮二异丁腈的作用下,化合物3和三正丁基烯丙基锡进行反应,生成化合物4;
75、优选地,所述偶氮二异丁腈与化合物3的摩尔比为0.2~0.5:1.0。
76、相对于现有技术,本发明具有以下有益效果:
77、本发明提供了一种合成贝前列素钠的新的反应路线,并提供了新的中间体化合物,本发明所述的制备方法合成步骤简单,反应产率相较于现有技术具有显著提高,所述方法避免使用剧毒试剂,环境友好、绿色无污染。
78、本发明提供了一种合成贝前列素钠的新的中间体化合物2和3,中间体2和3的反应方法简单,收率高,为贝前列素钠的合成提供了新的思路。
79、本发明还提供了一种合成贝前列素钠的中间体化合物4的制备方法,所述方法相较于现有技术步骤更简单、收率更高、反应条件温和,更适合工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!