一种苯并咪唑类化合物及其制备方法和应用与流程
1.本发明属于药物化学领域,具体涉及一种苯并咪唑类化合物及其制备方法和应用。
背景技术:
2.苯并咪唑是一种含有两个氮原子的苯并杂环结构,最初是因为其为维生素12的重要组成部分而被关注。苯并咪唑的特殊芳香体系使其易与生物体内的受体和酶等形成氢键,与金属离子配位以及发生π-π相互作用等。因此苯并咪唑结构作为一种优势骨架在药学领域得到了广泛的研究。多年来的研究表明,含苯并咪唑结构的化合物具有广泛的生物活性,如作为金属泵抑制剂、组胺受体拮抗剂、抗寄生虫、抗惊厥、镇痛、抗炎、抗高血压、抗病、抗凝血、抗肿瘤等,尤其作为抗肿瘤药物具有良好的应用前景,当前已有多种含苯并咪唑结构的化合物作为抗肿瘤药物进入临床,如苯达莫司汀(bendamustine)、多韦替尼(dovitinib)等。苯并咪唑类衍生物的抗肿瘤机制主要包括抑制拓扑异构酶和parp酶的活性、抑制微管蛋白合成、抑制有丝分裂阻滞细胞周期抑制细胞骨架、抑制肿瘤有氧糖酵解过程、降低血管内皮生长因子水平等。
3.急性髓系白血病(acute myelogenous leukemia,aml)是造血干/祖细胞恶性克隆性增殖性疾病。随着我国人口的老龄化,近年来aml的发病率呈升高态势。现阶段临床除全反式维甲酸与砷剂对急性早幼粒细胞白血病(aml-m3)有确切疗效外,远期预后差且极易复发仍然是威胁其他亚型aml患者生存的主要原因。据统计,aml的5年总生存率仅有24%。在过去的很长一段时间,aml的治疗一直以联合化疗为主,可供选择的药物较为有限且毒副反应较大,对不能耐受常规化疗的老年人来说可供选择的治疗方案更为单一。
4.阿糖胞苷是一种核苷类似物,临床上常用阿糖胞苷作为aml诱导和巩固治疗的药物。然而,随着阿糖胞苷的应用剂量越大,胞浆浓度越高,产生的毒性就越大,其中以骨髓抑制性为最严重的毒副作用。此外,现有研究表明阿糖胞苷代谢通路中存在多个可能导致细胞对阿糖胞苷敏感性下降的环节,有研究表明约30%~50%的患者经阿糖胞苷诱导治疗后出现复发耐药现象。因此目前临床急需一种效果更好、副作用小且对耐药型急性髓系白血病也有较好治疗效果的药物。
5.基于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种苯并咪唑类化合物及其制备方法及应用。
7.为了实现上述目的,本发明提供以下技术方案:
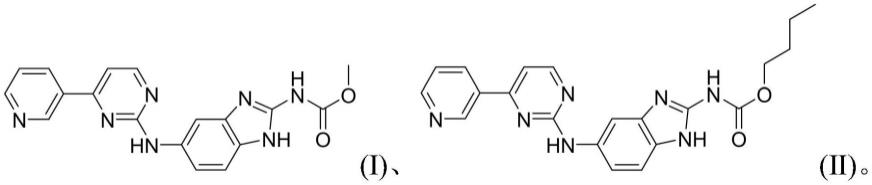
8.本发明提供了一种苯并咪唑类化合物,其具有式a所示结构:
[0009][0010]
或其立体异构体、互变异构体或药学上可接受的盐;
[0011]
其中,各r1、r2、r3、r4、r5、r6分别独立的选自氢、氘、氨基、羟基、巯基、卤素或者c
1-c5的直链或支链烷基,r7为氢、氘、c
1-5
的直链或支链烷基、c
1-5
的卤代烷基、c
1-5
的羟基烷基、c
1-5
的氨基烷基、c
3-5
的环烷基。
[0012]
在一些实施例中,本发明所述苯并咪唑类化合物具有式b所示结构:
[0013][0014]
在一些实施例中,r7为氢、氘、c
1-5
的直链或支链烷基、c
1-5
的卤代烷基、c
1-5
的羟基烷基、c
1-5
的氨基烷基、c
3-5
的环烷基。
[0015]
在一些优选的实施例中,r7为c
1-5
的直链或支链烷基。
[0016]
在一些实施例中,本发明所述的苯并咪唑类化合物为具有以下结构之一的化合物:
[0017][0018]
本发明还提供了一种所述苯并咪唑类化合物或其药学上可接受的盐的制备方法,包括以下步骤:
[0019]
本发明还提供了一种所述苯并咪唑类化合物或其药学上可接受的盐的制备方法,包括以下步骤:
[0020]
1)将2-硝基-1,4-苯二胺悬浮于水中,依次加入浓盐酸和氨基腈,升温反应,冷却后抽滤,得到暗黄色粉末状固体中间体一;
[0021]
2)以中间体一、1-(3-吡啶基)-3-(二甲氨基)-2-丙烯-1-酮、naoh为原料,正丁醇为溶剂,加热回流反应反应,冷却后抽滤,得到黄色粉末状固体中间体二;
[0022]
3)将中间体二溶于甲醇中,加入pd/c催化剂和水合肼,加热回流至反应完全,抽滤后得到橙红色粉末状固体中间体三;
[0023]
4)以中间体三、1,3-二羧甲基-2-甲基-2-硫代异脲、r7-oh为原料,升温反应,冷却后抽滤,得到所述苯并咪唑类化合物。
[0024]
其反应路线为:
[0025][0026]
本发明还提供了一种药物组合物,所述药物组合物包含本发明所述的苯并咪唑类化合物或其药学上可接受的盐,以及药学上可接受的辅料、稀释剂、载体或其组合。
[0027]
在本发明中,所述药物组合物可以制成任何形式的制剂,具体可以为胶囊剂、片剂、气雾剂、溶液剂、悬浮剂、糖衣剂、锭剂、糖浆剂、乳剂、膏剂、注射剂、散剂、糊剂、颗粒剂、缓释剂或泡沫剂,本发明对此没有特殊限定。
[0028]
本发明还提供了本发明所述的苯并咪唑类化合物或本发明所述的药物组合物在制备治疗急性髓系白血病药物中的应用。
[0029]
在一些实施例中,所述急性髓系白血病为耐药型急性髓系白血病。
[0030]
进一步地,所述耐药型急性髓系白血病为耐阿糖胞苷型急性髓系白血病。
[0031]
本发明提供了一类苯并咪唑类化合物,在结构上具有较高的创新性,制备方法简单,制备成本低,反应过程易于控制,适合大规模工业化生产。
[0032]
本发明提供的苯并咪唑类化合物能够有效抑制急性髓系白血病细胞的增殖,抑制效果显著优于现有药物如阿糖胞苷,并且对耐药型急性髓系白血病细胞也有较好的抑制效果,毒副作用小,具备良好的成药性。
附图说明
[0033]
图1为不同浓度、不同处理时间下多种待测物质对dami细胞增殖的影响;
[0034]
图2为不同浓度、不同处理时间下多种待测物质对kasumi细胞增殖的影响;
[0035]
图3为不同浓度、不同处理时间下多种待测物质对kg-1细胞增殖的影响;
[0036]
图4为不同浓度、不同处理时间下多种待测物质对me-1细胞增殖的影响;
[0037]
图5为不同浓度、不同处理时间下多种待测物质对skno1细胞增殖的影响;
[0038]
图6为不同浓度、不同处理时间下多种待测物质对k562细胞增殖的影响;
[0039]
图7为不同浓度、不同处理时间下多种待测物质对huvec细胞增殖的影响;
[0040]
图8为不同浓度下三种待测物质对耐阿糖胞苷细胞增殖的影响
具体实施方式
[0041]
为使本技术实施例的目的、技术方案和优点更加清楚,下面将对本技术实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0042]
实施例1(5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑基)氨基甲酸甲酯
[0043][0044]
1)中间体1的合成
[0045]
将2-硝基-1,4-苯二胺(5g,32.65mmol)悬浮于5ml水中,加入浓盐酸3.06g,再加入胺基腈(2.75g,65.3mmol),升温至85℃反应3h后,冷却至室温,置于2-8℃冰箱中过夜,抽滤析出的固体,滤饼用乙醚洗涤,干燥后得5.2g暗黄色粉末状固体中间体1,收率67%,无需纯化直接用于下一步。
[0046]
2)中间体2的合成
[0047]
将中间体1(1.42g,5.5mmol)、1-(3-吡啶基)-3-(二甲氨基)-2-丙烯-1-酮(925mg,5.25mmol)和naoh(230mg,5.75mmol)置于10ml正丁醇中回流反应20h,冷却至室温后,置于2-8℃冰箱中析晶24h,抽滤,1ml
×
3次正丁醇洗涤滤饼,再水洗至中性,干燥得1.48g黄色粉末状固体中间体2,收率87%,无需纯化直接用于下一步。
[0048]
3)中间体3的合成
[0049]
中间体2(1.45g,4.7mmol)悬浮于40mlmeoh中,加入290mg含水量50%的10%pd/c和85%水合肼(2.77g,47mmol),加热回流至反应完全,抽滤,热甲醇洗涤硅藻土层至洗出液无产物,滤液浓缩后抽滤,干燥后得1.173g橙红色粉末状固体中间体3,收率90%,无需纯化直接用于下一步。
[0050]
4)(5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑基)氨基甲酸甲酯的合成
[0051]
将中间体3(278mg,1mmol)悬浮于8mlmeoh中,加入1,3-二羧甲基-2-甲基-2-硫代异脲(247mg,1.2mmol),回流反应19h,冷却至室温后,抽滤,用meoh洗涤滤饼,滤饼干燥后得334mg粗品。334mg粗品经制备液相纯化得242mg墨绿色粉末状固体(5-(4-(3-吡啶基)-氨基吡啶)-2-苯并咪唑基)氨基甲酸甲酯。
[0052]
所述制备液相的操作方法:以mecn(a)和水(b)为洗脱溶剂;色谱柱为phenomenex gemini-c18 column(30mm
×
100mm,5μm);流速20ml/min;洗脱梯度0-25min,80%(b)-0%(b),25.01min-30min,80%(b)-80%(b);检测波长254nm。
[0053]
实施例2(5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑基)氨基甲酸丁酯与5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑酮
[0054][0055]
1)中间体4的合成
[0056]
将2-硝基-1,4-苯二胺(5g,32.65mmol)悬浮于5ml水中,加入浓盐酸3.06g,再加入胺基腈(2.75g,65.3mmol),升温至85℃反应3h后,冷却至室温,置于2-8℃冰箱中过夜,抽滤析出的固体,滤饼用乙醚洗涤,干燥后得5.2g暗黄色粉末状固体中间体4,收率67%,无需纯化直接用于下一步。
[0057]
2)中间体5的合成
[0058]
将中间体4(1.42g,5.5mmol)、1-(3-吡啶基)-3-(二甲氨基)-2-丙烯-1-酮(925mg,5.25mmol)和naoh(230mg,5.75mmol)置于10ml正丁醇中回流反应20h,冷却至室温后,置于2-8℃冰箱中析晶24h,抽滤,1ml
×
3次正丁醇洗涤滤饼,再水洗至中性,干燥得1.48g黄色粉末状固体中间体5,收率87%,无需纯化直接用于下一步。
[0059]
3)中间体6的合成
[0060]
中间体5(1.45g,4.7mmol)悬浮于40ml meoh中,加入290mg含水量50%的10%pd/c和85%水合肼(2.77g,47mmol),加热回流至反应完全,抽滤,热甲醇洗涤硅藻土层至洗出液无产物,滤液浓缩后抽滤,干燥后得1.173g橙红色粉末状固体中间体6,收率90%,无需纯化直接用于下一步。
[0061]
4)(5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑基)氨基甲酸丁酯)与5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑酮)的合成
[0062]
将中间体6(278mg,1mmol)悬浮于6ml正丁醇,加入1,3-二羧甲基-2-甲基-2-硫代异脲(247mg,1.2mmol),升温至100℃反应13h,冷却至室温后,抽滤,用正丁醇洗涤滤饼,滤饼干燥后得248mg粗品,经制备液相纯化得棕色粉末状的5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑酮(48mg,rt=10.6min)和(5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑基)氨基甲酸丁酯(42mg,rt=17.9min)。
[0063]
所述制备液相的操作方法:以mecn(a)和水(b)为洗脱溶剂;色谱柱为phenomenex gemini-c18column(30mm
×
100mm,5μm);流速20ml/min;洗脱梯度0-25min,90%(b)-25%
(b),25.01-27min,25%(b)-0%(b);27-28min,0%(b)-0%(b),28.01-33min,90%(b)-90%(b);检测波长254nm。
[0064]
实施例3(r)-n-(1h-1,3-苯并咪唑-2-基)-2,3-二甲基丁胺
[0065][0066]
将boc-l-缬氨酸(4.35g,20mmol)、edci(4.98g,26mmol)、hobt(3.51g,26mmol)、2-胺基苯并咪唑(2.93g,22mmol)及dipea(7.75g,60mmol)依次投入120mldcm中,室温下搅拌反应41h后,加入水,dcm萃取,有机相水洗三次,浓缩,不溶物抽滤,分别用少量乙醇和dcm洗滤饼,干燥,得4.317g白色粉末状固体中间体7,收率67%,产品无需纯化直接用于下一步。
[0067]
将中间体7(520mg,1.56mmol)悬浮于10mldcm中,加入2ml hcl/meoh(25%)溶液,室温下搅拌反应几分钟,出现粘稠胶状物,补加6ml甲醇使其溶解后,继续搅拌反应至tlc中间体7耗尽。反应液减压蒸干,加入4ml水溶解,饱和nahco3水溶液调ph=8,dcm/meoh=10/1混合溶剂萃取多次,萃取液浓缩至干得粗品,粗品经制备液相纯化得白色粉末状固体(r)-n-(1h-1,3-苯并咪唑-2-基)-2,3-二甲基丁胺。制备液相分离方法:以mecn(a)和水(b)为洗脱溶剂;柱子phenomenex gemini-c18 column(30mm
×
100mm,5μm);流速20ml/min;洗脱梯度0-20min,75%(b)-0%(b),20.01-25min,75%(b)-75%(b);检测波长254nm。
[0068]
实施例4不同化合物对多种白血病细胞增殖的影响
[0069]
1)实验材料:
[0070]
主要试剂:cell counting kit-8试剂盒(dojindo);rpmi 1640液体培养基(gibco);胎牛血清(solarbio/索莱宝);阿糖胞苷(solarbio/索莱宝);96孔板(corning/康宁);二甲基亚砜(solarbio/索莱宝)。
[0071]
主要仪器:细胞孵箱(thermo,hera cell150i),离心机(thermo,st40r),酶标仪(thermo,fc)。
[0072]
2)试验药物:
[0073]
本发明式i化合物、本发明式ⅱ化合物、阿糖胞苷,以5-(4-(3-吡啶基)-氨基嘧啶)-2-苯并咪唑酮为对照式i,以(r)-n-(1h-1,3-苯并咪唑-2-基)-2,3-二甲基丁胺为对照式ⅱ。
[0074]
3)实验方法:
[0075]
取生长良好的处于对数生长期的五种aml细胞系(kasumi细胞、me-1细胞、skno1细胞、kg-1细胞、dami细胞)、慢性髓系白血病细胞系(k562细胞)和脐静脉内皮细胞系(huvec细胞),分别种植于含有液体培养基的96孔板中,每孔加入细胞悬浮液100μl、细胞密度为1
×
105ml,每种细胞均设置三组实验,药物终浓度配置为1μmol/l、0.1μmol/l和0.01μmol/l的式ⅰ化合物、式ⅱ化合物、阿糖胞苷、对照式i和对照式ⅱ,每组设置3个复孔,分别培养24h、48h和72h后,每孔加入20μl的cck-8试剂,置于37℃孵育2h,在450nm和600nm处用酶标仪检测各孔od值并计算细胞增殖率。细胞增殖率的计算公式为:
[0076]
细胞增殖率=[实验组(450nm od值-600nm od值)-空白对照组(450nm od值-600nm od值)]/[对照组(450nm od值-600nm od值)-空白对照组(450nm od值-600nm od值)]
×
100%
[0077]
实验结果如图1-7所示,本发明式i化合物与本发明式ii化合物均能有效抑制5种aml细胞的增殖,而具有与本发明类似结构的对照式i与对照式ii未表现明显的抑制作用。
[0078]
本发明式i与本发明式ii处理后,对照组细胞(k562)的细胞增殖能力未受到明显抑制,这表明本发明式i和式ii化合物可特异性抑制aml细胞的增殖,对aml细胞的抑制作用具有专一性。
[0079]
在部分浓度、处理时间等条件下,本发明提供的式i化合物和式ii化合物对五种aml细胞增殖的抑制效果显著强于阿糖胞苷,且差异具有统计学意义(p《0.05)。在部分aml细胞系中(skno1、me-1、kasumi),0.01μmol/l浓度下细胞增殖率即与对照药品阿糖胞苷具有显著差异(p《0.05),说明本发明提供的式i和式ii化合物具有良好的成药性。
[0080]
对于正常人脐静脉内皮细胞(huvec),早期本发明式i与本发明式ii的抑制增殖作用弱于阿糖胞苷,后期随阿糖胞苷代谢,本发明式i与本发明式ii的抑制增殖作用略强于阿糖胞苷,这表明本发明提供的式i和式ii化合物的毒副作用小,成药潜力大。
[0081]
实施例5不同化合物对耐阿糖胞苷白血病细胞增殖的影响
[0082]
取生长良好的处于对数生长期的三种耐阿糖胞苷aml细胞系(kasumi-r、me-1-r、skno1-r),实验方法同实施例4,药物终浓度配置为2μmol/l、1μmol/l和0.1μmol/l的式ⅰ化合物、式ⅱ化合物和阿糖胞苷。于72小时后检测各孔od值并计算细胞增殖率。
[0083]
实验结果如图8所示,在三种耐阿糖胞苷细胞系中(kasumi-r、me-1-r、skno1-r),本发明提供的式i化合物和式ii化合物均有显著较好的抑制增殖作用,这表明本发明式i和式ii化合对耐阿糖胞苷型白血病细胞有较好的治疗效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1