含有马来酰亚胺片段的地塞米松衍生物及其制备方法
1.本发明属于医药化学领域,涉及提高地塞米松抗肿瘤活性的方法,尤其是涉及一组含有马来酰亚胺片段的地塞米松衍生物及其制备方法,以及它们在抗肿瘤方面的应用。
背景技术:
2.地塞米松(dexamethasone),化学名为16α-甲基-11β,17α,21-三羟基-9α-氟孕甾-1,4-二烯-3,20-二酮,cas号50-02-2,分子式c
22h29
fo5,分子量392.47,其化学结构式如以下式(iii)所示:
[0003][0004]
地塞米松是一种人工合成(1957年)的糖皮质激素类药物,并被列入who基本药物标准清单,已为广大临床医师所认可。本品具有抗炎、抗过敏、抗休克等作用,主要用于治疗过敏性及自身免疫性疾病,如结缔组织病,类风湿性关节炎,严重的支气管哮喘,皮炎等过敏性疾病,溃疡性结肠炎等,其临床剂型包括片剂、注射剂、混悬剂、滴眼剂、软膏剂等。此外,地塞米松也常与化疗药物联用以降低后者的毒副反应(如脱水、恶心、急性毒性、水肿、疼痛)。研究发现,地塞米松本身具有一定的抗瘤活性,但同时也可降低癌细胞对化疗药物的敏感性,故临床上务必严格仔细使用之(sau s,等.european journal of medicinal chemistry,83(2014)433-447)。
[0005]
近年来,内源性人血白蛋白(hsa)作为细胞毒药物的靶向载体的研究取得了的重大突破。其中,作为多柔比星(dna拓扑异构酶ii抑制剂)的hsa结合前药,aldoxorubicin(多柔比星的6-马来酰亚胺己酰肼衍生物)已于2014年被美国fda批准上市。研究发现,静脉给药后,aldoxorubicin分子中的马来酰亚胺片段可与has中的巯基共价键结合而靶向转运至肿瘤组织,在肿瘤微环境酸性条件下从白蛋白中释放出来。与原药多柔比星相比,aldoxorubicin的疗效更强,而毒副作用更低(moon h,等.biomacromolecules,2014,15,3794-3801)。
[0006]
基于上述研究成果,本发明人进行了广泛的研究,设计合成了含有马来酰亚胺片段的地塞米松衍生物,并测定了它们的抗肿瘤活性。最终发现,通过不同的连接子将地塞米松21-位的羟基与马来酰亚胺片段相连的化合物具有意想不到的强抗肿瘤活性。与原药地塞米松以及已上市的吉西他滨相比,这些前药在静脉给药时具有更加优越的体内抗瘤疗效。
技术实现要素:
[0007]
本发明的目的是提供以下式(i)化合物和式(ii)化合物,
[0008][0009]
或其药用盐、溶剂化物,
[0010]
其中:
[0011]
x代表o或不存在;
[0012]
n代表2-6。
[0013]
根据本发明第一方面的化合物,其中所述药用盐是与无机酸或者与有机酸形成的盐。
[0014]
根据本发明第一方面的化合物,其中所述无机酸选自:盐酸、硫酸、磷酸。
[0015]
根据本发明第一方面的化合物,其中所述有机酸选自:乙酸、三氟乙酸、柠檬酸、马来酸、草酸、琥珀酸、苯甲酸、酒石酸、富马酸、扁桃酸、抗坏血酸、苹果酸、氨基酸(例如丙氨酸、天冬氨酸、赖氨酸)、磺酸(例如甲磺酸、对甲苯磺酸)。
[0016]
根据本发明第一方面的化合物,其也可以溶剂化物(例如水合物)的形式存在,因此,这些溶剂化物(例如水合物)也包括在本发明的化合物之内。
[0017]
根据本发明第一方面的化合物,其为选自下列的化合物1~化合物10:
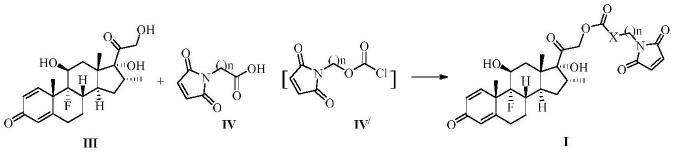
[0018]
化合物1:地塞米松-21-(3-马来酰亚胺)正丙酸酯
[0019]
化合物2:地塞米松-21-(4-马来酰亚胺)正丁酸酯
[0020]
化合物3:地塞米松-21-(5-马来酰亚胺)正戊酸酯
[0021]
化合物4:地塞米松-21-(6-马来酰亚胺)正己酸酯
[0022]
化合物5:地塞米松-21-(2-马来酰亚胺基)乙基碳酸酯
[0023]
化合物6:地塞米松-21-(3-马来酰亚胺)正丙基碳酸酯
[0024]
化合物7:地塞米松-21-(5-马来酰亚胺)正戊基碳酸酯
[0025]
化合物8:地塞米松-21-(3-马来酰亚胺)正丙基磷酸酯
[0026]
化合物9:地塞米松-21-(5-马来酰亚胺)正戊基磷酸酯
[0027]
化合物10:地塞米松-21-(6-马来酰亚胺)正己基磷酸酯。
[0028]
进一步的,本发明第二方面提供了制备式(i)化合物和式(ⅱ)化合物的方法,其分别按以下反应路线一和反应路线二进行:
[0029]
反应路线一:
[0030][0031]
在反应路线一中,n和x如前述的定义。
[0032]
具体地说,制备式(i)化合物包括如下步骤:
[0033]
式(iv)化合物或式(iv
/
)化合物溶于非极性溶剂(例如,二氯甲烷、三氯甲烷、四氢
呋喃、二氧六环),在有机碱(例如,三乙胺、n,n-二甲基吡啶、吡啶、4-二甲氨基吡啶)存在下,加入0.5~1倍当量的式(iii)化合物,于0℃~室温下搅拌反应5~15小时,得到式(i)化合物。
[0034]
在反应路线一中,用作起始物的式(iv
/
)化合物为已知化合物,并按现有出版物中已知的方法可容易地制得。例如huicong zhang等,j.med.chem.,2018,61:4904-4917。
[0035]
在反应路线一中,用作起始物的式(iii)化合物和式(iv)化合物为常用化学试剂,国内均有商品供应。
[0036]
反应路线二:
[0037][0038]
在反应路线二中,n如前述的定义。
[0039]
具体地说,制备式(ii)化合物包括如下步骤:
[0040]
式(iii)化合物溶于非极性溶剂(例如,二氯甲烷、三氯甲烷、四氢呋喃、二氧六环),于-40℃~-5℃下加入焦磷酰氯(p2o3cl4),同温下继续搅拌反应0.5~3h;然后向上述反应体系中加入1~2倍当量的式(v)化合物和有机碱(例如,三乙胺、n,n-二甲基吡啶、吡啶、4-二甲氨基吡啶),于同温下继续搅拌反应4~6小时,得到式(ii)化合物。
[0041]
在反应路线二中,用作起始物的式(iii)化合物和式(v)化合物为常用化学试剂,国内均有商品供应。
[0042]
进一步的,本发明第三方面提供了本发明第一方面任一项所述化合物或者本发明第二方面任一项所述方法制备的化合物在制备用于治疗肿瘤的药物中的用途。
[0043]
根据本发明第三方面的用途,其中所述肿瘤为实体瘤和白血病。
[0044]
目前,相关文献报道大多为地塞米松与其他化疗药物联合用药治疗某些实体瘤的研究,如地塞米松与吉西他滨联合治疗乳腺癌(yin yuan等,journal of pharmaceutical sciences,2015,104:4399
–
4408);或地塞米松与其他化疗药物形成的杂合体的研究,如地塞米松-吉西他滨杂合体在肿瘤治疗方面的应用(刘明亮等,cn 202110507994.6),但罕见基于地塞米松的结构改造而用于肿瘤治疗者。本发明则首次通过不同的连接子(酯键,碳酸酯键,磷酸酯键)将地塞米松与马来酰亚胺片段连接,相应的化合物可靶向作用于肿瘤组织,其体内抗肿瘤疗效明显优于地塞米松或阳性对照药-吉西他滨。
[0045]
本发明任一方面或该任一方面的任一实施方案所具有的任一技术特征同样适用其它任一实施方案或其它任一方面的任一实施方案,只要它们不会相互矛盾,当然在相互之间适用时,必要的话可对相应特征作适当修饰。下面对本发明的各个方面和特点作进一步的描述。
[0046]
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
具体实施方式
[0047]
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。
[0048]
实施例1、地塞米松-21-(3-马来酰亚胺)正丙酸酯
[0049]
3-马来酰亚胺丙酸(254mg,1.5mmol)与hatu(1.14g,1.5mmol)溶于二氯甲烷溶液中,加入三乙胺(417ml,3mmol),室温搅拌30分钟后,加入化合物ⅲ地塞米松(392mg,1mmol),反应8h,反应完全。后处理:旋干反应液,进行硅胶柱层析(石油醚:乙酸乙酯=2:1),得白色固体。
[0050]1h nmr(500mhz,dmso)δ7.24(s,1h),6.61(s,1h),6.27(s,1h),6.04(s,1h),4.95(d,j=16.2hz,2h),4.37(s,1h),4.32(s,1h),3.98(d,j=13.0hz,2h),2.75(d,j=4.6hz,2h),2.62(s,1h),2.50(s,1h),2.45(s,1h),2.31(d,j=7.6hz,1h),2.09(s,1h),1.82(d,j=14.3hz,2h),1.72(s,1h),1.51(s,3h),1.28(s,1h),1.00(s,4h),0.89(s,3h).ms-esi(m/z):544.2(m+h)
+
.
[0051]
实施例2、地塞米松-21-(4-马来酰亚胺)正丁酸酯
[0052]
参照实施例1,化合物ⅲ与4-马来酰亚胺正丁酸进行反应,得白色固体。
[0053]1h nmr(500mhz,dmso)δ7.24(s,1h),6.70(s,1h),6.27(s,1h),6.04(s,1h),4.95(d,j=5.0hz,2h),4.37(s,1h),4.32(s,1h),4.07(d,j=12.3hz,2h),2.62(s,1h),2.50(s,1h),2.46
–
2.43(m,3h),2.31(d,j=7.6hz,1h),2.09(s,1h),2.01(d,j=5.2hz,2h),1.97(s,0h),1.82(d,j=14.3hz,2h),1.72(s,1h),1.51(s,3h),1.28(s,1h),1.00(s,4h),0.89(s,4h).ms-esi(m/z):558.2(m+h)
+
.
[0054]
实施例3、地塞米松-21-(5-马来酰亚胺)正戊酸酯
[0055]
参照实施例1,化合物ⅲ与5-马来酰亚胺正戊酸进行反应,得白色固体。
[0056]1h nmr(500mhz,cdcl3)δ7.24(s,1h),6.70(s,1h),6.27(s,1h),6.04(s,1h),4.96(d,j=6.2hz,2h),4.37(s,1h),4.32(s,1h),3.71(d,j=12.9hz,2h),2.62(s,1h),2.50(s,1h),2.43(d,j=17.0hz,3h),2.31(d,j=7.6hz,1h),2.09(s,1h),1.82(d,j=14.3hz,2h),1.73(d,j=0.8hz,2h),1.62(s,1h),1.56(d,j=1.5hz,2h),1.51(s,3h),1.28(s,1h),1.00(s,4h),0.89(s,4h).ms-esi(m/z):572.2(m+h)
+
.
[0057]
实施例4、地塞米松-21-(6-马来酰亚胺)正己酸酯
[0058]
参照实施例1,化合物ⅲ与6-马来酰亚胺正己酸进行反应,得白色固体。
[0059]1h nmr(500mhz,dmso)δ7.29(d,j=10.2hz,1h),7.00(s,2h),6.22(dd,j=10.1,1.9hz,1h),6.00(s,1h),5.39(d,j=4.7hz,1h),5.13(s,1h),5.01(d,j=17.6hz,1h),4.79(d,j=17.6hz,1h),4.19
–
4.12(m,1h),3.39(t,j=7.0hz,2h),3.10(dt,j=11.1,5.6hz,1h),2.87(ddd,j=11.9,8.0,4.4hz,1h),2.69(s,1h),2.61(dt,j=13.6,6.8hz,1h),2.34(tt,j=12.8,5.6hz,4h),2.21
–
2.06(m,2h),1.77(dt,j=11.7,5.2hz,1h),1.64(t,j=11.8hz,1h),1.58
–
1.54(m,2h),1.49(s,3h),1.26(p,j=7.6,7.2hz,2h),1.18(t,j=7.3hz,2h),1.07(tt,j=8.8,3.8hz,1h),0.88(s,3h),0.78(d,j=7.2hz,3h).ms-esi(m/
z):586.2(m+h)
+
.
[0060]
实施例5、地塞米松-21-(2-马来酰亚胺基)乙基碳酸酯
[0061]-10℃下,2-马来酰亚胺乙醇(141mg,1mmol)溶于无水氯仿溶液(10ml)中,加入三乙胺(139μl,1mmol),ph试纸成碱性后加入三光气(90mg,0.3mmol)。反应20min,再次加入三乙胺(139μl,1mmol),ph试纸成碱性后加入三光气(90mg,0.3mmol)。室温搅拌1h,三乙胺(167μl,1.2mmol)及地塞米松(393mg,1mmol)依次加入反应液中,4h反应结束。柱层析(pe:ea=1:1)得白色固体。
[0062]1h nmr(500mhz,cdcl3)δ7.24(s,1h),6.70(s,2h),6.27(s,1h),6.04(s,1h),5.07(d,j=18.0hz,2h),4.48(d,j=5.3hz,2h),4.39
–
4.34(m,3h),4.32(s,1h),2.62(s,1h),2.50(s,1h),2.45(s,1h),2.31(d,j=7.6hz,1h),2.09(s,1h),1.82(d,j=14.3hz,2h),1.72(s,1h),1.51(s,3h),1.28(s,1h),1.00(s,4h),0.89(s,4h).ms-esi(m/z):560.2(m+h)
+
.
[0063]
实施例6、地塞米松-21-(3-马来酰亚胺)正丙基碳酸酯
[0064]
参照实施例5,化合物ⅲ与3-马来酰亚胺正丙氧基酰氯进行反应,得白色固体。
[0065]1h nmr(500mhz,cdcl3)δ7.24(s,1h),6.70(s,1h),6.27(s,1h),6.04(s,1h),5.07(d,j=18.0hz,2h),4.37(s,1h),4.32(s,1h),4.23(s,2h),3.98(d,j=7.8hz,2h),2.62(s,1h),2.50(s,1h),2.45(s,1h),2.31(d,j=7.6hz,1h),2.10(d,j=11.1hz,2h),1.82(d,j=14.3hz,2h),1.72(s,1h),1.62(s,1h),1.51(s,3h),1.28(s,1h),1.00(s,4h),0.89(s,4h).ms-esi(m/z):574.2(m+h)
+
.
[0066]
实施例7、地塞米松-21-(5-马来酰亚胺)正戊基碳酸酯
[0067]
参照实施例5,化合物ⅲ与5-马来酰亚胺正戊氧基酰氯进行反应,得白色固体。
[0068]1h nmr(500mhz,cdcl3)δ7.24(s,1h),6.70(s,1h),6.27(s,1h),6.04(s,1h),5.07(d,j=18.0hz,2h),4.38(s,1h),4.32(s,1h),4.17(d,j=4.2hz,2h),3.55(d,j=5.6hz,2h),2.62(s,1h),2.50(s,1h),2.45(s,1h),2.31(d,j=7.6hz,1h),2.09(s,1h),1.82(d,j=14.2hz,2h),1.75
–
1.68(m,5h),1.51(s,3h),1.46(d,j=4.6hz,2h),1.28(s,1h),1.00(s,4h),0.89(s,3h).ms-esi(m/z):602.2(m+h)
+
.
[0069]
实施例8:地塞米松-21-(3-马来酰亚胺)正丙基磷酸酯
[0070]
化合物ⅲ地塞米松(392mg,1mmol)溶于10ml超干thf,-40℃下加入焦磷酰氯(p2o3cl4,301mg,1.2mmol)并搅拌0.5小时。然后加入化合物v 3-马来酰亚丙醇(155mg,1mmol)和超干吡啶(79mg,1mmol),并继续搅拌4小时。后处理:加水淬灭反应,碳酸氢钠溶液洗,二氯甲烷萃取,有机相旋干,进行硅胶柱层析(石油醚:乙酸乙酯=2:1),得白色固体。
[0071]1h nmr(500mhz,cd3od)δ7.41(d,j=10.1hz,1h),6.80(s,2h),6.29(d,j=9.9hz,1h),6.07(s,1h),4.91
–
4.86(m,1h),4.68-4.64(m,1h),4.28-3.92(m,3h),3.48(t,j=7.1hz,2h),3.10
–
2.67(m,2h),2.53
–
2.16(m,3h),1.91
–
1.87(m,1h),1.78
–
1.48(m,7h),1.40
–
1.28(m,3h),1.02(s,3h),0.87(d,j=7.2hz,3h).ms-esi(m/z):610.2(m+h)
+
.
[0072]
实施例9:地塞米松-21-(5-马来酰亚胺)正戊基磷酸酯
[0073]
参照实施例8,化合物ⅲ与5-马来酰亚胺正戊醇进行反应,得白色固体。
[0074]1h nmr(500mhz,cd3od)δ7.41(d,j=10.0hz,1h),6.82(s,2h),6.39
–
6.17(m,1h),6.08(s,1h),4.94
–
4.86(m,1h),4.68-4.63(m,1h),4.27(d,j=10.7hz,1h),3.91-3.92(m,2h),3.49(t,j=7.1hz,2h),3.11
–
3.04(m,1h),2.75
–
2.68(m,1h),2.50
–
2.18(m,3h),1.90
–
1.85(m,1h),1.78
–
1.48(m,11h),1.40
–
1.35(m,2h),1.22
–
1.18(m,1h),1.02(s,3h),0.87(d,j=7.2hz,3h).ms-esi(m/z):638.2(m+h)
+
.
[0075]
实施例10:地塞米松-21-(6-马来酰亚胺)正己基磷酸酯
[0076]
参照实施例8,化合物ⅲ与6-马来酰亚胺正丁醇进行反应,得白色固体。
[0077]1h nmr(500mhz,cd3od)δ7.42(d,j=10.1hz,1h),6.80(s,2h),6.30(d,j=10.1hz,1h),6.10(s,1h),4.94
–
4.70(m,2h),4.26(d,j=10.5hz,1h),3.91-3.92(m,2h),3.50(t,j=7.1hz,2h),3.11
–
3.04(m,1h),2.75
–
2.28(m,4h),1.91
–
1.85(m,1h),1.78
–
1.48(m,13h),1.40
–
1.25(m,3h),1.01(s,3h),0.87(d,j=7.2hz,3h).ms-esi(m/z):652.2(m+h)
+
.
[0078]
生物实施例1.体外抗肿瘤活性评价
[0079]
倒置显微镜下观察贴壁细胞的生长状态,当发现培养瓶中的细胞汇合度达到80%-90%时需要进行传代。吸弃瓶中培养液,加入1-2ml无菌pbs轻柔冲洗细胞,弃pbs,再加1ml 0.25%胰蛋白酶,轻晃培养瓶使其均匀覆盖到各处,片刻后弃去胰蛋白酶,放置培养箱中2~3min。镜下发现细胞变大变圆并间隙增大后,轻柔拍打培养瓶,加少量培养液使其终止消化。用移液器轻柔吹打细胞悬液使其分散均匀,按适当比例接种至细胞培养瓶中,每瓶加入约5ml新鲜培养基。按画“8”法使瓶内的细胞分散均匀,置于细胞培养箱中培养,2-3天后观察细胞密度及其生长状态。
[0080]
(1)mtt(5mg/ml)溶液配制:称量250mg mtt粉末,溶于50ml 1*pbs中混合均匀,于超净台中使用0.22μm微孔滤膜将溶液过滤,分装于棕色ep管中,-20℃保存。
[0081]
(2)mtt法检测化合物对肿瘤细胞的增殖抑制作用
[0082]
1)铺板:将对数生长期的aspc-1细胞、h460细胞、hepg2细胞、u266、hct116细胞、gem-r(吉西他滨耐药株)aspc-1用胰酶消化后收集、计数,按3000-5000/孔接种至96孔板中,放恒温置培养箱中24h。为防止边缘效应导致的影响,96孔板周边一圈仅加200μl无菌pbs。
[0083]
2)加药:根据实验要求,加入各浓度药物,同时设置空白对照组。每个浓度设三个复孔,除了药物的种类、浓度不同外,其余条件均相同。
[0084]
3)终止反应:药物作用一段时间之后,在超净台中,每孔加10μl mtt溶液,继续置于培养箱中培养4h,之后,用吸泵吸弃孔内液体,每孔加150μl dmso,震荡15min。酶标仪检测570nm波长处的吸光度值。
[0085]
4)计算细胞存活率
[0086]
表1.部分实施例化合物的体外抗肿瘤活性[ic
50
(μg/ml)]
[0087][0088]
gem-ra:吉西他滨耐药株
[0089]
可见,本专利化合物对6株实体瘤表现出明确的体外广谱活性,更为重要的是,它们对吉西他滨耐药株gem-r aspc-1仍敏感。
[0090]
生物实施例2.体内抗肿瘤活性评价
[0091]
将对数生长期细胞按细胞数1
×
106/只接种于balb/c小鼠的腋部皮下,待瘤块长到一定体积后,无菌条件下处理瘤块。将剥离得到的瘤块剪成1.5mm3左右大小均匀的小块,接种于balb/c小鼠腋部皮下,接种当天为第0天。瘤块长至200mm3左右时,按照瘤体积大小进行分组,每组6只balb/c小鼠,共分为6组:空白对照组、实施例1化合物3mg/kg(5mmol/kg)组、实施例4化合物3mg/kg(5mmol/kg)组、实施例8化合物3mg/kg(5mmol/kg)组、地塞米松2mg/kg(5mmol/kg)组和吉西他滨盐酸盐8.71mg/kg(30mmol/kg)组。其中吉西他滨盐酸盐组的给药方式为腹腔给药,1次/3天,共7次,其余给药方式为经尾静脉给药,5次/周,共3周15次。每周测量小鼠体重和瘤体积,绘制肿瘤的生长曲线。实验结束后,对小鼠行安乐死,剥离瘤块并称重,计算各组的肿瘤抑制率。
[0092]
表2.部分实施例化合物对h460(人大细胞肺癌细胞)裸鼠移植瘤的生长抑制作用
[0093][0094]
试验结果表明,1)除吉西他滨盐酸盐组有小鼠死亡(试验第5日和第7日各死亡1只)外,其余各组小鼠全部存活;2)与空白对照组相比,除吉西他滨盐酸盐组小鼠体重明显降低外,其余各治疗组小鼠体重无明显变化;3)3个实施例化合物治疗组的抑瘤率(质量)分别为80.36%、72.09%和69.35%,均显著大于等摩尔给药剂量的原药地塞米松组(20.9%)以及6倍摩尔给药剂量的阳性对照组-吉西他滨盐酸盐(42.94%)。可见,本发明实施例化合物对h460裸鼠移植瘤的体内疗效显著大于原药对照组和阳性对照组,而系统毒性则低于阳性对照组。
[0095]
部分实施例化合物对aspc-1(人转移胰腺癌细胞)裸鼠移植瘤的生长抑制作用的试验步骤同上,结果见表3.
[0096]
表3.部分实施例化合物对aspc-1(人转移胰腺癌细胞)裸鼠移植瘤的生长抑制作用
[0097]
[0098][0099]
试验结果表明,1)实施例7化合物和实施例9化合物治疗组具有剂量相关性;2)实施例7化合物和实施例9化合物治疗组的抑瘤率(质量)均显著大于原药地塞米松组;3)除实施例7化合物2.5mg/kg组外,其余5个治疗组的抑瘤率(质量)也大于阳性对照组-吉西他滨盐酸盐。
[0100]
以上实验证实,本发明的化合物可有效治疗实体瘤,如肺癌(表2)、胰腺癌(表3)。更为重要的是,作为“夺命癌王”的胰腺癌其死亡率很高,而其治疗药物很少且效果不佳。表3数据证实,本发明的化合物对胰腺癌的体内疗效优于胰腺癌的一线药物-吉西他滨,故本发明的化合物可能为胰腺癌的治疗提供另一种临床选择。
[0101]
尽管上述实验中,本发明只选取部分实施例进行实验测试,但是实际上,本发明的其他化合物也能取得和上述化合物相同或者相近的治疗效果。
[0102]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1