一种两性杯芳烃衍生物、包含其的复合催化剂及其应用的制作方法
1.本发明涉及一类两性杯芳烃衍生物、包含其的复合催化剂及其在丙酸甲酯制备中的应用。
背景技术:
2.丙酸甲酯是制备甲基丙烯酸甲酯关键中间体,现有制备工艺中,lucite公司采用经过优选的双叔丁基膦配体、钯(ii)盐和磺酸作为催化体系,高效率、高选择性地完成乙烯羰基化反应制备丙酸甲酯,是一种几乎无三废产生的绿色工艺,该技术的转化率和选择性几乎达到“酶”化学的水平(参考发明专利cn102741213、cn104011007及相关报道)。反应过程以甲醇作为反应物和溶剂,产物丙酸甲酯的分离和催化剂套用需要通过蒸馏或者精馏实现,相应地,增加了分离过程的设备投资和能量消耗,增加了成本。如果使用水相的催化体系,由于丙酸甲酯难溶于水,通过分液的方法简化工艺流程,对于进一步降低乙烯羰基化制备丙酸甲酯的成本具有重要意义。
3.目前,实现水相催化的方法主要是采用水溶性的配体,如三苯基膦三间磺酸钠盐、3-二叔丁基膦基丙磺酸、三环己基膦三氟甲烷磺酸、甲苯磺酸三叔丁基膦等,制备过程比较复杂,成本较高。或者采用胶束增溶的方法,通过分子间弱相互作用将难溶于水的膦配体分散到水相,优势在于扩大配体使用种类,减少配体制备、筛选和优化的过程。例如,b.s.takale等人报道,采用α-生育酚、聚乙二醇单甲醚(mpeg-750)及琥珀酸组成一种表面活性剂,可以在水中形成“纳米胶束”,负载ppm级的含钯催化剂后,可以在水相中进行suzuki-miyaura交叉偶联等反应(chem.sci.,2019,10,8825)。
4.通过结构分析,兼具亲水基团和芳香疏水结构的杯芳烃是一类具有发展潜力的两性分子。特点在于:第一,杯芳烃是通过亚甲基桥连的大环芳香化合物,三苯基膦、xantphos、binap等配体通常含有苯环、萘环等结构,与杯芳烃分子间存在π-π相互作用,或者pd等金属离子可以与杯芳烃发生阳离子-π作用,有利于通过协同作用提高增溶效果;第二,杯芳烃分子存在酚羟基,对苯环有活化作用,易于在杯芳烃的上缘(酚羟基对位)和下缘进行一系列修饰以实现目标功能,或者调控聚集形态以提高均相催化的选择性。目前,已有较多相关文献报道。如z.csok等人在杯[4]芳烃的酚羟基上修饰一系列膦或者磷酸酯作为配位,用于催化烯烃的羰基化反应,均表现出良好的化学选择性(journal of organometallic chemistry,1998,570,23
–
29)。s.shirakawa等人介绍使用磺化杯芳烃修饰膦配体用来代替tppps(三磺化三苯基膦)与铑配位,对于非端位的烯烃的氢甲酰化具有良好的选择性(new j.chem.,2001,25,777-779)。l.monnereau等人制备了杯[4]芳烃的1,3位下缘磷酸酯修饰的配体,在无溶剂条件下,对于烯烃的氢氨基乙烯基化(hydroaminovinylation)具有高的选择性(green chem.,2010,12,1670
–
1673)。
技术实现要素:
[0005]
技术目的
[0006]
本发明的一个技术目的是提供一类两性杯芳烃衍生物。
[0007]
本发明的另一技术目的是提供包含上述杯芳烃衍生物、金属盐、配体的复合催化剂。
[0008]
本发明的又一技术目的是提供所述复合催化剂在乙烯的甲氧基羰基化反应中的应用。
[0009]
技术方案
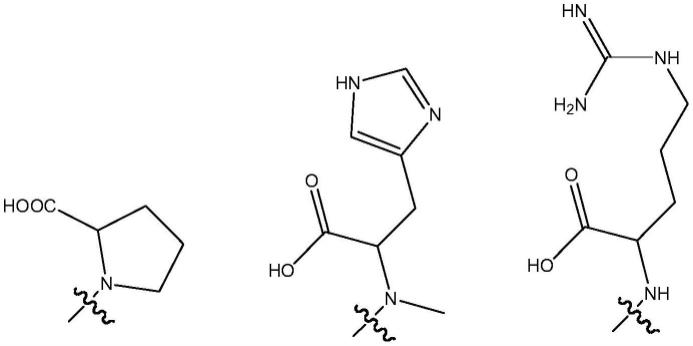
[0010]
一方面,本发明提供一种下式i所示的两性杯芳烃衍生物:
[0011][0012]
在上述结构中,m=2,3,4,表示m个单元连接形成环结构,
[0013]
在所述环结构中,r独立地选自氨基酸残基、磺酸基、硫酸基、磷酸基、羧基、氨基、胍基和聚醚,r1独立地选自c3-c12烷基。
[0014]
在具体实施方式中,m为2。
[0015]
在具体实施方式中,所述两性芳烃衍生物具有以下通式i-1所示的结构:
[0016][0017]
其中,r选自氨基酸残基、磺酸基、硫酸基、磷酸基、羧基、氨基、胍基和聚醚,优选地,为氨基酸残基,
[0018]
n为3-12的整数。
[0019]
关于n的选择,理论上,只有分子中疏水基足够大的两亲分子才显示其两性特征,一般来说碳链长度要大于8个碳原子,但是,如果疏水的碳原子链过长,则溶解度迅速下降,两性特征逐渐减少,通常的表面活性剂含有8
–
20个碳原子为宜,由于杯芳烃本身含有一个大的芳香疏水环体,相应地,其下缘取代碳原子的数量小于相应的链状表面活性剂分子。
[0020]
由于本技术中涉及的杯芳烃衍生物均为离子型两性化合物,因此,测定杯芳烃衍生物的cmc的方法为电导法。采用电导法测定cmc的基本原理为:对于溶于水的离子型两性化合物,当溶质浓度极低时,溶液的电导率变化规律类似强电解质,两性化合物在溶液中表现为完全解离,因此,溶液的电导率与溶质的浓度关系接近线性,当溶液中溶质浓度达到临界胶束浓度时,随着胶束形成,胶束定向移动速率减缓,造成溶液电导率与溶质的浓度的线性关系的斜率变小,出现明显的拐点,因此可以在拐点处计算出cmc的数值。本技术中一些两性杯芳烃衍生物的室温及反应温度的cmc值参见具体实施例。
[0021]
在具体实施方式中,氨基酸残基选自分别如下所示的衍生自脯氨酸、组氨酸和精氨酸的基团:
[0022]
在上述结构中的表示连接位置。
[0023]
在具体实施方式中,n为4、6或8。
[0024]
在具体实施方式中,所述两性杯芳烃衍生物选自以下化合物:
[0025][0026][0027]
另一方面,本发明提供上述两性杯芳烃衍生物的制备方法,所述方法为以下方法之一:
[0028]
方法一:两性杯芳烃衍生物中的r基团为脯氨酸残基,反应式如下,
[0029][0030]
所述方法包括以下步骤:
[0031]
1)使杯芳烃与式r
1-x表示的1-卤代烃反应生成杯芳烃的烷基化中间体;以及
[0032]
2)使步骤1)得到的中间体与脯氨酸和甲醛反应得到所述两性杯芳烃衍生物;
[0033]
上述步骤1)中,反应可以在例如碳酸钾的碱存在下,在例如乙腈或丙酮的溶剂中,在例如四丁基溴化铵的相转移催化剂存在下进行;
[0034]
上述步骤2)中,反应可以在例如四氢呋喃的溶剂中,在例如冰醋酸的催化剂存在下使用甲醛或者多聚甲醛水溶液进行;
[0035]
方法二:两性杯芳烃衍生物中的r基团为组氨酸或精氨酸残基,反应式如下,
[0036][0037]
所述方法包括以下步骤:
[0038]
1)使杯芳烃与式r
1-x表示的1-卤代烃反应生成杯芳烃的烷基化中间体;
[0039]
2)使步骤1)得到的中间体与氯化氢、甲醛或多聚甲醛反应生成氯甲基取代的杯芳烃烷基化中间体;以及
[0040]
3)使步骤2)得到的中间体与氨基酸甲酯反应,得到r为组氨酸或精氨酸残基的两性杯芳烃衍生物,
[0041]
上述步骤1)中,反应可以在例如碳酸钾的碱存在下,在例如乙腈或丙酮的溶剂中,在例如四丁基溴化铵的相转移催化剂存在下进行;
[0042]
上述步骤2)中,反应可以在例如冰醋酸的催化剂存在下使用甲醛或者多聚甲醛水溶液进行;
[0043]
上述步骤3)中,反应可以在例如碳酸钾的碱存在下,在例如二甲基甲酰胺的溶剂中,使用氨基酸甲酯盐酸盐进行;
[0044]
在以上两反应式中,m,r1的定义分别同权利要求1中所定义。
[0045]
另一方面,本发明提供一种复合催化剂,其为由金属盐、配体、上述两性杯芳烃衍生物以及去离子水组成的水相体系。
[0046]
在具体实施方式中,所述金属盐为钌盐、铑盐、钯(ii)盐、铂盐等,优选地,所述金属盐为钯(ii)盐,具体而言,其为对应阴离子为氯离子、硝酸根、醋酸根、三氟乙酸根的钯(ii)盐,优选地,所述钯(ii)盐为醋酸钯。
[0047]
在具体实施方式中,金属盐的加入量为1.0~10.0mmol/l,优选地,为1.0~2.0mmol/l。
[0048]
在具体实施方式中,所述配体是膦配体,可为单磷配体、双磷配体或多磷配体,结构通式为其中,p表示磷原子,o表示磷原子的个数,为1或2,x、y、z基团可以相同或者不同,并且各自独立地选自c6-c10芳基、直链或支链c1-c8烷基。从成本和使用效果两方面考虑,优选地,所述配体为1,2-双(二叔丁基膦甲基)苯。
[0049]
在具体实施方式中,金属盐的金属离子与配体的摩尔比为1:(4-10),优选地,摩尔比为1:(4-5)。
[0050]
在具体实施方式中,杯芳烃衍生物在水相体系中的加入量为其cmc值的1.5~50.0倍,优选为10~20倍。上述加入量可保证在不同反应温度下,两性杯芳烃衍生物均能起到良好的增溶效果。
[0051]
再一方面,本发明提供一种上述复合催化剂的制备方法,包括:将金属盐、配体以及上述两性杯芳烃衍生物在去离子水中混合。
[0052]
在具体实施方式中,所述混合可采用本领域中常见的方式进行,而没有限制,例如,可使用磁子搅拌进行混合。
[0053]
又一方面,本发明提供一种制备丙酸甲酯的方法,所述方法包括在上述复合催化剂存在下由乙烯、一氧化碳和甲醇反应制备丙酸甲酯的步骤。
[0054]
在具体实施方式中,在所述方法中,所述复合催化剂除水以外组分的总用量为甲醇投料质量的1~10%,优选为5~7%。
[0055]
在具体实施方式中,在所述方法中,所述复合催化剂与甲醇的质量比为2.0
–
20.0:1,优选为4:1。
[0056]
在具体实施方式中,在所述方法中,乙烯的分压为0.1~5.0mpa;一氧化碳的分压为0.1~5.0mpa;优选地,乙烯的分压为0.5~1.5mpa,一氧化碳的分压为0.5~1.5mpa。由于乙烯和一氧化碳在反应过程中存在协同和竞争两种关系,优选地,选择乙烯的分压与一氧化碳的分压一致,如果一氧化碳压力过大,易出现钯(ii)盐被还原为金属钯(0)的现象。
[0057]
在具体实施方式中,在所述反应中,反应温度为60~120℃,优选为80~100℃;反应时间为0.5~5h,优选为1~2h。
[0058]
在具体实施方式中,在所述反应中,反应体系的ph值为1~6,优选地,ph值为1.0,可用硫酸、对甲苯磺酸、醋酸等非氧化性酸调节反应体系的ph值,优选使用对甲苯磺酸调节反应体系的ph值。
[0059]
有益效果
[0060]
在本发明的复合催化剂中,作为催化剂活性中心的是钯(ii)盐和配体。两性杯芳烃衍生物在反应体系内聚集形成胶束,通过该聚集体的疏水相互作用,丰富的π-电子等,与钯(ii)盐和配体起到协同增溶的作用,在加速乙烯烷氧基羰基化反应的同时简化了反应的
后处理过程。
[0061]
本发明的一个优点是简化产品与催化剂的分离过程。众所周知,羰基化反应通常遇到的问题是产物与催化剂的分离,尤其对于高沸点产物或者稳定性较差的催化体系(platinum metals rev.,1988,32,179)。相应地,将钯-配体等催化剂溶于水,使用水作为溶剂,能够有效改善分离的效果,但遇到的另一个问题是原料烯烃在水中的传质,造成反应速率下降,副反应增加。因此,水相催化体系比较适用于较小分子(比如乙烯、丙烯等)的羰基化。因此,本技术的催化剂体系在乙烯的烷氧基羰基化制备丙酸甲酯中有较好的适用性。
[0062]
本发明的另一优点是简化配体的遴选。与现有技术相比,或者参考现有的水相催化体系,无需重新设计、制备和筛选配体,进而降低了配体制备成本。另外,该催化体系中对甲苯磺酸等用量少,减少对设备要求。
[0063]
总结上述,与现有的乙烯羰基化制备丙酸甲酯所用的催化体系相比,本技术的改进型复合催化剂体系具有以下优点:
[0064]
1)在催化乙烯的烷氧基羰基化反应中表现出高达98%以上的选择性、转化率;
[0065]
2)催化剂体系为水溶性体系,制备简单,反应结束后易于与产品分离,并实现多次回收利用;
[0066]
3)催化剂体系酸性低,对设备要求友好。
附图说明
[0067]
图1示意出本技术的乙烯烷氧基羰基化制备丙酸甲酯的工艺流程。
[0068]
图2为实施例11中得到的产品丙酸甲酯的气相色谱(gc)图。
[0069]
图3示出本技术制备的两性杯芳烃衍生物对钯(ii)-膦配体的增溶作用。
[0070]
图4示出表面活性剂十二烷基苯磺酸钠对钯(ii)-膦配体的增溶作用。
[0071]
图5示出在使用本技术的复合催化剂进行催化反应之后,反应体系静置后的照片。
具体实施方式
[0072]
为了进一步对本发明进行阐述,下面给出几个具体的实施例,然而,本发明的保护范围不局限于这些实施例。
[0073]
术语
[0074]
在本技术中,“氨基酸残基”仅指代氨基酸的氨基的氢离去后生成的残基。
[0075]
实施例1:杯芳烃衍生物p2c2-4的制备
[0076]
中间体1的制备:
[0077][0078]
在500ml的三口圆底玻璃烧瓶中放置磁力搅拌子,回流冷凝管和恒压滴液漏斗。随
后在烧瓶中加入42.4g(0.1mol)的杯[4]芳烃,69.0g(0.5mol)的研细的碳酸钾粉末和200ml的无水乙腈以及0.5g的四丁基溴化铵,在恒压滴液漏斗中加入34.3g(0.25mol)的1-溴丁烷。氮气置换,随后开启搅拌,加热至回流,开始慢慢滴加1-溴丁烷,滴加速度控制在6h滴加完毕。滴加完毕后,继续回流反应过夜。
[0079]
降温至室温,过滤反应液,滤饼用无水乙腈洗涤三次,合并滤液,减压除去大部分溶剂后,将残留物溶于乙酸乙酯并依次用1.0m的稀盐酸、饱和食盐水和水洗涤,有机相蒸馏出乙酸乙酯溶剂后,用柱色谱分离得到产物,流动相为石油醚(60
–
90℃)与乙酸乙酯,比例为体积比20:1,可得到白色固体产品36.5g,收率68%。1h-nmr(400mhz,cdcl3):δ8.13(s,2h),7.21(t,2h),7.05
–
7.08(m,6h),6.88(d,4h),4.41(d,4h),4.14(t,4h),3.55(d,4h),1.79(p,4h),1.34(m,4h),1.00(t,6h).
[0080]
p2c2-4的制备:
[0081][0082]
在100ml的圆底烧瓶中加入搅拌磁子。烧瓶中加入上一步反应的中间体1(5.36g,0.01mol),四氢呋喃25ml,3.45g(0.03mol)的脯氨酸,4ml去离子水,5.0ml的冰醋酸,0.5ml的甲醛水溶液(37%质量分数)。室温下,连续搅拌72h,过滤,滤饼用丙酮洗涤三次,通过水-乙醇-丙酮重结晶。得到白色粉末状产品,计4.7g,收率为59.5%。经电导法测定,其在20℃下的cmc为1.1mm。1h-nmr(400mhz,d2o):δ7.23(t,2h),7.05
–
7.08(m,4h),6.98(d,4h),4.16(t,4h),4.10
–
3.72(m,broad,12h),3.23(t,2h),2.40-2.30(t,4h),1.99
–
1.35(m,16h),0.93(t,6h).
[0083]
实施例2:杯芳烃衍生物h2c2-4的制备
[0084]
中间体2的制备:
[0085][0086]
在100ml的圆底烧瓶中,加入5.36g(0.01mol)的中间体1,加入0.90g(30mmol)的多
聚甲醛和40ml的冰醋酸。随后反应瓶内通入氯化氢气体1h,得到的混合物在室温下继续搅拌6h,得到的产品从反应液中析出,过滤,滤饼依次用稀盐酸-盐水-去离子水洗涤,干燥,使用二氯甲烷-甲醇重结晶,得到白色固体4.2g,收率67%。1h-nmr(400mhz,cdcl3):δ8.03(s,2h),7.18(s,4h),6.67-6.93(m,6h),4.57(s,4h),4.36(d,4h),4.02(t,4h),3.64(d,4h),1.79(m,4h),1.33(m,4h),1.00(t,6h).
[0087]
h2c2-4的制备:
[0088][0089]
在50ml的圆底烧瓶中,加入2.42g(0.01mol)的组氨酸甲酯盐酸盐,7.0g(0.05mol)的碳酸钾粉末和15ml的dmf,混合物在室温下搅拌30min,随后加入2.0g(0.003mol)的中间体2,氮气保护下,反应体系加热至80-90℃,持续反应24h。反应结束后,加入100ml的去离子水,过滤,滤饼用水洗涤3次,将滤饼悬浮于20%的氢氧化钠溶液30ml中,加入甲醇10ml,60℃下反应24h,反应结束后,加入稀盐酸调节体系ph值至6.0,得到大量沉淀,过滤,滤饼用水洗涤3次,干燥得到目标产物1.5g,收率55%。经电导法测定,其在20℃下的cmc为0.98mm。1h-nmr(400mhz,d2o-dcl):δ8.73(s,2h),7.68(s,2h),7.19(t,2h),6.83(m,8h),4.36(d,4h),4.07(t,4h),3.90
–
3.72(m,6h),3.64(d,4h),2.77(d,4h),1.79(m,4h),1.43(m,4h),1.00(t,6h).
[0090]
实施例3:杯芳烃衍生物a2c2-4的制备
[0091]
a2c2-4的制备:
[0092][0093]
制备方法与h2c2-4相同,不同之处仅在于将原料组氨酸甲酯盐酸盐替换为精氨酸甲酯盐酸盐,产品为白色易吸湿的粉末,收率为35%。经电导法测定,其在20℃下的cmc为8.3mm。1h-nmr(400mhz,d2o-dcl):δ7.20(t,2h),7.10(d,4h),6.94(d,6h),4.40(d,4h),4.05(t,4h),3.84(s,4h),3.62(d,4h),3.40(t,2h),3.31(t,4h),1.70
–
1.50(m,16h),0.95(t,6h).
[0094]
实施例4:杯芳烃衍生物p2c2-6的制备
[0095]
中间体3的制备:
[0096][0097]
制备方法参考中间体1的制备,原料为杯[4]芳烃和1-溴己烷。产物为白色固体,收率80%。1h-nmr(400mhz,cdcl3):δ8.13(s,2h),7.22(t,2h),7.06
–
7.08(m,6h),6.88(d,4h),4.44(d,4h),4.20(t,4h),3.58(d,4h),1.79(p,4h),1.35
–
1.10(m,6h),0.98(t,6h).
[0098]
p2c2-6的制备:
[0099][0100]
制备方法参考p2c2-4的制备,原料为中间体3和脯氨酸。产物为白色粉末,收率50%。经电导法测定,其在20℃下的cmc为0.78mm。1h-nmr(400mhz,d2o-dcl):δ7.17(t,2h),6.83-6.60(m,8h),4.40(d,4h),4.18(t,4h),3.70(t,2h),3.60(d,4h),3.05(m,8h),1.77
–
1.50(m,12h),1.40(p,4h),1.35
–
1.10(m,6h),0.98(t,6h).
[0101]
实施例5:杯芳烃衍生物h2c2-6的制备
[0102]
中间体4的制备:
[0103][0104]
制备方法与中间体2类似,不同之处仅在于用中间体3替换中间体1,收率60%。1h-nmr(400mhz,cdcl3):δ8.03(s,2h),7.17(s,4h),6.70-6.90(m,6h),4.57(s,4h),4.36(d,4h),4.02(t,4h),3.64(d,4h),1.79(m,4h),1.40(p,4h),1.35
–
1.10(m,6h),0.99(t,6h).
[0105]
h2c2-6的制备:
[0106][0107]
制备方法与h2c2-4类似,不同之处仅在于用中间体4替换中间体2,收率60%。经电导法测定,其在20℃下的cmc为0.60mm。1h-nmr(400mhz,d2o-dcl):δ8.73(s,2h),7.65(s,2h),7.25(t,2h),6.90(m,8h),4.36(d,4h),4.06(t,4h),3.90
–
3.70(m,6h),3.65(d,4h),2.77(d,4h),1.76(m,4h),1.50
–
1.30(m,8h),0.89(t,6h).
[0108]
实施例6:杯芳烃衍生物a2c2-6的制备
[0109]
a2c2-6的制备:
[0110][0111]
制备方法参照a2c2-4,不同之处仅在于用中间体4替换中间体2,收率为40%。经电导法测定,其在20℃下的cmc为8.4mm。1h-nmr(400mhz,d2o-dcl):δ7.20(t,2h),7.08(d,4h),6.93(d,6h),4.40(d,4h),4.05(t,4h),3.86(s,4h),3.65(d,4h),3.40(t,2h),3.30(t,4h),1.75
–
1.30(m,24h),0.85(t,6h).
[0112]
实施例7:杯芳烃衍生物p2c2-8的制备
[0113]
中间体5的制备:
[0114][0115]
制备方法参考中间体1的制备,原料为杯[4]芳烃和1-溴代正辛烷。产物为白色固体,收率80%。1h-nmr(400mhz,cdcl3):δ7.20(t,2h),7.08(t,2h),6.80
–
6.60(m,8h),4.37(d,4h),4.07(t,4h),3.64(d,4h),1.74(t,4h),1.60-1.30(m,24h),0.80(t,6h).
[0116]
p2c2-8的制备:
[0117][0118]
制备方法参考p2c2-4的制备,原料为中间体5和脯氨酸。产物为可溶于水的白色粉末,收率70%。经电导法测定,其在20℃下的cmc为0.55mm。δ7.17(t,2h),6.80-6.60(m,8h),4.40(d,4h),4.18(t,4h),3.70(t,2h),3.60(d,4h),3.05(m,8h),1.77
–
1.50(m,12h),1.40(p,4h),1.35
–
1.10(m,20h),0.98(t,6h).
[0119]
实施例8:杯芳烃衍生物h2c2-8的制备
[0120]
中间体6的制备:
[0121][0122]
制备方法与中间体2类似,收率60%。1h-nmr(400mhz,cdcl3):δ8.03(s,2h),7.17(s,4h),6.70-6.90(m,6h),4.57(s,4h),4.36(d,4h),4.02(t,4h),3.64(d,4h),1.79(m,4h),1.40(p,4h),1.35
–
1.10(m,20h),0.80(t,6h).
[0123]
h2c2-8的制备:
[0124][0125]
制备方法与h2c2-4类似,不同之处仅在于用中间体6替换中间体2,收率65%。经电导法测定,其在20℃下的cmc为0.61mm。1h-nmr(400mhz,d2o-dcl):δ8.73(s,2h),7.66(s,2h),7.15(t,2h),6.89(m,8h),4.36(d,4h),4.07(t,4h),3.90
–
3.72(m,6h),3.64(d,4h),2.77(d,4h),1.76(m,4h),1.44
–
1.26(m,16h),0.89(t,6h).
[0126]
实施例9:杯芳烃衍生物a2c2-8的制备
[0127]
a2c2-8的制备:
[0128][0129]
制备方法与a2c2-4相同,不同之处仅在于用中间体6替换中间体2,收率为60%。经电导法测定,其在20℃下的cmc为5.1mm。1h-nmr(400mhz,d2o-dcl):δ7.21(t,2h),7.09(d,4h),6.93(d,6h),4.44(d,4h),4.05(t,4h),3.86(s,4h),3.65(d,4h),3.40(t,2h),3.30(t,4h),1.78
–
1.30(m,32h),0.87(t,6h).
[0130]
实施例10:p2c2-4参与的乙烯烷氧基羰基化
[0131]
在100ml的衬四氟高压釜中,加入40ml的去离子水,500mg的p2c2-4(为了保证p2c2-4胶束的形成,过量>10倍cmc,以下实施例相同),室温下搅拌2h,随后加入10g的甲醇,11.2mg的醋酸钯(计为1.0mmol/l),78.8mg的1,2-双(二叔丁基膦甲基)苯(4.0mmol/l),随后,使用对甲苯磺酸调节反应体系的ph值至1.0.封闭反应釜,氮气置换,分别充入1.0mpa的乙烯和1.0mpa的一氧化碳。开启搅拌,反应釜升温至95
±
2℃,反应1h,反应结束后,降至室温,泄压,打开反应釜,将反应液倾出,静置分液,上层为目标产物丙酸甲酯,通过gc确定产品含量,下层为含有复合催化剂的水相,水相通过gc确定甲醇残留量后可以直接套用。由于反应过程保证甲醇完全转化,因此,转化率是以甲醇为基础加以计算的。
[0132]
甲醇转化率的计算公式:
[0133][0134]
产物选择性计算公式:
[0135][0136]
其中,m
甲
——反应投入的甲醇质量(g);
[0137]m残
——水相及丙酸甲酯中残留的甲醇总质量(g);
[0138]m丙
——反应得到的丙酸甲酯的质量(g)。
[0139]
实施例11:p2c2-6参与的乙烯烷氧基羰基化
[0140]
投料比例,投料量、反应条件及操作方法参考实施例10,不同之处仅在于用p2c2-6替换p2c2-4。
[0141]
实施例12:p2c2-8参与的乙烯烷氧基羰基化
[0142]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用p2c2-8替换p2c2-4。
[0143]
实施例13:h2c2-4参与的乙烯烷氧基羰基化
[0144]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用h2c2-4替换p2c2-4。
[0145]
实施例14:h2c2-6参与的乙烯烷氧基羰基化
[0146]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用h2c2-6替换p2c2-4。
[0147]
实施例15:h2c2-8参与的乙烯烷氧基羰基化
[0148]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用h2c2-8替换p2c2-4。
[0149]
实施例16:a2c2-4参与的乙烯烷氧基羰基化
[0150]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用a2c2-4替换p2c2-4。
[0151]
实施例17:a2c2-6参与的乙烯烷氧基羰基化
[0152]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用a2c2-6替换p2c2-4。
[0153]
实施例18:a2c2-8参与的乙烯烷氧基羰基化
[0154]
投料比例、投料量、反应条件及操作方法参考实施例10,不同之处仅在于用a2c2-8替换p2c2-4。
[0155]
实施例10-18中得到的产品量、甲醇的转化率和选择性参见下表1。
[0156]
表1乙烯羰基化制备丙酸甲酯的转化率与选择性
[0157]
实施例得到产品量(g)甲醇残余量(g)甲醇转化率%反应选择性%实施例1025.970.209896.4实施例1127.030.109999.3实施例1226.070.209896.7实施例1326.770.1298.898.5实施例1425.540.109993.8实施例1525.510.309795.6实施例1624.400.1298.889.8实施例1724.480.49692.7实施例1826.070.29896.7
[0158]
从以上实验结果可以看出,本技术的复合催化剂在催化乙烯羰基化的反应中,表现出较高的转化率和选择性。
[0159]
实施例19:p2c2-6参与的乙烯烷氧基羰基化的催化剂体系套用
[0160]
以转化率和选择性均较高的p2c2-6为例,进行催化剂体系的套用实验。
[0161]
实施例11的反应结束后,分离出产品,将在含有复合催化剂的水相重新投入反应釜,加入与实施例10相同的甲醇,并测定体系的ph,如ph增大,则补加少量对甲苯磺酸调节ph至1.0.反应条件参考实施例10.。
[0162]
重复上述操作6次,即催化剂体系套用6次,合计使用了7次。套用催化剂的收率和选择性见表2。
[0163]
表2p2c2-6催化剂体系回收套用的转化率与选择性汇总
[0164][0165][0166]
实施例20:两性杯芳烃衍生物形成的胶束或者聚集体对钯(ii)-配体的增溶效果的对照试验
[0167]
在本实施例中,进行了两性杯芳烃衍生物的增溶效果对照试验。
[0168]
如图3所示,图3中的左侧试管中加入去离子水、醋酸钯和1,2-双(二叔丁基膦甲基)苯,由于配体不溶于水,得到浑浊的悬浮液,再加入两性杯芳烃衍生物后,通过胶束的增溶作用,得到无色、澄清、透明、稳定的均一的溶液,如图3右侧试管所示。
[0169]
进而,为了说明本技术采用的杯芳烃衍生物的增溶作用的独特性,发明人使用常用的表面活性剂进行了对比。如图4所示。在与上述实验相同的条件下,图4左侧试管中加入去离子水、醋酸钯和1,2-双(二叔丁基膦甲基)苯,由于配体不溶于水,得到浑浊的悬浮液,作为对比,加入市售的十二烷基苯磺酸钠,如图4右侧试管所示,增容效果不明显。
[0170]
甲醇的存在对催化体系中杯芳烃衍生物cmc的影响是比较小。由于反应体系中存在的甲醇对杯芳烃衍生物形成胶束的插入,形成混合胶束,相应的cmc会减少,即甲醇的存在可使杯芳烃衍生物在更低浓度下形成胶束。参考k.shinoda的研究工作,醇分子的存在对于离子型表面活性剂cmc的影响表现在如下几个方面:1)脂肪醇的浓度与表面活性剂cmc呈线性关系,即醇的浓度越高,cmc越小;2)脂肪醇碳数与表面活性剂的cmc呈负相关,即更高级的醇会使cmc降低更多(j.phys.chem.1954,58,1136
–
1141)。因此,本发明中,无论是反应过程中还是反应结束后,只要确保在各段反应温度下,反应体系中的两性杯芳烃衍生物的浓度始终在其cmc之上,就能够持续形成胶束,并有效增溶钯(ii)-配体。进而确保了在反应结束后,反应体系内的钯(ii)-配体绝大部分通过杯芳烃衍生物形成胶束的增溶作用而留在水相中,既减少钯(ii)盐的流失,又可以简化分离过程。如图5所示,反应结束后,取出少
量反应液静置,上层为产品丙酸甲酯,下层为反应体系中的水相,保持澄清透明,无明显的固体析出。发明人对上层的丙酸甲酯进行了icp分析,数据表明钯(ii)离子的溶出量低于检测限,进一步说明了钯(ii)-配体保留在水相中,可以直接套用(如实施例19所证实),保证了本技术技术方案的可行性。
[0171]
综上,本技术中由于使用了水体系,降低了反应后的分离成本。另外,能够继续沿用现有技术及市售相关的配体,进一步节约了配体遴选的成本,且本技术的催化剂体系制备方法简单,成本低,效果好,便于回收再利用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1