一种鉴定体外培养的DP细胞的标志物组合及其应用的制作方法
一种鉴定体外培养的dp细胞的标志物组合及其应用
技术领域
1.本发明属于分子生物技术领域,具体涉及一种鉴定体外培养的dp细胞的标志物组合及其应用。
背景技术:
2.正常的毛囊(hair follicle,hf)不断经历生长期,退化期和休止期。毛乳头细胞(dermal papilla cells,dpcs)被认为是一种独特的间充质干细胞,具有自体干细胞治疗的潜力,位于毛囊底端的毛球部,被真皮鞘和毛母质细胞包绕。
3.dpcs作为hf的信号中心,在调节毛发生长、形成和循环中发挥重要作用。体外分离毛乳头细胞时,由于毛乳头的解剖位置特别,同时生物学特征明显,因此毫无杂质的毛乳头的提取十分困难,污染风险高,导致其后的生长的细胞纯度会被影响,存在较多杂细胞。因此,对于体外培养的dp细胞进行鉴定对于其后的应用研究至关重要。
4.目前,体内组织dp细胞的鉴定方法比较成熟。细胞离体后,失去了神经体液的调节和细胞间的相互影响,生活在缺乏动态平衡的相对稳定环境中,易发生分化现象减弱、形态功能趋于单一化、发生转化获得不死性种种转变。虽然体外细胞与机体细胞存有差异,但并未失去研究的意义。离体细胞仍带有全套的二倍体基因。细胞在培养中的表现,只不过是相应基因关闭与开启引起的现象,这并非是绝对缺陷。恰恰相反,在培养的细胞中某些特定功能的丧失,可为这类基因的表达与调控提供线索。但目前对于体外培养dp细胞,没有成熟的鉴定方法用于有效鉴别,因此迫切需要开发一种能够准确且快速鉴定dpcs的方法以支持体外dpcs应用前的鉴定。
技术实现要素:
5.本发明的目的在于提供一种鉴定体外培养的dp细胞的标志物组合及其应用,以解决或改善dp细胞体外鉴定的问题。
6.为了实现上述目的,本发明提供如下技术方案:一种鉴定体外培养的dp细胞的标志物组合,所述标志物包括hes1基因、tinagl1基因和il1b基因。
7.本发明还提供了一种如上所述的鉴定体外培养的dp细胞的标志物组合的应用,其采用下述技术方案:如上所述的标志物组合在从毛囊组织中体外分离培养dp细胞中的应用。
8.本发明还提供了一种体外培养的dp细胞鉴定试剂,其采用下述技术方案:一种体外培养的dp细胞鉴定试剂,所述试剂包括用于检测hes1基因、tinagl1基因和il1b基因中的至少一种的引物。
9.本发明的dp细胞鉴定试剂的优选方案中,用于检测hes1基因的引物为:
10.hes1-f:5
’‑
caagctggagaaggcggaca-3’;
11.hes1-r:5
’‑
tcggtacttccccagcacact-3’;
12.用于检测tinagl1基因的引物为:
13.tinagl1-f:5
’‑
ggccagagagataccgccgg-3’;
14.tinagl1-r:5
’‑
atgcggaagtggcccctctc-3’;
15.用于检测il1b基因的引物为:
16.il1b-f:5
’‑
ccgcgtcagttgttgtggcc-3’;
17.il1b-r:5
’‑
agtcccggagcgtgcagttc-3’。
18.本发明还提供了一种dp细胞鉴定试剂盒,其采用下述技术方案:一种dp细胞鉴定试剂盒,所述试剂盒包括如上所述的试剂。
19.本发明还提供了一种dp细胞鉴定方法,其采用下述技术方案:一种dp细胞鉴定方法,通过检测hes1基因、tinagl1基因和il1b基因中相对于管家基因的表达水平,判断体外培养的细胞是否为dp细胞。
20.本发明的dp细胞鉴定方法的优选方案中,所述hes1基因、tinagl1基因和il1b基因中的至少一种的表达水平采用real-time rt-pcr检测得到。
21.本发明的dp细胞鉴定方法的优选方案中,判断体外培养dp细胞的依据为
△
ct值;dp细胞的
△
ct值满足下述标准:hes1基因的
△
ct值≤11.8、tinagl1基因的
△
ct值≤11.2和il1b基因的
△
ct值≤4.4;所述
△
ct值按照下述方法计算得到:待测基因的ct值-管家基因的ct值;所述管家基因为gapdh基因。
22.本发明的dp细胞鉴定方法的优选方案中,检测gapdh基因的引物为:
23.gapdh-f:5
’‑
agccacatcgctcagacacc-3’;
24.gapdh-r:5
’‑
gtactcagcgccagcatcg-3’。
25.有益效果:
26.发明人通过试验首次发现了可以用于鉴定dp细胞的生物标志物hes1、tinagl1和il1b基因,试验验证通过检测hes1、tinagl1和il1b基因的相对表达水平可以实现体外培养的dp细胞的鉴定。
27.本发明的dp细胞鉴定方法简单易行、成本低,通过开发和研制dp细胞的鉴定产品,可以方便快速、准确、大批量地鉴定体外培养的dp细胞,对临床治疗等应用具有重要意义,填补了现有技术中相关内容的空白。
附图说明
28.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。其中:
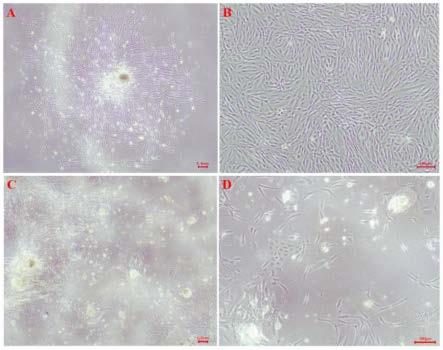
29.图1为本发明实施例提供的原代分离的dp细胞和低纯度dp细胞的细胞形态显微镜图;其中,图1a(0.1mm)和1b(100μm)为原代分离的dp细胞形态图;图1c(0.1mm)和1d(100μm)为原代分离的低纯度dp细胞形态图;
30.图2为原代分离得到的dp细胞和低纯度dp细胞的碱性磷酸酶(alp)免疫荧光实验结果对比图;从上到下依次为gfp荧光照片;核染的dapi荧光照片;前两者叠加后的荧光照片;
31.图3为筛选出的dp细胞鉴定特征基因的rna seq结果图;
32.图4为扩增产物的琼脂糖凝胶电泳图;其中,
②
为il1b基因pcr产物电泳图、
③
为tinagl1基因pcr产物电泳图、
⑤
为hes1基因pcr产物电泳图。
具体实施方式
33.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
34.本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
35.除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
36.下面将结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
37.本发明针对目前存在的dp细胞体外鉴定的效果有待进一步提高的问题,提供一种鉴定体外培养的dp细胞的标志物组合,本发明实施例提供的鉴定体外培养的dp细胞的标志物组合包括hes1基因、tinagl1基因和il1b基因。
38.其中,hes1基因(hes family bhlh transcription factor 1,gene id:3280),hes1基因属于前神经元碱性螺旋-环-螺旋(proneural basic helix-loop-helix,bhlh)基因家族,bhlh是一组转录因子,参与细胞的分化。hes1作为notch蛋白的下游靶基因,将notch信号下传,可使多种不成熟细胞维持在未分化状态,调节细胞对分化诱导因子的反应,维持未分化细胞数量上的稳定使干细胞处于增殖状态。
39.tinagl1基因(tubulointerstitial nephritis antigen like 1,gene id:64129),重组人肾小管间质性肾炎抗原样蛋白1(tinagl1)可以抑制两种主要信号通路:表皮生长因子受体(egfr)和整合素(integrin)通路,其中egfr基因突变可导致egfr信号传导活性飙升,进而向细胞发送促生长信号,而整合素信号通路则参与调节细胞向新位置的迁移,与其它细胞的粘附。
40.il1b基因(interleukin 1 beta,gene id:3553),il-1b作为一种关键的促炎细胞因子,参与多种自身免疫性炎症反应和多种细胞活动,包括细胞增殖、分化和凋亡。il-1b对几乎所有组织的细胞防御和组织修复至关重要,与疼痛、炎症和自身免疫有关。il-1b也参与神经保护、组织重塑和修复。
41.发明人通过试验发现,相比于低纯度dp细胞(“低纯度dp细胞”是指从毛囊细胞中分离培养dp细胞时,含有大量除dp细胞以外的细胞;例如,角质细胞、免疫细胞、血管细胞等),原代dp细胞具有更高的hes1基因、tinagl1基因、il1b基因表达量,而hes1基因、tinagl1基因、il1b基因的表达与干细胞的增殖、细胞的增殖、组织修复和重塑有关,进一步确定了可以用于鉴定dp细胞的生物标志物hes1基因、tinagl1基因、il1b基因,试验验证通过检测hes1基因、tinagl1基因、il1b基因的相对表达水平可以鉴定体外培养的dp细胞。
42.试验结果表明,hes1基因、tinagl1基因、il1b基因在dp细胞中相较于低纯度dp细胞均为高表达。适合作为鉴定dp细胞的生物标志物。
43.本发明还提出了一种如上所述的标志物组合的应用,本发明实施例中,如上所述的标志物组合在从毛囊组织中体外分离培养dp细胞中的应用。
44.本发明还提出了一种体外培养的dp细胞鉴定试剂,本发明实施例的试剂包括用于检测hes1基因、tinagl1基因和il1b基因中的至少一种的引物。
45.本发明优选实施例中,用于检测hes1基因的引物为:
46.hes1-f:5
’‑
caagctggagaaggcggaca-3’;
47.hes1-r:5
’‑
tcggtacttccccagcacact-3’。该用于检测hes1基因的引物的特异性好,灵敏度高,可以准确检测hes1基因的表达水平。
48.本发明优选实施例中,用于检测tinagl1基因的引物为:
49.tinagl1-f:5
’‑
ggccagagagataccgccgg-3’;
50.tinagl1-r:5
’‑
atgcggaagtggcccctctc-3’。该用于检测tinagl1基因的引物的特异性好,灵敏度高,可以准确检测tinagl1基因的表达水平。
51.本发明优选实施例中,用于检测il1b基因的引物为:
52.il1b-f:5
’‑
ccgcgtcagttgttgtggcc-3’;
53.il1b-r:5
’‑
agtcccggagcgtgcagttc-3’。该用于检测il1b基因的引物的特异性好,灵敏度高,可以准确检测il1b基因的表达水平。
54.本发明还提出了一种dp细胞鉴定试剂盒,本发明实施例的dp细胞鉴定试剂盒包括如上所述的试剂。
55.本发明还提出了一种dp细胞鉴定方法,本发明实施例的dp细胞鉴定方法:通过检测hes1基因、tinagl1基因和il1b基因相对于管家基因的表达水平,判断体外培养的细胞是否为dp细胞。本发明的用于鉴定体外培养dp细胞的方法,通过特异性检测待鉴定细胞内hes1基因、tinagl1基因、il1b基因的相对表达水平判定待鉴定细胞是否为dp细胞。该方法可以在dp细胞、低纯度dp细胞组成的待鉴定细胞组中准确鉴定出dp细胞,这对dp细胞的定性和临床应用具有重要意义。
56.本发明的鉴定方法简单易行、成本低,通过开发和研制体外培养的dp细胞的鉴定产品,可以方便快速、准确、大批量地鉴定dp细胞,对临床治疗等应用具有重要意义,填补了现有技术中相关内容的空白。
57.本发明优选实施例中,hes1基因、tinagl1基因和il1b基因中的至少一种的表达水平采用real-time rt-pcr检测得到。通过利用real-time rt-pcr进行检测,可以实时定量检测目标基因的含量。
58.本发明优选实施例中,判断体外培养dp细胞的依据为
△
ct值;dp细胞的
△
ct值满足下述标准:hes1基因的
△
ct值≤11.8、tinagl1基因的
△
ct值≤11.2和il1b基因的
△
ct值≤4.4;
△
ct值按照下述方法计算得到:待测基因的ct值-管家基因的ct值。
59.本发明优选实施例中,管家基因为gapdh基因。
60.本发明优选实施例中,检测gapdh基因的引物为:
61.gapdh-f:5
’‑
agccacatcgctcagacacc-3’;
62.gapdh-r:5
’‑
gtactcagcgccagcatcg-3’。
63.下面通过具体实施例对本发明的鉴定体外培养的dp细胞的标志物及其应用进行详细说明。
64.下面实施例中,所使用的试剂见下表1:
65.表1
[0066][0067][0068]
实施例1原代dp细胞体外分离培养
[0069]
将皮肤组织或毛囊组织用pbs清洗3次(皮肤组织用手术刀将表皮部分尽量切除),用显微镊将毛囊完整剥离放入装有amniomax(人羊水细胞完全培养基)培养基的培养皿中;
[0070]
在培养皿中加入5滴amniomax培养基,每个液滴放入2根毛囊,用1ml注射器将毛囊毛乳头切割下来,左手用注射器针头固定毛囊头部外面的真皮鞘,右手用注射器针头戳毛囊头部正中将毛囊头部翻转过来,沿凹陷处将毛乳头部分切下来,用针头将毛乳头固定在孔板上。沿壁缓慢加入2ml培养基(勿将毛乳头吹起来)。剩余部分为低纯度dp细胞(低纯度dp细胞中dp细胞的含量少),同样沿壁缓慢加入2ml培养基进行原代细胞分离培养。第四天换液,后续每四天换液。细胞观察:从二氧化碳培养箱中取出需传代的细胞,在显微镜下观察细胞生长情况,并随机选取2个视野分别使用低倍镜和高倍镜拍照,细胞密度达80%-90%确认可以进行传代。
[0071]
细胞消化:将培养瓶用含有酒精的无尘布擦拭外表面,传入生物安全柜中。轻轻前后摇晃培养瓶,使用移液管将旧培养基去掉。使用适量pbs清洗细胞表面1次,向每个培养瓶中加入适量消化酶,在室温条件下消化3-10min。轻轻摇晃后肉眼观察细胞呈流沙状,显微镜下观察,细胞呈球状后表明消化完全。加入适量终止液终止消化,液体转入50ml离心管,加入适量pbs冲洗培养瓶,液体转入50ml离心管中,放置在离心机中离心。离心参数400g,
5min。
[0072]
细胞接种培养:离心结束后,弃上清(得到原代分离的dp细胞和低纯度dp细胞)。
[0073]
使用完全培养基对原代分离得到的dp细胞进行重悬,取20μl进行计数。根据所得计数结果,按照8000-20000cells/cm2的密度接种至培养瓶。置于37℃,5.0%二氧化碳培养箱中传代培养。依次分别得到p3代细胞和p5代细胞。
[0074]
实施例2原代分离的dp细胞和低纯度dp细胞的细胞形态观察
[0075]
在倒置显微镜下观察原代分离的dp细胞和低纯度dp细胞的细胞形态,结果如图1所示,原代分离得到的dp细胞:细胞形态均一,且符合dp细胞典型特征,细胞呈梭形,且形态统一性较高,细胞呈旋涡状、束状或放射状排列,贴壁细胞主要为梭形的成纤维样。原代分离得到的低纯度dp细胞形态散乱不均一,既有梭形成纤维状细胞,也有铺路石样细胞,并不符合dp细胞典型特征。
[0076]
实施例3 alp免疫荧光鉴定
[0077]
细胞铺板:将培养的原代细胞(每孔1
×
104细胞)接种在24孔板中并培养至大约30%汇合度(约2天左右),设置复孔。
[0078]
固定:细胞去培养基后用pbs洗1次,用4%多聚甲醛室温固定10分钟,固定后pbs清洗3次,每次浸泡5分钟。
[0079]
封闭:每孔加入1ml pbs(含3%bsa/0.1%triton)室温封闭1小时。加一抗:弃封闭液后加入稀释的alp一抗(用pbs/3%bsa稀释),4℃过夜孵育,pbs清洗3次,每次5分钟。
[0080]
加二抗:加入稀释的二抗室温避光孵育1小时,pbs清洗3次,每次5分钟。
[0081]
dapi核染:用dapi染液室温染核5分钟。
[0082]
观察拍照:使用配备数码相机的荧光显微镜捕获图像。
[0083]
如图2所示,原代分离的dp细胞与低纯度dp细胞相比,alp免疫荧光强度更高,符合dp细胞的alp染色特征。
[0084]
实施例4原代分离得到的dp细胞和低纯度dp细胞的rnaseq检测
[0085]
对根据实施例1分离的,根据实施例2和3筛选的原代dp细胞和低纯度dp细胞的三批体外分离培养的的原代dp细胞和低纯度dp细胞进行rnaseq检测。
[0086]
根据rna seq得到的检测结果筛选出dp细胞相对于低纯度dp细胞特异性高表达且和生发功能相关的特征基因;
[0087]
结果如图3所示,下表2为rna seq结果图中高表达基因的功能分类,根据rna seq得到的检测结果筛选出dp细胞相对于低纯度dp细胞特异性高表达且和生发功能相关的特征基因,发现基因hes1、tinagl1、il1b在三批dp原代细胞中均高表达,且基因与细胞增殖和组织修复相关。
[0088]
表2rna seq结果图中高表达基因的功能分类
[0089][0090]
实施例5针对筛选出的高表达特征基因设计引物并进行引物筛选
[0091]
原代dp细胞样本进行总rna提取,rna抽提步骤如下:
[0092]
1)将细胞悬液转移至1.5ml ep离心管,500g
×
5min离心后尽弃上清。加入1ml trizol,用移液枪反复吹打15次使细胞完全裂解。
[0093]
2)加入200μl氯仿剧烈震荡直至呈乳白色,室温静置2min。
[0094]
3)放入低温高速离心机,4℃,13800g,离心15min。
[0095]
4)离心完毕后,取出ep管后发现管内液体分三层,小心移取上层液体至新的1.5ml ep管中。
[0096]
5)在新的ep管中加入冷的500μl异丙醇,上下颠倒使rna析出。
[0097]
6)放入低温高速离心机4℃,13800g,离心10min。
[0098]
7)弃掉上清,用500μl的75%乙醇混匀,于4℃,13800g,离心3min。
[0099]
8)弃掉上清,室温挥发掉酒精,用20μl depc水溶解rna。
[0100]
将原代dp细胞样本rna反转录成cdna,实验步骤如下:
[0101]
1)cdna第一链合成
[0102]
pcr仪65℃预热,在冰上按照下表在每个pcr管中配制反应体系,反应体系如下表3所示:
[0103]
表3
[0104]
模板rna总rna2μg引物random primer1μl水depc treated h2oup to 12μl总体积/12μl
[0105]
将反应管混合,短暂离心,放入预热好的pcr仪中,65℃,5min,立刻放回冰上。
[0106]
2)在冰上按照下表在第一链合成体系反应完的pcr管中加入如下试剂,见下表4:
[0107]
表4
[0108]5×
反应缓冲液4μlribolock rnase inhibitor(20u/μl)1μl10mmdntp mix2μl
revertaid m-mμlv rt(200u/μl)1μl总体积20μl
[0109]
混合,短暂离心后,在pcr仪中孵育25℃5min,42℃90min,70℃5min,4℃forever。
[0110]
cdna的pcr扩增(聚合酶链式反应是一种用于放大扩增特定的dna片段的分子生物学技术,它可看作是生物体外的特殊dna复制,pcr的最大特点,是能将微量的dna大幅增加):采用rt-qpcr引物对提取的cdna进行pcr扩增,使用的引物序列如表5所示。
[0111]
表5筛选高表达特征基因使用的引物序列
[0112][0113]
rt-qpcr实验步骤如下:
[0114]
1)将反转录后的cdna稀释10倍后即为实时定量pcr反应用的模板。
[0115]
2)取出保存于-30~-10℃的superrealpremix plus(sybr green)和引物,室温解冻。
[0116]
rt-pcr反应程序如下表6所示:
[0117]
表6
[0118]
[0119][0120]
3)在pcr孔中配制pcr反应体系,配制完成后每个孔各成分的含量如下表7所示:
[0121]
表7
[0122]
depc h2o6.2μl2
×
superreal premixplus10μl上游引物0.6μl下游引物0.6μl50
×
rox reference dye2μlsamples0.6μl
[0123]
4)pcr反应体系配好后,将pcr管放入rt-pcr仪中,运行设置好的程序。
[0124]
5)pcr反应结束后导出实验数据,整理实验台面,关闭rt-pcr仪,关闭电脑。
[0125]
6)分析实验数据,以msc为参比样品通过δδct法计算rpe各待测基因rq的对数值(lgrq),判断其是否符合筛选标准。
[0126]
结果如表8所示,no.1-6的引物对应的qpcr扩增结果优于no.7-12的结果,选择no.1-6的引物对应的qpcr产物进行后续的琼脂糖凝胶电泳实验。
[0127]
表8筛选引物所对应的qpcr扩增结果
[0128][0129]
实施例6扩增产物的琼脂糖凝胶电泳实验
[0130]
筛选出的引物对应的qpcr扩增产物进行琼脂糖凝胶电泳实验,同时以50-500bp的dna ladder作为电泳marker,得出每个筛选引物对应pcr产物的dna分子大小,和引物扩增片段的大小进行对比,如一致,即说明此扩增产物即为目标扩增片段,对应引物是适用的。
[0131]
结果如图4所示,结果发现,筛选出的引物对应的pcr扩增产物的分子大小和目标扩增片段一致,说明筛选出的引物是适用的(图4中的泳道
④
为gprc5a基因pcr产物电泳图,由于gprc5a基因表达结果不符合基因标志物特质,所以不作为dp细胞特征基因)。
[0132]
实施例7用qpcr检测的dp细胞和低纯度dp细胞的hes1、tinagl1、il1b基因表达
[0133]
取用于rna seq检测的三批原代dp细胞和三批低纯度dp细胞(按照实施例1的方法分离得到);
[0134]
细胞样本rna反转录成cdna;
[0135]
cdna的pcr扩增,采用rt-qpcr对提取的cdna进行pcr扩增,使用筛选的引物序列如
下:
[0136]
hes1-f:5
’‑
caagctggagaaggcggaca-3’(seq id no.1);
[0137]
hes1-r:5
’‑
tcggtacttccccagcacact-3’(seq id no.2)。
[0138]
tinagl1-f:5
’‑
ggccagagagataccgccgg-3’(seq id no.3);
[0139]
tinagl1-r:5
’‑
atgcggaagtggcccctctc-3’(seq id no.4)。
[0140]
il1b-f:5
’‑
ccgcgtcagttgttgtggcc-3’(seq id no.5);
[0141]
il1b-r:5
’‑
agtcccggagcgtgcagttc-3’(seq id no.6)。
[0142]
gapdh-f:5
’‑
agccacatcgctcagacacc-3’(seq id no.13);
[0143]
gapdh-r:5
’‑
gtactcagcgccagcatcg-3’(seq id no.14)
[0144]
结果如表9所示:
[0145]
表9原代dp细胞和低纯度dp细胞的hes1、tinagl1、il1b基因表达检测结果
[0146][0147][0148]
由上表9可知,相比于低纯度dp细胞,hes1基因、tinagl1基因和il1b基因在三个批次的dp细胞中相对于低纯度dp细胞均高表达,且dp细胞的hes1基因、tinagl1基因、il1b基因相对于gapdh基因
△
ct值分别小于11.8,11.2,4.4,而低纯度dp细胞的hes1基因、tinagl1基因、il1b基因相对于gapdh基因
△
ct值分别大于11.8,11.2,4.4。其中,
[0149]
△
ct=ct(hes1/tinagl1/il1b)-ct(gapdh)。
[0150]
实施例8 dp细胞的鉴定
[0151]
选取p3代dp细胞(实施例1中的原代分离的dp细胞传代培养得到)、p5代dp细胞(实施例1中的原代分离的dp细胞传代培养得到)和低纯度dp细胞样品(实施例1中原代分离得到),采用rt-qpcr对每个样品提取并反转录的cdna样品进行检测,计算
△
ct值
[0152]
△
ct=ct(hes1/tinagl1/il1b)-ct(gapdh)。
[0153]
hes1、tinagl1、il1b基因检测引物如下:
[0154]
hes1-f:5
’‑
caagctggagaaggcggaca-3’(seq id no.1);
[0155]
hes1-r:5
’‑
tcggtacttccccagcacact-3’(seq id no.2)。
[0156]
tinagl1-f:5
’‑
ggccagagagataccgccgg-3’(seq id no.3);
[0157]
tinagl1-r:5
’‑
atgcggaagtggcccctctc-3’(seq id no.4)。
[0158]
il1b-f:5
’‑
ccgcgtcagttgttgtggcc-3’(seq id no.5);
[0159]
il1b-r:5
’‑
agtcccggagcgtgcagttc-3’(seq id no.6)。
[0160]
gapdh基因检测引物如下:
[0161]
gapdh-f:5
’‑
agccacatcgctcagacacc-3’(seq id no.13);
[0162]
gapdh-r:5
’‑
gtactcagcgccagcatcg-3’(seq id no.14)。
[0163]
通过对比可以发现,如表10所示,p3代dp细胞的hes1、tinagl1、il1b相对于gapdh的
△
ct分别为11.5、9.9、4.0,分别小于11.8,11.2,4.4的判定标准,而两个原代分离得到的低纯度dp细胞(按照实施例1的方法分离培养得到)和一个p5代dp细胞样品均不符合此标准,考虑到随着传代次数的增多,hes1、tinagl1和il1b基因的表达量可能会发生变化,于是我们提出了hes1、tinagl1、il1b相对于gapdh的
△
ct值分别在小于11.8,11.2,4.4时可以被用于筛选具有较好生发功能的dp细胞,并将此标准筛选出的dp细胞用于后续小鼠实验当中。
[0164]
表10p3、p5代dp细胞,原代分离低纯度dp细胞的基因表达鉴定结果
[0165][0166]
实施例9小鼠实验
[0167]
取2只雌性balb/c孕小鼠饲养至生产。取新生小鼠制备表皮/真皮混合敷料。培养实施例1中经原代分离的dp细胞传代培养得到的p3代细胞(dp细胞-p3)、原代低纯度dp细胞(实施例1原代分离低纯度dp细胞)和实施例1中经原代分离的dp细胞传代培养得到的p5代细胞(dp细胞-p5),在培养皿细胞覆盖率达到70-80%时收细胞。取dp细胞-p3、dp细胞-p5和原代低纯度dp细胞分别制备敷料。6只balb/c裸小鼠(不具备长毛功能)异氟烷吸入麻醉,背部朝上固定,背部皮肤左右两侧分别金属穿刺造2个直径5mm的创口。其中三只小鼠背部左侧给予dp细胞-p3混合的matrix胶,右侧给予鼠源细胞混合的matrix胶;两只小鼠背部左侧给予dp细胞-p5混合的matrix胶,右侧给予鼠源细胞混合的matrix胶;另外一只小鼠背部左侧给予原代低纯度dp细胞混合的matrix胶,右侧给予鼠源细胞混合的matrix胶。将对应的敷料移植到伤口部位,每孔20μl(每孔6
×
104细胞),随后敷上pet膜,用医用的3m膜贴在移植后的皮肤表面固定伤口。
[0168]
于d7(第7天)拆除敷料和3m膜,于d7(第7天)和d14(第14天)用微针再次在左右背部移植部位滚动10次;于d35(第35天)观察毛发生长情况,取背部皮肤。实验发现只有使用含有dp细胞-p3的matrix胶的实验组有新生毛发,而使用含有原代低纯度dp细胞和dp细胞-p5的matrix胶组的小鼠背部无毛发生长。
[0169]
综上所述:本发明通过rt-pcr与免疫荧光实验,本发明首次证明hes1基因、tinagl1基因和il1b基因可以用于鉴定原代分离的dp细胞与低纯度dp细胞,且鉴定分离出的纯度较好的dp细胞敷于裸鼠伤口部位,裸鼠长出了毛发,说明此鉴别方法可较好的筛选具有生发功能的dp细胞。
[0170]
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、
等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1