一种利用微基质胶球快速培养类器官的方法与流程
一种利用微基质胶球快速培养类器官的方法
1.本技术要求2022年06月17日提交的中国发明专利申请【cn202210690524.2】、名称为“一种半悬浮培养扩增类器官的方法”的优先权,该优先权发明专利申请以引用方式全文并入。
技术领域
2.本发明属于细胞生物学技术领域,具体涉及一种利用微基质胶球快速培养类器官的方法。
背景技术:
3.类器官是指一种将多能干细胞、成体干细胞或肿瘤细胞进行体外3d培养,进而形成与来源组织具有相似的组织结构和生理结构的三维培养物。目前,类器官已经广泛运用于生物发育、药物开发与筛选、毒性测试、肿瘤研究和疾病模型构建等生命医药科学领域。
4.类器官取材来源于人体的正常组织或肿瘤组织,然而,实践中发现当来源的细胞数量太少(例如临床穿刺样本)或细胞质量不稳定时,往往会导致类器官培养周期长,培养出的类器官体积小等问题,进而限制了类器官技术在快速诊断、治疗评估和个性化精准治疗中的发展及应用。因此,实现类器官体外快速扩增培养将极大扩增其在医学领域中的运用场景,包括疾病建模、药物筛选、个性化药物测试等运用场景。
5.传统类器官培养方法是通过将类器官与基质胶混合,种植于细胞培养皿中,待基质胶凝固后,在培养皿上层覆盖类器官培养基。基质胶作为类器官生长的支架,类器官包埋在基质胶中,培养基/培养液中的营养成分则通过基质胶的多孔结构缓慢渗透到基质胶内部的类器官里。在这种培养方式下,类器官被包埋在作为类器官生长支架的基质胶中,培养液中的营养成分通过基质胶多孔结构缓慢渗透到基质胶内部。由于营养成分和代谢产物交换速率较低,进而限制了类器官的生长速度。
6.综上,亟需一种新的类器官培养方法来增加类器官对营养物质的摄取和代谢产物的排出,以缓解现有技术的不足。
技术实现要素:
7.有鉴于此,本发明的目的在于提供一种利用微基质胶球快速培养类器官的方法,具体技术方案如下。
8.一种利用微基质胶球快速培养类器官的方法,包括以下步骤:
9.步骤一:在细胞培养基顶部加入矿物油,使所述矿物油覆盖所述细胞培养基制得液-油培养体系;
10.步骤二:获取细胞,使所述细胞与基质胶混合均匀,制得细胞终浓度为1
×
105~5
×
105个/ml的细胞悬液;
11.步骤三:使用微小注射工具将步骤二所得的细胞悬液注射到步骤一制得的液-油培养体系的矿物油层中,使与基质胶混合的细胞从所述微小注射工具排出形成微小基质胶
液滴,所述微小基质胶液滴在矿物油中再形成微小基质胶球并穿过矿物油层到达细胞培养基层;
12.步骤四:待微小基质胶球全部沉入所述液-油培养体系的细胞培养基层并悬浮于其中,放入培养箱培养。
13.进一步,所述液-油培养体系的细胞培养基与矿物油的体积比为1:1。
14.进一步,从所述微小注射工具排出的所述微小基质胶液滴的体积为0.3-0.5μl。
15.优选的,所述微小基质胶液滴的体积为0.3μl、0.4μl或0.5μl。
16.进一步,所述微小注射工具包括微小注射器、微细导管和微流控操作仪器中的一种或几种。
17.可以理解的是,如果采用微流控操作仪器,得到的微小基质胶液滴的大小是恒定的。
18.进一步,步骤二中所述细胞与所述基质胶的比例为100~500个细胞/μl。
19.优选的,所述基质胶中含有的细胞数量为100个细胞/μl、200个细胞/μl、300个细胞/μl、400个细胞/μl或500个细胞/μl。
20.进一步,所述液-油培养体系的细胞培养基与所述微基质胶球的比例为5:1~10:1。
21.优选的,所述液-油培养体系的细胞培养基与所述微基质胶球的比例为5:1、6:1、7:1、8:1、9:1或10:1。
22.进一步,所述细胞来自人体正常组织或肿瘤细胞,并且消化为单细胞。
23.进一步,所述培养箱培养的条件为30℃-37℃,5% co2。
24.进一步,步骤二中细胞与基质胶混合均匀的方法包括充分吹打或振摇。
25.进一步,步骤四中放入培养箱培养后,每隔8-12小时晃动一次培养物。
26.有益技术效果:
27.本发明提供的利用微基质胶球快速培养类器官的方法,通过细胞将基质胶分割成数量众多的微小基质胶液滴,再包裹矿物油形成微小基质胶球的方法,相较于传统类器官培养方法,增加了基质胶和细胞培养基营养物质的接触面积;微小基质胶球由于体积小,还可以提高培养基营养物质渗入内部和细胞代谢产物及时排出的效率。因此,被包裹的细胞生长为类器官的速率显著提高(即在与传统培养方法相同的培养时间里,本发明方法培养得到的类器官体积更大),且用本发明的培养方法几乎不会影响类器官的形态、分化和培养成功率。
28.本发明提供的利用微基质胶球快速培养类器官的方法可高效率地培养临床样本组织来源细胞的类器官,特别是以微量组织细胞著称的穿刺样本,较于传统类器官培养方式,相同培养时间内的类器官生长速率得到显著提升。进而本发明的方法可以有效满足疾病研究、药物筛选、药效毒性评估和个性化治疗短期内对大量类器官样本的需求。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍。显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以
根据这些附图获得其它的附图。
30.图1为基于微基质胶球快速扩增培养类器官的示意图;
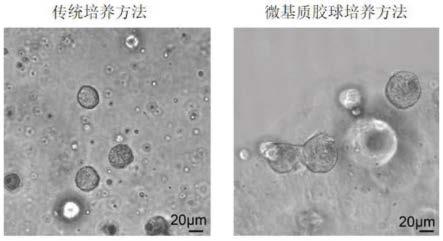
31.图2为传统培养方法和本发明的微基质胶球培养方法在相同时间里培养的类器官体积大小比较图(比例尺:20μm);
32.图3为传统方法和微基质胶球方法培养食管类器官的体积比较图(比例尺:50μm);
33.图4为传统方法和微基质胶球方法培养鼻咽类器官的体积比较图(比例尺:50μm);
34.图5为传统方法和微基质胶球方法培养的食管类器官和鼻咽类器官直径的统计比较图。
具体实施方式
35.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.如在本说明书中使用的,术语“大约”,典型地表示为所述值的+/-5%,更典型的是所述值的+/-4%,更典型的是所述值的+/-3%,更典型的是所述值的+/-2%,甚至更典型的是所述值的+/-1%,甚至更典型的是所述值的+/-0.5%。
37.在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围的描述应该被看作已经具体地公开了子范围如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及此范围内的单独数字,例如1,2,3,4,5和6。无论该范围的广度如何,均适用以上规则。
38.本发明所涉及的部分英文缩写解释
39.dmem:一种广泛应用的细胞培养基,可以适用于培养许多哺乳动物细胞,产品购买自gibco公司。
40.dmem/f12:为f12培养基和dmem培养基按照比例1:1混合而成。该培养基综合了f12培养基成分丰富和dmem养分浓度高的优点。产品购买自gibco公司。
41.matrigel:基质胶,从富含胞外基质蛋白的ehs小鼠肿瘤中分离出,其主要成分由层粘连蛋白,ⅳ型胶原,巢蛋白,硫酸肝素糖蛋白等组成,还包含生长因子和基质金属蛋白酶等。产品购买自bd公司。
42.本发明所述的“液-油培养体系”是指由细胞培养基和矿物油组成的类器官生长培养体系,其中矿物油覆盖于细胞培养基的顶部。
43.本发明所述的“微基质胶球”是指将细胞与基质胶以及矿物油以特定比例混合形成的微小球状物,其中细胞包裹在基质胶球的内部,基质胶球的最外层为矿物油。
44.实施例1
45.1.组织获取:
46.在获取手术/穿刺活检组织后,立即转移至含有青霉素/链霉素的组织保存液中,放置于便携低温保存箱将样本转移至实验室进行处理。
47.2.组织分离与培养:
48.2.1组织消化:使用冰上遇冷的含有青霉素/链霉素的pbs溶液清洗组织数次;使用无菌剪刀剪碎组织,使用10ml trypsin重悬组织碎块,转移至50ml的离心管中,37℃水浴消化1小时,消化期间每10分钟吹打组织20-30下,防止细胞团结块,促进组织充分消化成单细胞。
49.2.2细胞收集:消化完成后,加入20ml含fbs血清的dmem培养基终止消化;使用100μl滤膜过滤消化液,去除剩余组织块;400g,离心5分钟,去上清,收集细胞沉淀。
50.2.3实验组类器官培养:制备培养平板:吸取300μl细胞培养基加入24孔板底部,再吸取300μl矿物油覆盖在细胞培养基上层,放入37℃培养箱预热备用。另取适量matrigel基质胶重悬细胞沉淀,细胞与matrigel基质胶的比例为100~500个细胞/μl基质胶;吹打20-30下使细胞与matrigel基质胶充分混匀,将基质胶/细胞混合物放入微小注射工具中(以微小注射器为例);取出预热的培养平板,将微小注射工作的尖部伸入矿物油中,缓慢间断推动活塞以每次0.3-0.5μl(包括0.3μl、0.4μl或0.5μl)的体积从针尖排出微小基质胶液滴,排出的微小基质胶液滴可在矿物油中形成球状体并缓缓依次通过矿物油层到达细胞培养基层并悬浮于其中,此时细胞培养基与基质胶球的比例为5:1~10:1(包括5:1、6:1、7:1、8:1、9:1或10:1);将培养板放置在5% co2、37℃细胞培养箱中培养,每过8-12小时轻轻晃动平板几次,促进氧气和营养物质的吸收;观察记录类器官生长。操作过程示意图见图1。
51.2.4对照组类器官培养:使用适量matrigel基质胶重悬细胞沉淀(matrigel基质胶用量与细胞数量与2.3部分一致),细胞与matrigel基质胶的比例为100~500个细胞/μl基质胶,种植在培养皿中部,室温覆盖5min,使用细胞培养基覆盖。将培养板放置5% co2,37℃细胞培养箱培养,观察并记录类器官生长情况。
52.所述细胞培养基的配方如下:基础培养基dmem/f12中按以下比例或浓度加入:b27添加剂(life technologies,1:50),神经调节蛋白(life technologies,1:100),人表皮生长因子(r&d,50ng/ml),纤维母细胞生长因子10(peprotech,final 200ng/ml),rock抑制剂(abmole bioscience,终浓度10μm),tgfβ抑制剂a83-01(tocris bioscience,final 2μm),wnt信号通路激活剂r-spodin 1(peprotech,final 250ng/ml),人头蛋白(peprotech,final 100ng/ml),wnt3a(peprotech,25ng/ml),sirtuins抑制剂(sigma,1mm),乙酰半胱氨酸(sigma,1mm),l-谷氨酰胺(gibco,2mm),and青霉素(100u/ml)/链霉素(0.1mg/ml)。
53.3.类器官传代培养:
54.3.1待类器官培养到一定的数目及体积时,即可进行类器官的传代。传代时吸走上层矿物油,使用2ml tryple
tm
重悬培养物,吹打混匀后将细胞悬液移至15ml的离心管中。
55.3.2将移于离心管中细胞继续用移液枪吹打60-100次,置于37℃水浴锅中消化5min。
56.3.3取出离心管,使用移液枪轻柔吹打60-100次,显微镜下观察,可能会观察到大量的细胞团悬浮于消化液中,极少为单细胞,再次将离心管置于37℃水浴锅中消化5min。
57.3.4呈单细胞样后,将离心管置于离心机中,400g,5min,弃上清。另取适量基质胶重悬细胞沉淀,细胞与matrigel基质胶的比例为100~500个细胞/μl基质胶,吹打20-30下使细胞与matrigel基质胶充分混匀,将基质胶/细胞混合物放入微小注射工具中(以微小注射器为例),将针尖伸入矿物油中,缓慢间断推动活塞以每次0.3-0.5μl体积从针尖排出微
小基质胶液滴,排出的微小基质胶液滴可在矿物油中形成球状体并缓缓依此通过矿物油层到达细胞培养基层并悬浮于其中;将培养板放置于5% co2,37℃细胞培养箱中培养,每过8-12小时轻轻晃动平板几次,促进氧气和营养物质的吸收;观察记录类器官生长。
58.3.5对照组传代培养。
59.可以理解的是,类器官传代的目的为将原代培养的类器官继续扩大培养以获得更多细胞。传代培养和原代培养方法步骤类似,不同之处在于原代培养是将组织消化成单细胞进行培养,传代培养是将类器官消化成单细胞后进行培养,对照组也可进行传代培养,方法同对照组培养方式相同。传统培养方法和微基质胶球培养方法培养相同时间后的类器官体积大小对比见图2。
60.实施例2
61.按照实施例1的方法分别培养食管类器官和鼻咽类器官,传统培养方法和微基质胶球培养方法培养得到的食管类器官和鼻咽类器官实物对比图见图3和图4。
62.传统培养方法和微基质胶球培养方法培养得到的食管类器官和鼻咽类器官体积大小数据如下表所示(每种方法每种类器官均选取了100个进行测量),统计图见图5。
63.表1不同方法培养的鼻咽/食管类器官
64.如上表所示,采用本发明的方法培养的食管类器官平均体积为60944立方微米;传统方法培养的食管类器官平均体积为20545立方微米。采用本发明的方法培养的鼻咽类器官平均体积为54091立方微米;传统方法培养的鼻咽类器官平均体积为20328立方微米,培养时间均为3天。
65.综上,本发明的方法可高效率地制备生长迅速、质量稳定的类器官,以满足药物开发与筛选、毒性测试、肿瘤研究和疾病模型构建等领域的运用。
66.实施例3
67.优选参数验证
68.可以理解的是,本发明方法提供的微基质胶球以微小液滴的方式,增加了基质胶和细胞培养基营养物质的接触面积,进而提高了细胞培养基营养物质渗入基质胶内部和细胞代谢产物排出的效率。因此,被包裹的细胞生长为类器官的速率显著提高,即在相同培养时间里,长出的类器官体积更大。但微基质胶球的大小并不是越小越好,也不是越大越好。细胞与基质胶混合形成的微小基质胶液滴的大小需要与细胞培养基的比例在一定合适的范围内才能达到营养物质渗透和代谢产物排出的最优选择。本实施选择在液-油培养体系的细胞培养基与微基质胶球的比例为5:1的比例下,培养3天,考察不同体积大小的微小基
质胶液滴培养成的类器官体积的大小(每种微小基质胶液滴体积下测量5个类器官)。
69.表2不同体积的微小基质胶液滴培养成的类器官体积的微小基质胶液滴培养成的类器官
70.上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1