基于根癌农杆菌真空渗透介导的桑树离体瞬时转化方法
1.本发明属于桑树遗传转化技术领域,具体涉及一种基于根癌农杆菌真空渗透介导的桑树离体瞬时转化方法。
背景技术:
2.桑树属桑科(moraceae)桑属(morus)多年生木本乔木植物,是家蚕的天然优质饲料,也是我国的传统药用植物,其果实(桑葚)、根、茎、叶及其加工副产物都具有较高的药用价值和保健功效。因此,桑树是一种重要的生态经济型林木。然而,传统桑蚕种养模式下形成的“重蚕轻桑”产业科学研究发展格局,导致桑树的基础研究薄弱,基因功能研究滞后,严重制约着桑树多元化发展和多用途综合开发利用。随着川桑(morus notabilis schneid.)(he et al.,2013)和白桑(morus alba l.)(jiao et al.,2020)基因组解析相继完成,以及桑树转录组测序数据的批量化产生,标记着桑树进入后基因组时代,大量桑树基因及其功能亟需进行验证和鉴定。因此,建立快速、高效的遗传转化体系是实现基因批量化功能鉴定的重要技术手段。
3.最早,平野等(1985)证实桑树能被农杆菌感染,随后众多研究者相继开展大量的桑树转基因研究,然而时至今日仍然没有建立起成熟稳定的桑树转基因体系。目前,桑树遗传转化方法主要有以下4种:(1)叶盘转化法;machii等(1990)首次基于农杆菌介导的叶盘转化法将gus基因和nptii基因转入到桑树中,成功获得具有gus酶活性的植株。吴成仓等(1992)通过叶盘转化法将天蚕抗菌肽b基因(人工合成)和gus基因转入桑树中,经过筛选获得抗性愈伤组织。谈建中等(1999,2001)通过叶盘转化法将大豆球蛋白基因a1ab1b分别转化桑树叶盘与茎尖,经卡那霉素抗性筛选培养,获得a1ab1b转基因阳性植株。shalini等(2008)和manaswini等(2011)通过农杆菌介导的叶盘转化法将外源基因导入印度桑
‘
k2’,均成功获得了转基因阳性植株。(2)基因枪轰击法;除了传统的农杆菌介导的植物组织培养转化法以外,基因枪技术在桑树转基因研究中也得到了应用。machii等(1996)通过基因枪轰击法将gus基因成功导入桑树悬浮愈伤组织中,但最终未能获得转基因植株。王洪利等(2003)采用基因枪法成功将水稻半胱氨酸蛋白酶抑制剂基因(oc)转入到桑树品种新一之濑中。(3)植株转化法,植株转化法是以植物茎尖或腋芽为受体材料,通过注射接种农杆菌进行转化的方法。陆小平等(2004)首次报道采用农杆菌侵染被针刺伤后的桑树腋芽,对感染部位长出的表型异常桑芽进行鉴定,证实目的基因成功导入。林天宝等(2018)将携带gus和kan基因的农杆菌菌液注射桑树冬芽,经gus染色、pcr检测和卡那霉素抗性筛选,证实gus基因成功已转入桑树。(4)花粉管通道法,花粉管通道法是在植物授粉后直接注射dna溶液于子房,利用受精过程中花粉伸长的花粉管,将外源基因转入受精的卵细胞,并进一步整合到基因组中,最终获得转基因个体。李镇刚等(2014)利用花粉管通道法结合农杆菌介导法对桑树进行了转化,经pcr鉴定获得转phy c基因的桑树植株。此外,张大燕等(2015)基于农杆菌介导注射法,探索了缓冲液、农杆菌菌液浓度、转化时间、桑树品种等对桑树叶片瞬时转化效率的影响,并初步构建了农杆菌介导的桑树叶片瞬时转化体系。李瑞雪等(2018)报
道了农杆菌介导的病毒诱导基因沉默(vigs)转化体系,并成功将桑树pds基因沉默导致叶片出现白化现象。
4.目前,桑树遗传转化研究仍存在以下一些问题:(1)稳定遗传转化效率和再生率低。桑树为多年生木本植物,难以建立成熟的再生体系,基因型依赖性强;(2)瞬时转化效率低。现有农杆菌介导的桑树活体叶片瞬时转化均采用注射侵染法,由于桑树叶片薄,叶脉多,导致注射侵染和农杆菌转化效率低,无法实现快速、高效及批量化基因功能验证。
技术实现要素:
5.针对现有技术中的问题,本发明旨在建立快速、高效的桑树组培苗瞬时转化体系,以实现桑树基因的快速、高效及批量化功能验证,促进桑树基础研究的快速发展。
6.为了实现上述目的,本发明的技术方案具体如下:
7.本发明提供了一种基于根癌农杆菌真空渗透介导的桑树离体瞬时转化方法,具体步骤为:
8.步骤1,将含有目的基因的根癌农杆菌摇菌培养后收集菌体,再用渗透缓冲液重悬得到农杆菌侵染液;其中,渗透缓冲液具体为:无菌双蒸水中含有10mm mes,10mm mgcl2,50~200μmol/l乙酰丁香酮(as),ph为5.6。
9.步骤2,先将桑树离体组织浸入渗透缓冲液中超声处理产生为微孔创伤,再将桑树离体组织浸入农杆菌侵染液中真空渗透侵染。
10.进一步地,在上述的桑树离体瞬时转化方法中,根癌农杆菌可以为农杆菌gv3101、农杆菌eha105或农杆菌lba4404;其中,农杆菌lba4404的转化效率最佳。
11.进一步地,在上述的桑树离体瞬时转化方法中,农杆菌侵染液的od
600
为0.5~1.0;优选od
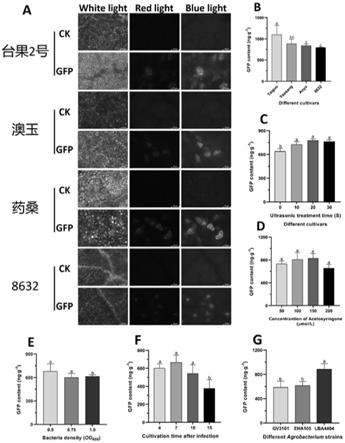
600
=0.5。
12.进一步地,在上述的桑树离体瞬时转化方法中,步骤2用于浸染桑树离体组织的农杆菌浸染液中还含有silwet l-77表面活性剂,且其浓度优选为0.02%。
13.进一步地,在上述的桑树离体瞬时转化方法中,超声处理的条件可以为:50khz超声波仪器中超声处理10-30s,其中20s为最佳。
14.进一步地,在上述的桑树离体瞬时转化方法中,真空浸染的条件为:0.7mpa真空条件下渗透侵染20min。
15.进一步地,在上述的桑树离体瞬时转化方法中,当桑树离体组织为组培苗时,该方法还包括步骤3:将浸染后组培苗接种于继代培养基共培养,再将组培苗洗菌后接种至无菌继代培养基中继续培养,其中培养7d为最佳。
16.更进一步地,在本发明的具体实施例中,验证了桑树组培苗的基因型为
‘
台果2号’、
‘
药桑’、
‘
澳玉’和
‘
8632’时的转化效果,其中
‘
台果2号’为最佳。
17.更进一步地,组培苗所用的继代培养基为dkw+zt 2.0mg/l+6-ba2.0mg/l+iaa 0.1mg/l+蔗糖30g/l+琼脂6.5g/l,且步骤3中组培苗的培养时间为4~10d。
18.本发明的有益效果为:本发明基于农杆菌真空渗透侵染法,结合超声波处理,克服了叶脉组织导致注射侵染效率低的难题,建立了快速、高通量的桑树离体瞬时转化体系,并从乙酰丁香酮浓度、农杆菌菌株类型、农杆菌菌液浓度、超声波处理时间和培养时间对桑树组培苗瞬时转化效率进一步优化。而且,本发明提供的体系成功用于maans和madfr瞬时转
化离体桑果进行功能验证。因此,本发明建立的方法可实现桑树基因的快速、高效及批量化功能验证,为推进桑树后基因组时代提供技术保障。
附图说明
19.图1为不同桑树基因型(a,b)、超声波处理时间(c)、乙酰丁香酮浓度(d)、农杆菌菌液浓度(e)、培养时间(f)和农杆菌菌株类型(g)对桑树组培苗瞬时转化效率的影响对比图。
20.图2为实施例10中桑果离体瞬时转化maans和madfr超表达功能分析的结果图,其中,a为桑果渗透侵染后不同时间果实外观着色对比图,b为桑果渗透侵染后7d后果实外观着色对比图,c为桑果渗透侵染后7d后花青苷含量变化对比图。
具体实施方式
21.为了使本发明所要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
22.下述实施例中,若无特殊说明,均为常规方法;所述试剂和材料,若无特殊说明,均可从商业途径获得。
23.实施例1
24.本例以
‘
台果2号’桑树基因型组培苗(继代培养25d)为试材,以gfp为报告基因。瞬时转化过程为:
25.将含有gfp基因的农杆菌gv3101单克隆于1ml含有相应抗生素的lb液体培养基中,28℃摇菌(220rpm)培养1d,然后加入到50ml含相应抗生素lb液体培养基中,28℃摇菌(220rpm)过夜培养至od
600
为1.6-1.8(菌液呈金黄色)。25℃、4,000
×
g离心10min收集菌体,并用渗透缓冲液重悬菌体并培养至菌液浓度od
600
为0.75,得到农杆菌侵染液。其中,渗透缓冲液(ph 5.6)含10mm mes,10mm mgcl2,150μmol/l as。
26.渗透浸染前,在农杆菌侵染液中加入过滤灭菌的silwet l-77表面活性剂并使其终浓度为0.02%。将组培苗先整株浸入渗透缓冲液中,置于50khz超声波仪器中处理20s。再将组培苗整株浸入农杆菌侵染液中,并于0.7mpa真空条件下渗透侵染20min。然后将组培苗接种于继代培养基中共培养2d后,将组培苗置于500mg/l头孢无菌水中浸洗10min,最后接种至无菌的继代培养基中继续培养2d。其中,继代培养基为:dkw+zt 2.0mg/l+6-ba 2.0mg/l+iaa 0.1mg/l+蔗糖30g/l+琼脂6.5g/l。
27.实施例2-4
28.与实施例1不同的是,实施例2-4采用不同的桑树基因型组培苗为试材,具体如下表所示:
29.实施例2实施例3实施例4
‘
药桑
’‘
澳玉
’‘
8632’30.待转化结束后,分别检测实施例1~4中所得组培苗的叶片gfp蛋白含量,结果如图1中a和b所示:
‘
台果2号’组培苗叶片gfp蛋白含量显著高于其他基因型,且叶片gfp荧光信号明显强于其他基因型,表明
‘
台果2号’瞬时转化效率最高。
31.实施例5
32.按照实施例1的操作过程,本例探讨50khz频率超声波处理时间分别为0、10、20、30s对gfp瞬时转化效率的影响。
33.待转化结束后,分别检测不同超声波处理时间下的组培苗叶片gfp蛋白含量,结果如图1中c所示:超声波处理20s条件下组培苗叶片gfp蛋白含量最高,表明其瞬时转化效率最高。
34.实施例6
35.按照实施例1的操作过程,本例探讨渗透缓冲液中as浓度分别为50、100、150、200μmol/l对gfp瞬时转化效率的影响。
36.待转化结束后,分别检测不同as浓度下组培苗叶片gfp蛋白含量,结果如图1中d所示:150μmol/l as浓度下的组培苗叶片gfp浓度明显高于其他浓度处理,表明其瞬时转化效率最高。
37.实施例7
38.按照实施例1的操作过程,本例探讨农杆菌浸染液中菌液浓度od
600
分别为0.5、0.75、1.0对gfp瞬时转化效率的影响。
39.待转化结束后,分别检测不同菌液浓度下组培苗叶片gfp蛋白含量,结果如图1中e所示:菌液浓度od
600
为0.5时,叶片gfp蛋白含量最高。
40.实施例8
41.按照实施例1的操作过程,本例探讨不同培养时间4、7、10、15d对gfp瞬时转化效率的影响;培养时间的方案具体为:待组培苗于真空渗透侵染后,先经共培养2d后,再于头孢无菌水浸洗后,接种至无菌继代培养基继代培养2d、5d、8d、13d。
42.待转化结束后,分别检测不同培养时间下组培苗叶片gfp蛋白含量,结果如图1中f所示:渗透侵染后培养7d组培苗叶片gfp蛋白含量最高。
43.实施例9
44.按照实施例1的操作过程,本例探讨不同农杆菌菌株gv3101、eha105、lba4404对gfp瞬时转化效率的影响。
45.待转化结束后,分别检测不同农杆菌菌株侵染下组培苗叶片gfp蛋白含量,结果如图1中g所示:农杆菌lba4404介导的瞬时转化gfp蛋白含量最高。
46.实施例10
47.本例以果桑品种
‘
紫晶’花后10d离体果实为试材,将maans和madfr基因分别瞬时转化至桑果中进行超表达功能验证,以空载作为对照。其过程具体为:
48.将含有maans基因或madfr基因的农杆菌lba4404单克隆于1ml含有相应抗生素的lb液体培养基中,28℃摇菌(220rpm)培养1d,然后加入到50ml含相应抗生素lb液体培养基中,28℃摇菌(220rpm)过夜培养至od
600
为1.6-1.8(菌液呈金黄色)。25℃、4,000
×
g离心10min收集菌体,并用渗透缓冲液重悬菌体并培养至菌液浓度od
600
为0.75,得到农杆菌侵染液。其中,渗透缓冲液(ph 5.6)含10mm mes,10mm mgcl2,150μmol/l as。
49.渗透浸染前,在农杆菌侵染液中加入过滤灭菌的silwet l-77表面活性剂并使其终浓度为0.02t%。将果实先浸入渗透缓冲液中,置于50khz超声波仪器中处理20s。再将果实浸入农杆菌侵染液中,并于0.7mpa真空条件下渗透侵染20min。
50.将浸染后的桑果置于培养皿中28℃保湿培养,培养皿中铺垫无菌滤纸,用含30g/l
蔗糖的无菌双蒸水润湿,5d后部分桑果开始出现色素积累,而对照组无明显变化,尤其是侵染7d后桑果着色变化明显,花青苷含量显著高于对照组(见图2)。
51.综上所示,本发明提供的桑树离体瞬时转化技术具有用于桑树基因功能验证的可行性和高效性,为促进桑树基础研究的发展提供了技术保障。
52.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1