一种胰腺炎症转化为胰腺癌模型及其构建方法与应用与流程
本发明属于胰腺炎恶性转化分子机制,具体涉及一种胰腺炎症转化为胰腺癌模型及其构建方法与应用。
背景技术:
1、胰腺癌是全球第七大癌症,早期确诊率和治愈率都很低,5年生存率不足10%,被称为“癌中之王”,胰腺癌约90%为起源于腺管上皮的胰腺导管腺癌(pancreatic ductaladenocarcinoma,pdac)。pdac常规治疗包括化学疗法、放射疗法和外科手术,由于早期无症状和药物耐受等特征,上述疗法的临床效果十分有限。因此,迫切需要揭示pdac潜在的分子机制,以期研发出高效的疾病诊疗策略。早在1863年,科学家rudolph virchow率先观察发现了炎症和肿瘤之间的联系。胰腺外分泌功能可能会受到各种胰腺病理影响,如胰腺炎和pdac。研究报道,急性胰腺炎(acute pancreatitis,ap)反复发作会导致慢性胰腺炎(chronic pancreatitis,cp),而cp患者罹患pdac的风险比正常人群高53倍。胰腺炎病程复杂,目前仍缺乏公认的临床途径筛查和治疗高pdac风险的胰腺炎患者。
2、ros广泛指代氧来源的自由基和非自由基,主要来源于线粒体内膜的电子传递链(eleceron transfer chain,etc)和nadph氧化酶(reduced nicotinamide adeninedinucleotide phosphate oxidase,nox)体系,包括o2-、h2o2、oh-和o3等。炎症是机体对氧化应激和ros的一种生物学反应,它启动了体内稳态的恢复过程,炎症微环境与癌细胞建立共生关系,增强了癌细胞对生存、侵袭、转移和逃逸的适应性。ros与胰腺炎反复发作以及pdac的发生发展密切有关。钙卫蛋白s100a9是钙结合蛋白s100蛋白家族的成员,通常与s100a8蛋白以ca2+依赖的方式形成s100a9/a8异源二聚体,并与效应靶蛋白相互作用,在调节体内钙平衡、细胞凋亡和炎症反应等生理病理过程中发挥生物学作用。
3、已有研究报道ros能够激活s100a9介导的炎症信号通路调控细胞代谢,s100a9是联系氧化应激反应与炎症反应的一种重要介质。但当前还未见s100a9/a8调控胰腺炎癌恶性转化的相关报道。
4、现有临床技术不能对胰腺炎癌恶性转化过程进行控制,找到控制胰腺炎癌转化的关键靶点将有利于预防胰腺炎症转化为癌症,也成为了本领域亟待解决的关键临床问题。
技术实现思路
1、本发明是为了解决现有技术所存在的上述问题,从ros激活s100a9炎症信号通路的角度探讨胰腺炎恶性转化的分子机制,研究发现s100a9是促使胰腺炎转化为胰腺癌的关键靶点,抑制s100a9将有助于防止胰腺炎转化为胰腺癌。
2、本发明用h2o2产生的ros,诱导小鼠胰腺炎症,进一步导致胰腺炎诱导小鼠胰腺腺泡细胞内的线粒体损伤和大量ros释放;ros通过激活s100a9高表达,进一步加强细胞内炎症信号通路,导致胰腺腺泡细胞内ck19基因表达上调,并进一步地促进s100a9/a8二聚体形成,这个二聚体形成进一步激活了myc原癌基因相关通路,从而诱导腺泡细胞adm病变形成。
3、如果把s100a9基因敲除了,即构建s100a9-/-,就能够减轻因胰腺炎诱导的胰腺腺泡细胞损伤以及腺泡-导管化生(adm)乃至胰腺上皮内瘤变(panins)等超早期胰腺导管癌病变。因此,s100a9是关键的控制胰腺炎转癌的靶点基因。这个关键靶点是通过与ros和myc形成ros/s100a9/myc信号轴,信号轴的形成在胰腺炎诱导adm病变过程中起着重要的促进作用,可能是早期胰腺导管癌pdac治疗的关键靶点。
4、为了实现上述目的,本发明的技术方案如下:
5、一种胰腺炎症转化为胰腺癌模型,敲除小鼠3号染色体的s100a9基因。
6、一种胰腺炎症转化为胰腺癌模型的构建方法,包括如下步骤:
7、步骤一:采用“胰胆管逆行注射牛磺胆酸钠法”构建胰腺炎小鼠模型;
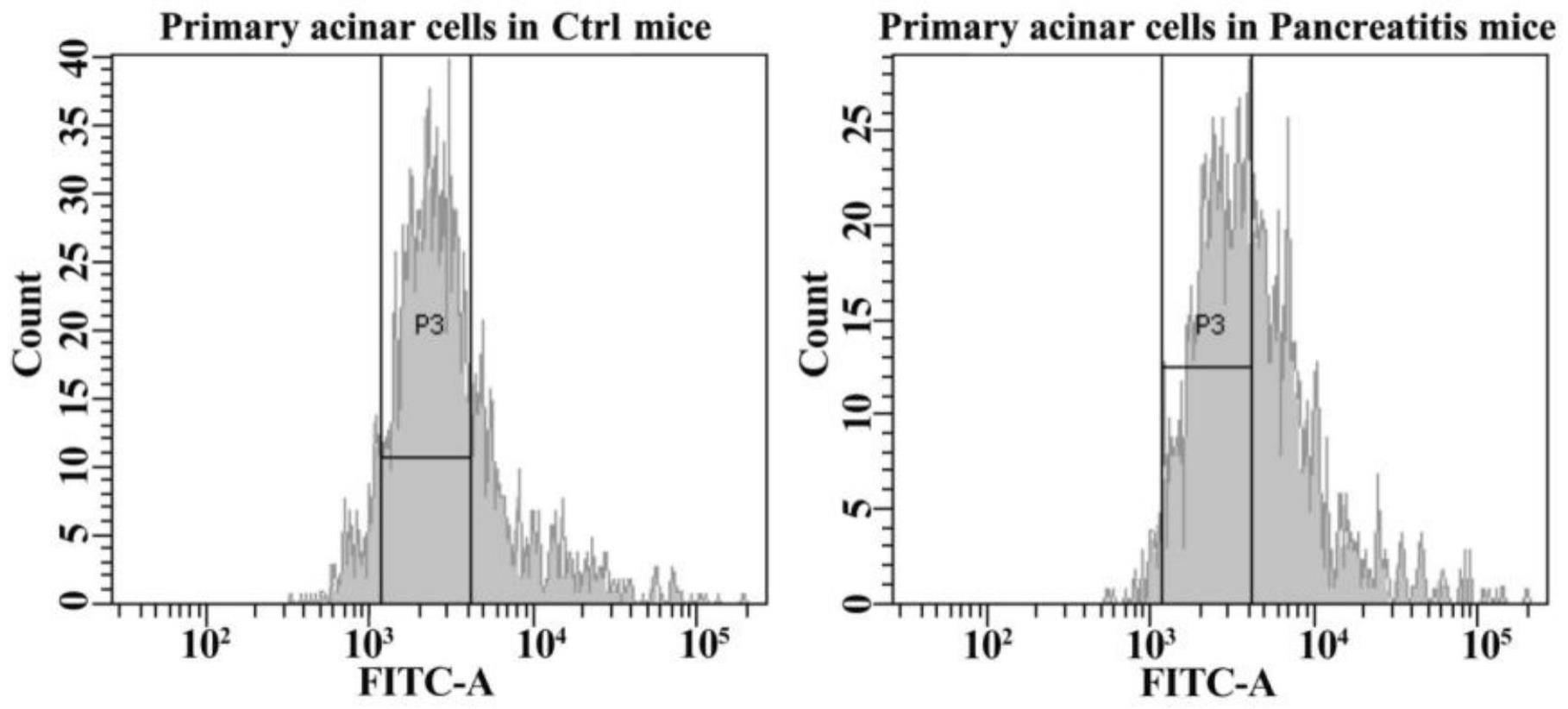
8、步骤二:利用流式细胞仪检测胰腺腺泡细胞ros的释放水平;
9、步骤三:h2o2诱导小鼠原代胰腺腺泡细胞出现adm表型;
10、步骤四:构建s100a9稳定过表达的266-6细胞株;
11、步骤五:构建s100a9-/-c57bl/6小鼠;
12、步骤六:观察s100a9在胰腺adm及胰腺炎恶性转化中的作用。
13、进一步的,所述步骤一的具体方法如下:
14、大鼠禁食12h,自由饮水,腹腔注射40mg/kg戊巴比妥钠进行麻醉,麻醉成功后取仰卧位,固定于鼠板,上腹部脱毛备皮,在无菌操作下行正中切口入腹,充分暴露术野,用小动脉夹夹闭肝门处胰胆管,于胰胆管汇合处逆行注射5.0%牛磺胆酸钠,以0.1mg/100g体重注射。
15、进一步的,所述步骤二的具体方法如下:
16、①按照“原代胰腺腺泡细胞提取分离”的方法提取分离胰腺炎诱导adm病变小鼠的原代胰腺腺泡细胞,体外继续培养24h;
17、②按照1:1,000比例用无血清培养液稀释dcfh-da探针,使其终浓度为10μm;
18、③收集原代胰腺腺泡细胞,重悬于稀释好的dcfh-da溶液中,37℃孵育20min,每隔3~5min颠倒混匀一下,使探针和细胞充分接触;
19、④细胞用无血清细胞培养液充分洗涤,最后采用流式细胞仪进行检测。
20、进一步的,所述步骤三的具体方法如下:提取分离正常小鼠的原代胰腺腺泡细胞,并将其接种于96孔板中,细胞贴壁之后,每孔分别加入200μl h2o2终浓度为0、25、50、100和200μm的waymouth's完全培养基,在37℃和5%co2的恒温培养箱中进行24h培养,然后每孔更换200μl完全培养基,并加入20μl5mg/ml的mtt溶液,继续在培养箱中培养,4h后终止培养,小心吸去孔内培养液,每孔加入100μl dmso,低速振荡10min充分溶解紫色结晶物,最后采用多功能酶标仪在490nm波长下测量各孔的od值,同时设置调零孔和对照孔,计算各组间的相对细胞活力,以此评价h2o2对小鼠原代胰腺腺泡细胞的细胞毒作用,然后在倒置显微镜的明场下进行观察以确定h2o2对原代胰腺腺泡细胞的影响。
21、进一步的,所述步骤四的具体方法如下:
22、①将状态良好的266-6细胞用胰酶消化后重悬,取适量细胞接种至6孔板中,37℃培养箱中过夜;
23、②分别取滴度为108的阴性对照病毒和s100a9过表达慢病毒,按1:100与dmem培养基混合稀释,总体积为2ml,并加入终浓度5μg/ml polybrene以提高慢病毒对细胞的感染效率,37℃培养箱中培养;
24、③24h后吸去原病毒培养基,更换成新鲜的完全dmem,37℃培养箱中培养;
25、④48h后于荧光倒置显微镜下观察并记录结果,待到大部分细胞都表达绿色荧光之后,更换新鲜培养基,并加入终浓度为6μg/ml嘌呤霉素,继续培养24h,杀死没有感染上病毒的细胞;
26、⑤吸取含有嘌呤霉素的dmem培养液,收集存活下来的266-6阳性细胞,在37℃培养箱中扩大培养;
27、⑥qpcr检测稳定过表达细胞的s100a9 mrna的表达情况,以此判断266-6 s100a9细胞株构建是否成功;
28、⑦在266-6 s100a9细胞株的基础上,转染s100a8过表达慢病毒进一步构建s100a9和s100a8过表达的稳定细胞株,qpcr检测稳定过表达细胞的s100a9和s100a8的mrna表达水平,以此判断266-6 s100a9/a8细胞系构建是否成功。
29、进一步的,所述步骤五的具体方法如下:
30、s100a9基因位于小鼠的3号染色体,采用crispr/cas9技术,设计sgrna,通过应用高通量电转受精卵方式,获得s100a9基因敲除s100a9-/-小鼠,具体方法和技术依靠赛业(苏州)生物科技有限公司进行,采用rt-pcr和琼脂糖凝胶电泳进行野生型wt、杂合子s100a9+/-和纯合子s100a9-/-基因型鉴定,相对应的引物序列为:f1:5’-ctttcctccaagccttcctcttg-3’;f2:5’-caaagtcctagtgcccacggc-3’;r1:5-gtgaaaggaggcagaaaggacatg-3’。
31、一种胰腺炎症转化为胰腺癌模型的应用,可以应用在筛选治疗或预防胰腺癌的药物,或应用在抗胰腺肿瘤疫苗等。
32、本发明与现有技术相比的有益效果是:
33、通过上述的流程步骤操作,本发明构建了稳定过表达s100a9的胰腺腺泡细胞模型,利用细胞生物学实验、分子生物学实验以及s100a9-/-c57bl/6小鼠,证实s100a9在胰腺adm及胰腺炎恶性转化中发挥至关重要的作用。为深入探究胰腺adm及胰腺炎恶性转化及基因靶向治疗提供必不可少的依据,本发明应用细胞生物学功能实验、分子生物学实验、基因敲除小鼠模型等技术深入探究s100a9在胰腺adm及胰腺炎恶性转化的作用及其分子机制,结果表明s100a9/a8过表达激活了myc癌基因相关通路从而诱导腺泡细胞adm及恶性转化,ros/s100a9/myc信号轴可能是pdac早期的治疗靶点之一。
34、本发明的创新之处是为胰腺adm及胰腺炎恶性转化机理和靶点治疗技术提供新的思路和方法。s100a9为胰腺炎向胰腺癌转化的关键靶点,抑制这个关键靶点及可抑制胰腺炎向癌症的转化,对设计新的抗胰腺癌化学药物、研发新的抗胰腺肿瘤疫苗,防治炎症向癌症转化、以及单克隆或car-t(s100a9/s100a8/myc)胰腺癌治疗具有重要的临床应用价值。
- 还没有人留言评论。精彩留言会获得点赞!