核酸检测芯片和核酸检测方法
1.本发明属于微流控芯片技术领域,具体涉及一种核酸检测芯片和核酸检测方法。
背景技术:
2.hiv、埃博拉病毒、严重急性呼吸综合征(sars)等传染性病毒对人类健康和生命带来了很大的影响,我们希望一种快速准确的诊断方法,然而传统的微生物检测方法很难达到这个目标,但随着分子技术的不断应用,使这个目标得以实现。核酸检测是目前病原体检测的主要依据,这种方法快速准确、灵敏度高,特异性强,检测限可达几个拷贝数。
3.开发同时检测多种病原体的方法可缩短诊断时间,有效检出多种病原的共感染。结合微流控技术,可以有效提高多重分子检测的效率,缩短病原体的报告时间,使用药更精准。
4.微生物crispr/cas基因编辑系统的应用是生命科学的热门技术。近些年来,张锋教授、jennifer doudna等都成功开发出了基于crispr cas12/13的基因检测。jennifer doudna教授在《science》撰文中指出cas12酶家族在grna的引导下与目标序列结合以后,便会切换为激活状态,疯狂的切割体系内其它的单链dna。只要在体系内加入报告因子,如果cas12a/13识别到目标系列,就会切割单链底物释放荧光报告基团。基于crispr的核酸检测技术是目前最具前景的诊断手段,具备操作简便、耗时短、价格低廉等优点。
5.已有一些研究将核酸检测与微流技术结合,但很少有将病毒分离富集、核酸提取、核酸扩增和核酸检测集成在一起的微流控芯片,很多芯片集成化、自动化低,需要额外的手动操作。基于crispr的微流控芯片目前研究很少,利用该技术进行多重检测更是少之又少。所以开发一款集病毒分离富集、核酸提取、核酸扩增、核酸检测于一体、可实现“样本进结果出”,一次取样快速检测多种病毒的芯片很有意义。
技术实现要素:
6.本发明旨在至少解决现有技术中存在的技术问题之一,提供一种核酸检测芯片和核酸检测方法。
7.本发明的一方面,提供一种核酸检测芯片,包括依次层叠设置的流道层、弹性薄膜层和气道层;所述流道层设置有微流体通道以及与所述微流体通道相连通的进样口组和出样口组,所述流道层还依次设置有通过所述微流体通道相连通的病毒分离区、核酸裂解区、核酸分配区、lamp扩增区和crispr检测区;所述弹性薄膜层在对应所述进样口组和出样口组的位置处分别设置有连接入口组和连接出口组;所述气道层设置有气路通道,所述气路通道分别与所述微流体通道以及所述核酸裂解区、核酸分配区、lamp扩增区和crispr检测区相对应;以及,所述气道层在对应所述连接入口组和所述连接出口组的位置分别设置有引入口
组和引出口组,所述引入口组通过所述连接入口组与所述进样口组连通,所述引出口组通过所述连接出口组与所述出样口组连通。
8.可选地,所述病毒分离区设置有病毒分离结构,所述病毒分离结构包括呈螺旋设置的病毒分离流道、第一出口流道和第二出口流道;其中,所述第一出口流道的入口与所述病毒分离流道的外侧壁相连通,所述第一出口流道的出口与所述核酸裂解区的入口相连通;所述第二出口流道的入口与所述病毒分离流道的内侧壁相连通。
9.可选地,所述第一出口流道的直径小于所述第二出口流道的直径。
10.可选地,所述核酸裂解区包括裂解室和洗脱室;所述裂解室的出口通过所述微流体通道与所述洗脱室的入口相连通,所述洗脱室的出口通过所述微流体通道与所述核酸分配区的入口相连通;所述裂解室和所述洗脱室的入口还均分别与所述进样口组中对应的进样口连通,所述洗脱室的出口还与所述出样口组中对应的出样口连通。
11.可选地,所述核酸分配区包括多个核酸分配室;每个所述核酸分配室的入口均通过所述微流体通道与所述核酸裂解区的出口相连通,每个所述核酸分配室的出口均通过所述微流体通道各自独立地与所述lamp扩增区的入口相连通;每个所述核酸分配室的入口还均分别与所述进样口组中对应的进样口连通。
12.可选地,所述lamp扩增区包括多个lamp扩增室,所述lamp扩增室为被动混合器;每个所述lamp扩增室对应一个所述核酸分配室,每个所述lamp扩增室的入口均通过所述微流体通道与对应的所述核酸分配室的出口相连通,每个所述lamp扩增室的出口均通过所述微流体通道与所述crispr检测区的入口相连通。
13.可选地,所述crispr检测区包括多个crispr反应室和多个尖角混合器;每个所述crispr反应室对应一个所述lamp扩增室,每个所述crispr反应室的入口均通过对应的所述尖角混合器和所述微流体通道与所述lamp扩增室的出口相连通;每个所述crispr反应室的入口还均分别与所述进样口组中对应的进样口连通。
14.可选地,还包括控制阀组,所述控制阀组串设于所述微流体通道;所述气路通道控制所述弹性薄膜层发生形变使得所述控制阀组开闭,以分别控制所述核酸裂解区、核酸分配区、lamp扩增区和crispr检测区的微流体通道的通断。
15.可选地,所述流道层还设置有阳性对照区和阴性对照区;所述阳性对照区包括阳性lamp扩增室以及通过所述微流体通道与所述阳性lamp扩增室相连通的阳性crispr反应室,所述阳性lamp扩增室和所述阳性crispr反应室均分别与所述进样口组中对应的进样口连通;所述阴性对照区包括阴性lamp扩增室以及通过所述微流体通道与所述阴性lamp扩增室相连通的阴性crispr反应室,所述阴性lamp扩增室和所述阴性crispr反应室均分别与所述进样口组中对应的进样口连通。
16.本发明的另一方面,提供一种核酸检测方法,采用前文记载的所述的核酸检测芯片,所述方法包括以下步骤:向病毒分离区通入样本,以将样本中的病毒分离;
向核酸裂解区通入分离后的病毒样本、裂解液和磁珠,使得磁珠与液体混合,并在混合之后捕获磁珠;向所述核酸裂解区通入洗脱液,对捕获的磁珠进行洗脱;将洗脱后的所述核酸裂解区的液体挤压至所述核酸分配区;分别向所述核酸分配区通入lamp混合液以及向所述crispr检测区通入对应的crispr反应液,并将所述核酸分配区的液体挤压至所述crispr检测区;反应完成后,在激发光的照射下,透过滤光片观察荧光。
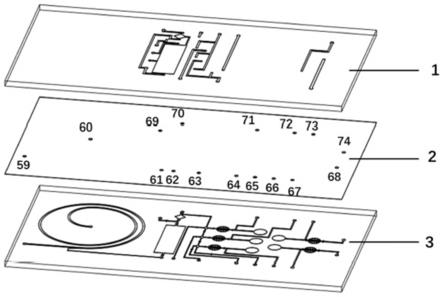
17.本发明实施例的核酸检测芯片和核酸检测方法,在流道层上设置有微流体通道以及依次通过微流体通道相连通的病毒分离区、核酸裂解区、核酸分配区、lamp扩增区和crispr检测区,从而可以将病毒分离富集、核酸提取、lamp等温扩增和crispr检测技术结合到同一片芯片上,发挥了微流控技术的优势,如低成本,自动化等。在实际进行核酸检测时,只需将样品完成病毒分离富集、核酸提取、lamp等温扩增,在与cas酶、向导rna(crrna)和淬灭的dna单链等混合反应,就可以实现目标序列的检测。本发明实施例的核酸检测芯片操作方便,检测结果准确率高,还可以减少气溶胶污染,此外,本发明实施例的核酸检测芯片通过所设置的核酸分配区,将提取的核酸分配至多个检测通道,可以同时检测多种不同的核酸,检测效率高。
附图说明
18.图1为本发明一实施例的核酸检测芯片的结构示意图;图2为本发明另一实施例的核酸检测芯片中流道层的结构示意图;图3为本发明另一实施例的核酸检测芯片中气道层的结构示意图;图4为本发明另一实施例的核酸检测芯片中病毒分离区的分离过程示意图;图5为本发明另一实施例的核酸检测芯片检测病毒的预期荧光图。
具体实施方式
19.为使本领域技术人员更好地理解本公开的技术方案,下面结合附图和具体实施方式对本发明作进一步详细描述。
20.如图1所示,本发明的实施例涉及一种核酸检测芯片,包括从上至下依次层叠设置的气道层1、弹性薄膜层2和流道层3。本发明实施例的芯片结构的气道层1、弹性薄膜层2和流道层3可以均为聚二甲基硅氧烷(pdms)材质,每层结构之间通过等离子处理键合,形成腔室、流道等结构。
21.如图2所示,所述流道层3设置有微流体通道以及与所述微流体通道相连通的进样口组(4,7至15,17至20)和出样口组(5、6,16),相应的,为了向进样口组(4,7至15,17至20)提供流体以及将出样口组(5、6,16)的流体引出,如图1所示,所述弹性薄膜层2在对应所述进样口组(4,7至10,12至15,17至20)和出样口组(5、6,11,16)的位置处分别设置有连接入口组(60至69,71至74)和连接出口组(59,70)。这样,流体经由引入口组流向连接入口组,并经由该连接入口组引入至流道层3上的进样口组(4,7至10,12至15,17至20),相应的,从出样口组(5,6,11,16)流出的流体流向连接出口组,并经由该连接出口组引入至流体引出口组,实现流体回收。
22.如图2所示,所述流道层3还依次设置有通过所述微流体通道相连通的病毒分离区、核酸裂解区、核酸分配区、lamp扩增区和crispr检测区。如图3所示,所述气道层1设置有气路通道(46至57),所述气路通道(46至57)分别与所述微流体通道以及所述核酸裂解区、核酸分配区、lamp扩增区和crispr检测区相对应。
23.本发明实施例的核酸检测芯片,在流道层上设置有微流体通道以及依次通过微流体通道相连通的病毒分离区、核酸裂解区、核酸分配区、lamp扩增区和crispr检测区,从而可以将病毒分离富集、核酸提取、lamp等温扩增和crispr检测技术结合到同一片芯片上,发挥了微流控技术的优势,如低成本,自动化等。在实际进行核酸检测时,只需将样本完成病毒分离富集、核酸提取、lamp等温扩增,在与淬灭的dna单链以及相应的向导rna等混合反应,就可以实现目标序列的检测。本发明实施例的核酸检测芯片操作方便,检测结果准确率高,还可以减少气溶胶污染,此外,本发明实施例的核酸检测芯片通过所设置的核酸分配区,将提取的核酸分配至多个检测通道,可以同时检测多种不同的核酸,检测效率高。
24.如图2所示,所述病毒分离区设置有病毒分离结构,所述病毒分离结构包括呈螺旋设置的病毒分离流道l1、第一出口流道l2和第二出口流道l3。所述第一出口流道l2的入口与所述病毒分离流道l1的外侧壁相连通,所述第一出口流道l2的出口与所述核酸裂解区的入口相连通,所述第二出口流道l3的入口与所述病毒分离流道l1的内侧壁相连通。
25.具体地,本实施例中的病毒分离区是依据颗粒惯性聚焦技术制成的,微流道中的颗粒聚焦效果与该螺旋状流体通道中的迪恩二次流效应和流体的惯性效应有关。在该螺旋形流道中粒子主要受到两个力的作用,迪恩曳力fd和静惯性升力f
l
。在本实施例中的病毒分离区域中,样本溶液在螺旋形流道中流动,由于其结构紧凑,连续相近的曲率提供稳定的二次流,样本溶液中的颗粒在迪恩曳力fd和静惯性升力f
l
的合力作用下,颗粒直径较大的细胞和细菌会受到更大的惯性升力聚焦在靠近流道内测壁的位置,而病毒则更容易会迪恩曳力作用下聚焦在靠近流道外壁的位置。如图4所示,将样品溶液从进样口4泵入病毒分离富集区域,样品溶液中的粒子在aa’纵切面呈现样本溶液初始状态的不规则分布,在经历1/2迪恩二次流循环作用下,在bb’纵切面处部分粒径大的细胞100和细菌200在螺旋通道内测壁面附近受到的迪恩曳力fd和静惯性升力f
l
相近达到稳定,而粒径小的病毒300在迪恩曳力的作用下向螺旋通道外侧运动,最终在cc’处细胞100和细菌200均聚焦在螺旋通道内侧壁面附近,病毒300聚焦在螺旋通道外侧壁面附近,实现病毒的分离。
26.为了使得本实施例的螺旋设置的病毒分离流道l1的病毒分离效果达到最好,本发明的发明人作出了一系列实验,发现当迪恩曳力fd和静惯性升力f
l
满足以下关系式时,可以使得病毒和其它粒子(如细胞和细菌等)分离效果最佳:(1)(2)其中,ρ为流体密度,u为流体的平均速度,α为流体中颗粒的直径,d为螺旋通道的水力半径,f
l
为升力系数,μ为流体的动力粘度,ud为迪恩二次流的流速。
27.上述ud满足以下关系式:
(3)其中,de为迪恩数(用于表征迪恩二次流的强度),迪恩数与迪恩二次流的强度正相关,de表达式为:(4)其中,re为流道雷诺数,表述了惯性力和粘性力之间的关系。r表示为流道的曲率。re满足下述关系式:(5)在螺旋形流道中粒子主要受到两个力的作用,迪恩曳力fd和静惯性升力f
l
,螺旋形流道可以形成稳定的迪恩二次流,当迪恩曳力fd和静惯性升力f
l
平衡时,颗粒可以在流道中达到稳定。
28.示例性的,如图2所示,所述第一出口流道l2的直径小于所述第二出口流道l3的直径。为了使得本实施例的螺旋设置的病毒分离流道l1的病毒分离效果达到最好,本发明的发明人作出了一系列实验,对第一出口流道l2和第二出口流道l3的直径之间的关系进行了研究,发现当所述第一出口流道l2和所述第二出口流道l3的直径比值范围为200~250:1时,病毒分离结构的病毒分离效果最好,可以实现99.7%以上的病毒、细菌和细胞的准确分离。
29.如图2所示,所述核酸裂解区包括裂解室21和洗脱室22。所述裂解室21的出口通过所述微流体通道与所述洗脱室22的入口相连通,所述洗脱室22的出口通过所述微流体通道与所述核酸分配区的入口相连通。所述裂解室21的入口与进样口7连通,进样口7与第一出口流道f2的出口连通,所述洗脱室22的入口与进样口15连通,所述洗脱室22的出口与出样口16连通。
30.继续参考图2,所述核酸分配区包括多个核酸分配室23,每个所述核酸分配室23的入口均通过所述微流体通道与洗脱室22的出口相连通,每个所述核酸分配室23的出口均通过所述微流体通道各自独立地与所述lamp扩增区的入口相连通。每个所述核酸分配室23的入口还均分别与对应的进样口连通,作为一个示例,如图2所示,核酸分配区包括三个核酸分配室23,该三个核酸分配室分别对应三个进样口,从左到右分别是进样口10、进样口9和进样口8。
31.继续参考图2,所述lamp扩增区包括多个lamp扩增室24,所述lamp扩增室24为被动混合器,用于提高核酸与lamp混合液的混合效率。每个所述lamp扩增室24对应一个所述核酸分配室23,每个所述lamp扩增室24的入口均通过所述微流体通道与对应的所述核酸分配室23的出口相连通,每个所述lamp扩增室24的出口均通过所述微流体通道与所述crispr检测区的入口相连通。
32.继续参考图2,所述crispr检测区包括多个crispr反应室25和多个尖角混合器58,尖角混合器用于提高lamp扩增子与crispr检测液的混合效率。每个所述crispr反应室25对应一个尖角混合器和一个所述lamp扩增室24,每个所述crispr反应室25的入口均通过对应的所述尖角混合器和所述微流体通道与所述lamp扩增室24的出口相连通。每个所述crispr反应室25的入口还均与对应的进样口连通,作为一个示例,如图2所示,所述crispr检测区
包括三个crispr反应室25,该三个crispr反应室25分别对应三个进样口,从左到右分别为进样口12、进样口18和进样口17。
33.继续参考图2,所述流道层还设置有阳性对照区和阴性对照区。所述阳性对照区包括阳性lamp扩增室26以及通过所述微流体通道与所述阳性lamp扩增室26相连通的阳性crispr反应室28,所述阳性lamp扩增室26与进样口14连通,所述阳性crispr反应室28与进样口13连通。所述阴性对照区包括阴性lamp扩增室27以及通过所述微流体通道与所述阴性lamp扩增室27相连通的阴性crispr反应室29。所述阴性lamp扩增室27与进样口20连通,所述阴性crispr反应室29与进样口19连通。
34.继续参考图2,核酸检测芯片还包括控制阀组,所述控制阀组串设于所述微流体通道。所述气路通道控制所述弹性薄膜层2发生形变使得所述控制阀组开闭,以分别控制所述核酸裂解区、核酸分配区、lamp扩增区和crispr检测区的微流体通道的通断。
35.具体地,如图2所示,控制阀组包括微阀(30至45),微阀30和微阀31分别设置于裂解室21的入口和出口,微阀33和微阀34分别设置于洗脱室22的入口和出口,微阀32串设于进样口15所在的微流体通道。微阀35设置于洗脱室22的出口和核酸分配室23之间,微阀36、微阀37和微阀38分别串设于各核酸分配室23对应的进样口(8、9、10)所在的微流体通道。微阀39、微阀40和微阀41分别设于核酸分配室23之间的微流体通道。多个微阀42分别串设于连接核酸分配室23和lamp扩增室24的微流体通道,也即分别设置于多个lamp扩增室24的入口。多个微阀43分别串设于连接lamp扩增室24和crispr反应室25的微流体通道,也即分别设置于多个lamp扩增室24的出口。在阳性lamp扩增室26的入口和出口分别设置有微阀44和微阀45,在阴性lamp扩增室27的入口和出口分别设置有微阀44和微阀45。
36.如图3所示,气道层1包含若干气路通道,这些通道隔着弹性薄膜层2与流道层3上的微阀相连接,通过改变气道层1的气压,可实现微阀的开关,当气道层1气压增大时,弹性薄膜向下变形从而关闭通道,当气道层1气压减小时,弹性薄膜恢复从而打开通道。
37.本发明的另一方面,提供一种核酸检测方法,采用前文记载的所述的核酸检测芯片,核酸检测芯片的具体结构可以参考前文相关记载,在此不作赘述。所述方法包括以下步骤:s110、向病毒分离区通入样本,以将样本中的病毒分离。
38.s120、向核酸裂解区通入分离后的病毒样本、裂解液和磁珠,使得磁珠与液体混合,并在混合之后捕获磁珠。
39.s130、向所述核酸裂解区通入洗脱液,对捕获的磁珠进行洗脱。
40.s140、将洗脱后的所述核酸裂解区的液体挤压至所述核酸分配区。
41.s150、分别向所述核酸分配区通入lamp混合液以及向所述crispr检测区通入对应的crispr反应液;分别向阳性lamp扩增室和阴性lamp扩增室通入对照样本和lamp混合液;分别向阳性crispr反应室和阴性crispr反应室通入对应的crispr反应液;以及,将所述核酸分配区的液体挤压至所述crispr检测区,分别将所述阳性lamp扩增室和阴性lamp扩增室的液体挤压至对应的所述阳性crispr反应室和阴性crispr反应室。
42.s160、反应完成后,在激发光的照射下,透过滤光片观察荧光。
43.本发明实施例的核酸检测方法,采用前文记载的核酸检测芯片,在流道层上设置有微流体通道以及依次通过微流体通道相连通的病毒分离区、核酸裂解区、核酸分配区、
lamp扩增区和crispr检测区,从而可以将病毒分离富集、核酸提取、lamp等温扩增和crispr检测技术结合到同一片芯片上,发挥了微流控技术的优势,如低成本,自动化等。在实际进行核酸检测时,只需将样品完成核酸提取、lamp等温扩增,在与淬灭的dna单链以及相应的向导rna(crrna)等混合反应,就可以实现目标序列的检测。本发明实施例的核酸检测方法操作方便,检测结果准确率高,还可以减少气溶胶污染,此外,本发明实施例的核酸检测方法通过所设置的核酸分配区,将提取的核酸分配至多个检测通道,可以同时检测多种不同的核酸,检测效率高。
44.下文将以一个具体示例对本发明实施例的核酸检测方法进行详细说明。
45.将含有病毒(如新冠病毒等)的样本溶液以流速范围100μl /min~200μl /min通过流道层3中的进样口4。分离出的新冠病毒溶液从出样口5流出。
46.出样口5与进样口7连通,通过进样口7通入分离出的含新冠病毒的样品、裂解液和磁珠至裂解室21,关闭微阀30和31,气路通道47通入气体,正压和负压交替进行,以达到混合磁珠与液体的目的,室温下孵育5分钟。
47.打开微阀30、31,进样口7通入液体,将裂解室21的液体挤压至洗脱室22。洗脱室22设有半月形微结构阵列,微结构捕获住磁珠,废液通过出样口16排除。
48.关闭微阀31、35,打开微阀32-34,通过进样口15通入洗脱液至洗脱室22。
49.关闭微阀33、34,气路通道47通入气体,正压和负压交替进行,使得洗脱液充分洗脱磁珠,室温下洗脱5分钟。
50.打开微阀32、33、35、39、40、41,关闭微阀31、34、36、37、38、42。通过进样口15通入液体,将洗脱室22的液体挤压至核酸分配室23。
51.打开微阀36、37、38、42、43,关闭微阀33、39、40、41。分别从进样口8、9、10通入lamp混合液至核酸分配室24。从进样口14、20通入对照样本和lamp混合液。
52.关闭微阀42-45。65摄氏度加热40分钟。
53.打开微阀42-45。进样口8、9、10、14、20通入液体,进样口12、13、17、18、19分别通入对应的crispr反应液(如cas蛋白、crrna、ssdna以及缓冲液等),将lamp扩增室、阳性lamp扩增室26、阴性lamp扩增室27的液体向下挤压,与crispr反应液混合至crispr反应室25、阳性crispr反应室28、阴性crispr反应室29。37摄氏度加热5分钟。
54.示例性的,所述lamp扩增反应液包含lamp master预混液,一对外部引物f3和b3、一对内部引物fip和bip以及两个环导引物lf和lb。所述crispr反应液包含反应缓冲液、cas12a蛋白、rnase抑制剂、crrna和ssdna,其中ssdna为淬灭的荧光探针。
55.反应完成后,在470nm激发光的照射下,透过滤光片(如橙色滤光片)观察荧光,通过观察荧光现象来判断检测结果。如图5所示,为预期荧光图,如果样本含有新冠病毒,则会有明显的荧光强度变化。
56.上述各室所要求的温度可以通过外部的加热器来维持,将所述微流控芯片置于蓝光照明下,观察荧光现象。
57.可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1