早期前列腺癌的检测用标志物、蛋白分子检测方法及应用与流程
1.本发明属于生物医学技术领域,尤其涉及一种早期前列腺癌的检测用标志物、蛋白分子检测方法及应用。
背景技术:
2.目前,前列腺癌(pca)作为112个国家中男性最常被诊断出的癌症,目前临床检查测试常用直肠指检(dre)、前列腺特异性抗原(psa)和格里森评分。然而,这些程序中的每一个都有其缺点,并可能导致惰性疾病患者的过度诊断,这反过来可能导致不必要的活检,过度治疗甚至非必要的根治性前列腺切除术。在过去的几十年里,因为前列腺癌的早期诊断与治疗方法改进等原因,前列腺癌的死亡率呈逐年下降的趋势,但是这种长期下降的趋势已趋于停止。
3.随着测序技术尤其是高通量测序技术的迅速发展,人们对基因组变异/基因表达差异与表型之间关系的认识越来越深刻。然而传统的bulk rna测序手段是针对细胞集合进行测序,而单个细胞特异性的信息往往被掩盖,导致错失很多重要信息。
4.10xgenomics平台首先利用微流控技术分选单个细胞,然后将带有barcode和引物的凝胶珠以及单个细胞包裹在油滴中;在油滴中凝胶珠溶解释放反转录oligo,细胞裂解释放mrna,通过smart法获得用于测序的带barcode的cdna;液体油层破坏后,cdna进行后续文库构建,使用illumina测序平台检测,即可一次性获得大量单细胞的基因表达数据,10min内自动完成多至80,000个细胞的捕获,细胞捕获率最高65%。可实现大量单细胞的快速高效标记、测序和分析,获得单细胞水平的基因表达谱和差异情况,并通过对复杂细胞群体进行深入细致分析。
5.通过上述分析,现有技术存在的问题及缺陷为:
6.(1)现有前列腺癌临床检查测试方法可能导致惰性疾病患者的过度诊断,甚至可能导致不必要的活检,过度治疗甚至非必要的根治性前列腺切除术。
7.(2)传统的bulk rna测序手段是针对细胞集合进行测序,而单个细胞特异性的信息往往被掩盖,导致错失很多重要信息。
8.(3)前列腺癌高度的异质性决定了传统测序不能很好的显示其基因表达方面的差异。
技术实现要素:
9.针对现有技术存在的问题,本发明提供了一种早期前列腺癌的检测用标志物、蛋白分子检测方法及应用。
10.本发明是这样实现的,通过单细胞测序技术对多种前列腺组织样本进行全方面的分析,在确定了癌细胞和正常细胞后,通过拟时序分析,筛选出了可以体现从正常到癌细胞变化过程的五种基因,通过对这五种基因标志物进行免疫组化的验证,可以达到判定鉴别细胞的作用。
11.一种早期前列腺癌的检测用标志物,早期前列腺癌的检测用标志物包括gadd45a、pdzk1ip1、nipal3、rab3b以及rcan3;
12.其中,标志物gadd45a的核苷酸序列为seq id no:1,pdzk1ip1的核苷酸序列为seq id no:2,nipal3的核苷酸序列为seq id no:3,rab3b的核苷酸序列为seq id no:4,rcan3的核苷酸序列为seq id no:5。
13.本发明的另一目的在于提供一种实施所述的早期前列腺癌的检测用标志物的早期前列腺癌的检测用标志物的筛选方法。
14.进一步,早期前列腺癌的检测用标志物的筛选方法包括:
15.在对前列腺组织样本单细胞悬液经过细胞活率及杂质等细胞质检后,获得合格上机测序细胞;下机数据经过基因数、表达分子数与细胞中线粒体基因百分比的指标对低质量细胞进行过滤后,获得用于下游分析的高质量细胞。
16.进一步,早期前列腺癌的检测用标志物的筛选方法还包括:
17.初步细胞聚类出28个亚群,合并注释后鉴定出管腔细胞、基底细胞、t细胞、巨噬细胞、内皮细胞、平滑肌细胞、成纤维细胞、b细胞、肥大细胞、浆细胞以及神经细胞共11个细胞谱系。对管腔细胞进行再分群聚类,将管腔细胞分为luminal1、luminal2和luminal3三群管腔细胞。通过infer cnv分析,luminal1为前列腺癌细胞;通过拟时序分析,luminal3细胞出现于拟时序分析的起点位置并且存在于整个过程中,是正常的管腔细胞;对从正常管腔细胞到前列腺癌细胞拟时序过程中差异最大的6种基因进行分析,确定gadd45a和pdzk1ip1表达逐渐降低,nipal3、rab3b和rcan3表达逐渐升高。
18.本发明的另一目的在于提供一种实施所述的早期前列腺癌的检测用标志物的早期前列腺癌的蛋白分子检测方法。
19.进一步,早期前列腺癌的蛋白分子检测方法包括:
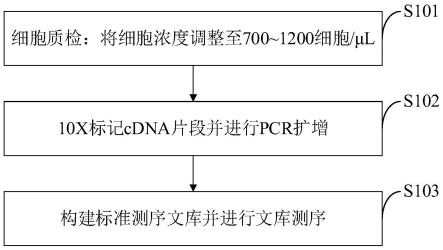
20.通过单细胞测序技术和拟时序分析筛选出五种显示从管腔细胞到癌细胞变化的基因,通过检测五种基因确定细胞状态;通过对组织切片进行免疫组化染色,通过观察蛋白分子表达水平实现早期前列腺癌的检测。
21.进一步,早期前列腺癌的蛋白分子检测方法包括以下步骤:
22.步骤一,细胞质检:将细胞浓度调整至700~1200细胞/μl;
23.步骤二,10x标记cdna片段并进行pcr扩增;
24.步骤三,构建标准测序文库并进行文库测序。
25.进一步,步骤二中的10x标记cdna片段包括:含有barcode信息的凝胶珠与细胞和酶的混合物结合后,被位于微流体系统中的油表面活性剂液滴包裹,形成gems;gems流到储液器中并被收集,凝胶珠溶解释放barcode序列,逆转录cdna片段,并对样本进行标记;将凝胶珠破碎并打碎油滴,以cdna为模板进行pcr扩增;将所有gems的产物混合,构建标准测序文库。
26.进一步,步骤三中的标准测序文库的构建及文库测序包括:
27.将cdna酶切打断成200~300bp的片段,加上测序接头和引物进行二代测序的建库过程,再进行pcr扩增得到dna文库;利用illumina测序平台的双端测序模式对构建得到的dna文库进行高通量测序。
28.其中,生物信息学分析流程包括:
29.(1)利用10x genomics官方分析软件cell ranger对原始数据进行数据过滤、比对、定量以及鉴定回收细胞,最终得到各细胞的基因表达矩阵;
30.(2)采用seurat进行细胞过滤、标准化、细胞亚群分类、各亚群差异表达基因分析以及marker基因筛选。
31.本发明的另一目的在于提供一种所述的早期前列腺癌的检测用标志物在制备早期前列腺癌检测用试剂盒和/或装置中的应用。
32.结合上述的技术方案和解决的技术问题,本发明所要保护的技术方案所具备的优点及积极效果为:
33.第一,针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
34.本发明通过特殊基因的筛选发现,通过infer cnv分析,其中luminal1为前列腺癌细胞;通过拟时序分析发现,luminal3细胞出现于拟时序分析的起点位置并且存在于整个过程中,是一种正常的管腔细胞,对从正常管腔细胞到前列腺癌细胞拟时序过程中差异最大的6种基因进行了分析,本发明发现gadd45a,pdzk1ip1表达逐渐降低,nipal3,rab3b,rcan3表达逐渐升高。
35.本发明通过单细胞测序技术和拟时序分析筛选出五种可以显示从管腔细胞到癌细胞变化的基因,通过检测这五种基因可以确定细胞状态。另外,本发明可以通过对组织切片进行免疫组化染色,通过观察蛋白分子表达水平实现早期前列腺癌的检测,对前列腺癌的早期识别提供了理论依据。
36.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
37.本发明提供了一种早期前列腺癌的蛋白分子检测方法及相应的基因,该蛋白分子检测方法能够通过特异性的蛋白运用免疫组化方法来识别前列腺癌细胞,或者通过后续制作为试剂盒用于前列腺癌细胞的检测。
38.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
39.(1)本发明的技术方案转化后的预期收益和商业价值为:本发明提出了从正常细胞到前列腺癌细胞过程中指示变化的基因,可以通过本发明提出的分子标志物及方法确定细胞状态,提高前列腺癌细胞的检测。
40.(2)本发明的技术方案解决了人们一直渴望解决、但始终未能获得成功的技术难题:本发明提供了从正常细胞到癌细胞变化明显的基因表达,可以通过检测这些基因,判断细胞类型,减少穿刺活检的风险。
附图说明
41.为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
42.图1是本发明实施例提供的早期前列腺癌的蛋白分子检测方法流程图;
43.图2是本发明实施例提供的通过单细胞测序鉴定前列腺组织样本中的不同细胞类型的示意图;
44.图3是本发明实施例提供的通过单细胞测序鉴定管腔细胞中的不同细胞类型的示意图;
45.图4是本发明实施例提供的管腔细胞中中不同类型细胞的cnv分析示意图;
46.图5是本发明实施例提供的使用管腔细胞重建癌细胞发展的伪时间轨迹,并识别轨迹期间变化的基因示意图。
具体实施方式
47.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
48.针对现有技术存在的问题,本发明提供了一种早期前列腺癌的检测用标志物、蛋白分子检测方法及应用,下面结合附图对本发明作详细的描述。
49.一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
50.本发明实施例提供的早期前列腺癌的检测用标志物包括gadd45a、pdzk1ip1、nipal3、rab3b以及rcan3;
51.其中,标志物gadd45a的核苷酸序列为seq id no:1,pdzk1ip1的核苷酸序列为seq id no:2,nipal3的核苷酸序列为seq id no:3,rab3b的核苷酸序列为seq id no:4,rcan3的核苷酸序列为seq id no:5。
52.gadd45a:[source:hgnc symbol]
[0053]
atgactttggaggaattctcggctggagagcagaagaccgaaaggatggataaggtgggggatgccctggaggaagtgctcagcaaagccctgagtcagcgcacgatcactgtcggggtgtacgaagcggccaagctgctcaacgtcgaccccgataacgtggtgttgtgcctgctggcggcggacgaggacgacgacagagatgtggctctgcagatccacttcaccctgatccaggcgttttgctgcgagaacgacatcaacatcctgcgcgtcagcaacccgggccggctggcggagctcctgctcttggagaccgacgctggccccgcggcgagcgagggcgccgagcagcccccggacctgcactgcgtgctggtgacgaatccacattcatctcaatggaaggatcctgccttaagtcaacttatttgtttttgccgggaaagtcgctacatggatcaatgggttccagtgattaatctccctgaacggtga
[0054]
pdzk1ip1:[source:hgnc symbol]
[0055]
atgtcggccctcagcctcctcattctgggcctgctcacggcagtgccacctgccagctgtcagcaaggcctggggaaccttcagccctggatgcagggccttatcgcggtggccgtgttcctggtcctcgttgcaatcgcctttgcagtcaaccacttctggtgccaggaggagccggagcctgcacacatgatcctgaccgtcggaaacaaggcagatggagtcctggtgggaacagatggaaggtactcttcgatggcggccagtttcaggtccagtgagcatgagaatgcctatgagaatgtgcccgaggaggaaggcaaggtccgcagcaccccgatgtaa
[0056]
nipal3:[source:hgnc symbol]
[0057]
nncgtggctgggatgcttgtcttgtccattcaagggaacctgcagcttgactaccccatcttctacgtgatgttcgtgt gcatggtggcaaccgccgtctatcaggctgccttctccaagacagattcttcacctgctaatgagaacaacagtccctacct
[0058]
aagagaatcacatgaagctcttatgagaatgtctctagggaaatgcccggtttttgagtcaagcctcacagatgtacga
[0059]
ctcctctttgattgccagtgtgggctacattctgtccacaaccattgctatcacagcaggtgcaatattttacctggacttcatcggggaggacgtgctgcacatctgcatgtttgcactggggtgcctcattgcattcttgggcgtcttcttaatcacgcgtaa
[0060]
rab3b:[source:hgnc symbol]
[0061]
atggcttcagtgacagatggtaaaactggagtcaaagatgcctctgaccagaattttgactacatgtttaaactgcttatcattggcaacagcagtgttggcaagacctccttcctcttccgctatgctgatgacacgttcaccccagccttcgttagcacc
[0062]
gtgggcatcgacttcaaggtgaagacagtctaccgtcacgagaagcgggtgaaactgcagatctgggacacagctggg
[0063]
caggagcggtaccggaccatcacaacagcctattaccgtggggccatgggcttcattctgatgtatgacatcaccaatgaagagtccttcaatgctgtccaagactgggctactcagatcaagacctactcctgggacaatgcacaagttattctggtggggaacaagtgtgacatggaggaagagagggttgttcccactgagaagggccagctccttgcagagcagcttgggtttgatttctttgaagccagtgcaaaggagaacatcagtgtaaggcaggcctttgagcgcctggtggatgccatttgtgacaagatgtctgattcgctggacacagacccgtcgatgctgggctcctccaagaacacgcgtctctcggacaccccaccgctgctgcagcagaactgctcatgctag
[0064]
rcan3:[source:hgnc symbol]
[0065]
atgctgagggacactatgaaatcttggaatgatagccagtcagatctgtgtagcactgaccaagaagaggaagaagagatgatttttggtgaaaatgaagatgatttggatgagatgatggatttaagtgatctgcctacctcactttttgcttgcagcgtccatgaagcagtgtttgaggcacgagagcagaaggaaagatttgaagcactcttcaccatctatgatgaccaggttacttttcagctgtttaaaagctttagaagagtcagaataaatttcagcaaacctgaagcggcagcaagagcgcgaatagaactccacgaaacagacttcaatgggcagaagctaaagctatattttgcacaggtgcagatgtccggcgaagtgcgggacaagtcctatctcctgccgccccagcctgtcaagcagttcctcatctcccctccagcctctcccccggtggggtggaagcagagcgaagatgcgatgcctgttataaattatgatttactctgtgctgtttccaaattgggaccaggagagaaatatgaacttcacgcgggaacagagtcgacacccagcgtggtggttcatgtctgtgaaagtgaaactgaagaggaagaagagacaaaaaaccccaaacagaaaattgcccagacgaggcgccccgaccctccgaccgcagcgttgaatgagccccagacctttgattgcgcgctgtga
[0066]
如图1所示,本发明实施例提供的早期前列腺癌的蛋白分子检测方法包括以下步骤:
[0067]
s101,细胞质检:将细胞浓度调整至700~1200细胞/μl;
[0068]
s102,10x标记cdna片段并进行pcr扩增;
[0069]
s103,构建标准测序文库并进行文库测序。
[0070]
本发明实施例提供的10x标记cdna片段包括:含有barcode信息的凝胶珠与细胞和酶的混合物结合后,被位于微流体系统中的油表面活性剂液滴包裹,形成gems;gems流到储液器中并被收集,凝胶珠溶解释放barcode序列,逆转录cdna片段,并对样本进行标记;将凝胶珠破碎并打碎油滴,以cdna为模板进行pcr扩增;将所有gems的产物混合,构建标准测序文库。
[0071]
本发明实施例提供的标准测序文库的构建及文库测序包括:将cdna酶切打断成
200~300bp的片段,加上测序接头和引物进行二代测序的建库过程,再进行pcr扩增得到dna文库;利用illumina测序平台的双端测序模式对构建得到的dna文库进行高通量测序。其中,生物信息学分析流程包括:
[0072]
(1)利用10x genomics官方分析软件cell ranger对原始数据进行数据过滤、比对、定量以及鉴定回收细胞,最终得到各细胞的基因表达矩阵;
[0073]
(2)采用seurat进行细胞过滤、标准化、细胞亚群分类、各亚群差异表达基因分析以及marker基因筛选。
[0074]
作为优选实施例,本发明实施例提供的早期前列腺癌的检测用标志物的筛选方法具体包括以下步骤:
[0075]
(1)特殊基因的筛选:在对13例前列腺组织样本单细胞悬液经过细胞活率及杂质等细胞质检后,获得合格上机测序细胞数为112587个。下机数据经过基因数、表达分子数与细胞中线粒体基因百分比等指标对低质量细胞进行过滤后获得可供下游分析的高质量细胞共82473个。
[0076]
初步细胞聚类出28个亚群,合并注释后鉴定出管腔细胞、基底细胞、t细胞、巨噬细胞、内皮细胞、平滑肌细胞、成纤维细胞、b细胞、肥大细胞、浆细胞、神经细胞11个细胞谱系。对其中管腔细胞进行再分群聚类,将其分为luminal1,luminal2和luminal3三群管腔细胞。通过infer cnv分析,其中luminal1为前列腺癌细胞。通过拟时序分析发现,luminal3细胞出现于拟时序分析的起点位置并且存在于整个过程中,是一种正常的管腔细胞,对从正常管腔细胞到前列腺癌细胞拟时序过程中差异最大的6种基因进行了分析,本发明发现gadd45a,pdzk1ip1表达逐渐降低,nipal3,rab3b,rcan3表达逐渐升高。对前列腺癌的早期识别提供了理论依据。
[0077]
(2)组化验证:通过单细胞测序技术和拟时序分析本发明筛选出五种可以显示从管腔细胞到癌细胞变化的基因,通过检测这五种基因,可以确定细胞状态,本发明可以通过对组织切片进行免疫组化染色,通过观察蛋白分子表达水平实现早期前列腺癌的检测。
[0078]
二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
[0079]
应用实施例1:通过对本发明提及到的相关基因标记物,后续将会设计为试剂盒的形式,用于实验室该前列腺细胞的判定。
[0080]
应用实施例2:在对相关前列腺组织进行判断时,可以通过对本发明涉及的相关基因进行免疫组化验证,从而判定组织类型。
[0081]
三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
[0082]
本发明实施例在5位患者身上通过前列腺穿刺活检术获取5例前列腺癌样本,其中3例还取了匹配的前列腺癌周边组织样本,在一位患者身上通过前列腺穿刺活检术获取了两例正常样本,在另外3位患者身上通过膀胱全切术获取3例正常前列腺组织。在预冷的磷酸盐缓冲盐水(pbs)中洗涤以去除血液污染后,将样品解剖成碎片(《10mm3)用于病理检查和单细胞悬液制备。
[0083]
(1)细胞质检
[0084]
将细胞浓度调整到理想浓度,一般是700~1200细胞/μl。
[0085]
(2)10x标记cdna片段
[0086]
含有barcode信息的凝胶珠与细胞和酶的混合物结合,然后被位于微流体系统中的油表面活性剂液滴包裹,形成gems(gel beads-in-emulsions)。gems流到储液器中并被收集,凝胶珠溶解释放barcode序列,逆转录cdna片段,并对样本进行标记。将凝胶珠破碎并打碎油滴,以cdna为模板进行pcr扩增。将所有gems的产物混合,构建标准测序文库。
[0087]
(3)构建标准测序文库
[0088]
首先将cdna酶切打断成200~300bp左右的片段,加上测序接头和引物等传统二代测序的建库过程,最后进行pcr扩增得到dna文库。
[0089]
(4)文库测序
[0090]
利用illumina测序平台的双端测序模式对建好的文库进行高通量测序。
[0091]
生物信息学分析流程:
[0092]
(1)利用10x genomics官方分析软件cell ranger(https://support.10xgenomics.com/single-cell-gene-expression/software/overview/welcome)对原始数据进行数据过滤、比对、定量、鉴定回收细胞,最终得到各细胞的基因表达矩阵。
[0093]
(2)后续采用seurat(https://satijalab.org/seurat/)进行进一步的细胞过滤、标准化、细胞亚群分类、各亚群差异表达基因分析及marker基因筛选。
[0094]
图2是通过单细胞测序鉴定前列腺组织样本中的不同细胞类型图,umap图证明前列腺组织中的主要细胞簇根据其特征基因表达谱进行着色和标记。细胞过滤:
[0095]
10x项目捕获到的细胞中,部分细胞活性低甚至为死细胞,本发明基于细胞表达的基因数量进行细胞过滤(不同样本类型表达的基因数量不一致,具体项目会采用不同阈值),本发明的高质量细胞指标如下:
[0096]
1.单细胞中鉴定到的gene数量(500-inf)
[0097]
2.单细胞中umi的总数小于inf
[0098]
3.单细胞中线粒体基因表达比例小于25%
[0099]
4.使用doubletfinder包去除多细胞
[0100]
此外,还对基因进行了过滤,保留至少在1个细胞中表达的基因。
[0101]
低质量细胞的过滤利用的是seurat数据分析r包,其功能包括质控、过滤、数据标准化、pca分析,tsne、差异基因分析等,同时具备分析结果可视化的功能(butler et al.,2018)。通过对cellranger结果的基因表达数据进行过滤并进一步的分析,可以提高分析结果质量。
[0102]
单细胞亚群分类分析:
[0103]
(1)去除低质量细胞后,使用seurat软件的“normalization”函数的lognormalize方法,进行表达量均一化.
[0104]
(2)通过主成分分析降维,减少变量然后利用均一化后的表达量值进行pca(principal component analysis)分析。从pca分析结果中选取前10个主成分用于后续的聚类和分群分析。
[0105]
(3)聚类和分群分析:seurat软件使用基于图论的聚类算法对细胞进行聚类和分
群。主要包括以下步骤:
[0106]
a)构建细胞间的聚类关系:利用显著的主成分构建基于欧式距离的knn聚类关系图;
[0107]
b)优化细胞间聚类关系距离的权重值:利用jaccard相似性优化细胞间距离的权重值;
[0108]
c)聚类和分群:通过基于共享最近邻居(shared nearest neighbor,snn)模块优化的聚类算法识别细胞聚类,即首先计算k-最近邻并构造snn图,然后优化模块化功能以确定集群。
[0109]
图3是通过单细胞测序鉴定管腔细胞中的不同细胞类型示意图,根据不同的标记基因可将管腔细胞分为cluster1,cluster2,cluster3三种类型;以luminal细胞为总体,重复单细胞亚群分类分析过程。
[0110]
图4是管腔细胞中中不同类型细胞的cnv分析示意图。由图4可以看出,luminal5,7,12,13,15即cluster1为前列腺癌细胞。使用infercnv r包通过每个染色体区域内基因的表达水平来估计初始cnv[20]。分析基因的相对表达值限制为[-1,1]。本发明认为b细胞是非恶性细胞,并使用其平均估计的cnv作为背景来确定哪个管腔细胞簇是恶性的。
[0111]
图5是使用管腔细胞重建癌细胞发展的伪时间轨迹,并识别轨迹期间变化的基因示意图。图5中,cluster1代表1型管腔细胞即癌细胞;cluster2代表2型管腔细胞;cluster3代表3型正常管腔细胞;伪时间以从黑色到灰色的渐变着色。伪时间的开始用黑色表示,伪时间的结束用浅灰色表示。管腔细胞通过特征基因表达谱分为7种状态。确定了分化起点后,monocle可以模拟出每个细胞所处的分化时间,并寻找随着分化时间逐渐升高或降低的基因表达分布图,该图挑选了差异前6的基因进行绘制,图中每个点表示一个细胞,不同颜色表示不同cluster,纵坐标表示该基因的表达水平。拟时序分析用monocle 2通过反向图形嵌入自动学习单细胞轨迹和分支点。每个细胞表示为高维空间(x)中的一个点,其中每个维对应于有序基因的表达水平。通过降维方法(例如pca)将数据投影到低维空间(z)上,monocle 2在使用k均值聚类自动选择的一组质心上构建生成树。然后将细胞移向最近的树顶点,将顶点位置更新为“适合”的细胞,学习新的生成树,然后迭代该过程,直到树和细胞收敛为止。
[0112]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1