一种金耳多糖及其制备方法和应用
1.本发明涉及一种金耳多糖,还涉及其制备方法与应用。
背景技术:
2.现代药理学已经证明来源于植物的多糖具有多种功能活性,如抗癌、抗氧化、降血糖、降血脂、抗炎、增强免疫等,如今植物多糖在食药及保健品领域的应用也越来越广泛。金耳(naematelia aurantialba(bandoni&m.zang)millanes& wedin),又名金黄银耳、脑耳、黄木耳,是耳包革科、耳包革属真菌。金耳含有丰富脂肪,蛋白质和铁、镁、钙、钾等微量元素,是一种营养滋补品,并可作为药用。
3.公开号为cn104187608a的发明专利公开了一种降血糖作用的保健食品及其制备方法,该保健食品中添加了金耳和茶树菇发酵物、提取物,然而该发明并没有明确其降糖功效。公开号为cn112089828a的发明专利公开了一种生物发酵型复方三价铬的降血糖组合,其中包含三价铬酵母、灵芝、金耳、番石榴叶、枸杞、地黄、金顶侧耳、蛹虫草和葛根;该组合复杂,成本高,不利于市场拓展。公开号为cn101225361b的发明专利公开了一种具有降糖功效的含半萜金耳发酵液的发酵工艺,但由于原料单一,天然产物单独使用降血糖效果不显著,虽具有一定的降糖功效,但不能达到非常理想的效果。公开号为cn104758309b、 cn100506238c、cn101862346b、cn103127227a分别公开了树莓多糖、苦瓜多糖、人参酸性多糖、桑叶多糖的降糖效果,但这些原料的多糖得率低,不利于工业化生产;西药联用却又会在降血糖的过程中产生依赖性,具有一定的毒副作用。
技术实现要素:
4.发明目的:本发明的目的是提供一种高效降血糖、且依赖性和毒性低的金耳多糖,第二目的是提供上述金耳多糖的制法,第三目的是提供上述金耳多糖的应用。
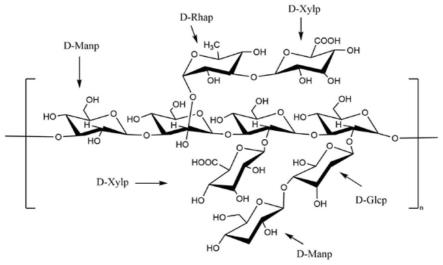
5.技术方案:本发明所述的金耳多糖,为如下式1所示的化合物,其中,n为大于等于1的自然数;
6.7.优选的,所述金耳多糖由甘露糖、鼠李糖、葡萄糖和木糖四种单糖构成,以摩尔百分比计,各单糖的配比为甘露糖67.39%~67.84%,鼠李糖1%~10.17%,葡萄糖1%~18.23%,木糖21.89%~28.29%。
8.优选的,所述金耳多糖的均值分子量为428kda。
9.上述金耳多糖的制备方法,包括以下步骤:
10.(1)将金耳子实体粉碎过筛得金耳粉;将金耳粉和乙醇按照料液比1:5~1:8 混合,加热回流取残渣干燥得金耳干粉;
11.(2)将所得的金耳干粉,按照料液比为1:40~1:80与水混合,浸提得到料液混合物;再将料液混合物离心,取上清液并减压浓缩得金耳多糖浓缩液;
12.(3)用氯仿-正丁醇混合溶液对金耳多糖浓缩液进行脱蛋白处理,两者的体积比为2:1~4:1;震荡混合,静置分层后取上层糖液;
13.(4)将上层糖液加入大孔树脂进行脱色,收集滤液得即为脱色后的金耳多糖浓缩液;
14.(5)向所得的脱色后的金耳多糖浓缩液中加入无水乙醇,其中无水乙醇占总体积的70%~80%,静置后离心,得到金耳粗多糖沉淀,冻干后得到金耳粗多糖样品;
15.(6)对金耳粗多糖样品进行分离得金耳多糖。
16.优选的,步骤(1)具体为:金耳子实体预处理:将金耳子实体洗净干燥,粉碎过筛得金耳粉;将金耳粉和乙醇按照料液比(g/ml)1:5~1:8混合,加热回流,过滤得粉渣,取粉渣重复加热回流的提取步骤,取残渣干燥得金耳干粉;
17.优选的,所述干燥温度为40~60℃,采用40~60目筛粉碎过筛;所述加热回流温度为60~70℃回流时间为4~5h,所述重复加热回流为2~4次,所述干燥温度为45~60℃,干燥时间为24~48h。
18.优选的,步骤(2)具体为:取金耳干粉按照料液比(g/ml)为1:40~1:80与水混合,浸提得到料液混合物;再将料液混合物离心,取上清液即得金耳多糖提取液,减压浓缩得金耳多糖浓缩液。
19.优选的,所述浸提温度为85~95℃,浸提时间为3~6h,重复2~4次;所述离心,离心力为5000~8000g,离心时间为5~10min;所述减压浓缩为浓缩至原体积的1/3~1/5。
20.优选的,步骤(4)中,大孔树脂为大孔树脂d101、聚酰胺树脂或ab-8中的一种;树脂与浓缩液的体积比为1:5~1:8,脱色10~12h;
21.优选的,步骤(5)中,所述静置温度1~4℃,静置时间为24~48h,所述离心条件为5000~8000g的离心力下离心8~15min。
22.优选的,步骤(6)具体为:采用离子交换层析柱对金耳粗多糖样品进行分离,将金耳粗多糖配置成10~20mg/ml的多糖水溶液,除质后上样至离子交换层析柱中进行梯度洗脱,采用苯酚硫酸法对所得洗脱液进行多糖含量测定,将同一洗脱峰下的洗脱液合并旋蒸浓缩,再进行透析、冷冻、干燥得金耳多糖。
23.优选的,所述洗脱液为超纯水或0.1~0.4mol/l的nacl溶液,洗脱流速在0.5~1 ml/min,每管8~10ml;所述离子交换层析柱的填料为deae-52cellulose、 deae-sepharose fast flow或sp-sepharose fast flow中的一种;所述多糖含量测定为在490nm下测定吸光值,以管号为横坐标,吸光值为纵坐标绘制多糖洗脱曲线;所述透析为采用3000~5000da的
透析袋对浓缩液透析36~48h,期间每6~8 小时换一次超纯水,透析温度为1~4℃。
24.本发明所述的金耳多糖在制备降血糖药物中的应用。
25.优选的,所述金耳多糖通过抑制α-葡糖苷酶的活性,辅助二甲双胍改善胰岛素抵抗,应用于金耳多糖胶囊、金耳多糖复配营养粉或金耳多糖口服液的制备中。
26.本发明的金耳多糖是一种新型植物多糖,分子量均一,结构明确,具有抑制α-葡糖苷酶的活性,从而抑制了大分子的葡萄糖分解成双糖、单糖,进而降低了餐后血糖。餐后血糖的降低会使胰岛素分泌水平也相应的降低,辅助糖尿病阳性药二甲双胍增加胰岛素抵抗模型的葡萄糖摄取量,与二甲双胍的联合使用可有效减轻糖尿病的胰岛素抵抗。
27.有益效果:与现有技术相比,本发明具有如下显著优点:(1)可以抑制α-葡糖苷酶的活性,也可以辅助糖尿病阳性药二甲双胍增加胰岛素抵抗模型的葡萄糖摄取量,与二甲双胍的联合使用可有效改善糖尿病的胰岛素抵抗;相比于普通单独作用的其他多糖,本发明的金耳多糖与二甲双胍联合使用,比单独使用二甲双胍效果增加了33%,起到了提质增效的作用;
28.(2)本发明的制备方法所制得的多糖产率高,工艺简单可行,且适合应用于大规模工业化生产,可以充分提取,高效利用,避免浪费,以提高植物真菌的综合利用度,具有广阔的市场前景。
附图说明
29.图1为tabp-3组分的分子结构示意图;
30.图2为tabp粗多糖在deae-52阴离子交换柱的色谱洗脱图;
31.图3为tabp-3组分的单糖组分的高效液相色谱分析;
32.图4为tabp-3组分的分子量分布图;
33.图5为tabp-3组分的红外光谱图;
34.图6为tabp-3组分对α-葡糖苷酶的抑制效果;
35.图7为tabp-3组分对hepg2的细胞毒性;
36.图8为tabp-3组分对胰岛素抵抗的改善作用;
37.图9为tabp-3联合二甲双胍对胰岛素抵抗的改善作用。
具体实施方式
38.下面结合附图对本发明的技术方案作进一步说明。
39.实施例1
40.(1)金耳原料预处理:将新鲜的金耳子实体清洗干净,切成1cm
×
1cm大小的块状,放于托盘中,在55℃恒温鼓风干燥箱中干燥48h。粉碎后过40目筛得金耳全粉。按照料液比(g/ml)1:8的比例将金耳全粉与无水乙醇混合,在65℃的水浴锅中加热回流5h,过滤后取残留物,重复上述加热回流步骤3次,最后将残留物置于50℃的鼓风干燥箱中干燥48h。
41.(2)将经过预处理的金耳干粉按照料液比(g/ml)为1:50与水混合,于90℃下浸提5h,重复2次;将料液混合物于8000g的离心力下离心10min,取上清即为金耳多糖提取液,减压浓缩至原体积的1/3,得金耳多糖浓缩液。
42.(3)采用sevag试剂(氯仿:正丁醇=4:1)对金耳多糖浓缩液进行脱蛋白处理,将金
耳浓缩液与sevag试剂混合,两者体积比为4:1,震荡混合8min,重复震荡10次,直至肉眼观察不到蛋白残留,静置分层后取上层液;
43.(4)将步骤3)中所得的上层糖液加入大孔树脂ab-8进行脱色,树脂与浓缩液的体积比为1:5,脱色12h,收集滤液得即为脱色后的金耳多糖浓缩液。
44.(5)向步骤4)中所得的脱色后的金耳多糖浓缩液中加入无水乙醇至乙醇占总体积的80%,在4℃中静置48h后,于8000g的离心力下离心10min,得到金耳粗多糖沉淀,冻干后得到金耳粗多糖样品。
45.(6)采用离子交换层析柱对多糖样品进行分离,所用填料为deae-52 cellulose。将步骤5)所得金耳粗多糖加超纯水配置成15mg/ml的多糖水溶液,过0.45μm水系滤膜除去多糖水溶液中的杂质。将该多糖水溶液上样至离子交换层析柱中,依次用超纯水和0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l的nacl 溶液对其进行梯度洗脱,控制洗脱流速在1ml/min,每管10ml,采用苯酚硫酸法对所得各管洗脱液进行多糖含量测定,于490nm下测定吸光值,以管号为横坐标,吸光值为纵坐标绘制多糖洗脱曲线(图2),测定完毕后将同一洗脱峰下的各管洗脱液合并旋蒸浓缩,采用3500da的透析袋对浓缩液透析48h,期间每6 小时换一次超纯水,透析温度为4℃,透析完毕后冷冻干燥得金耳多糖各组分。其中用超纯水洗脱的命名为tabp-1,用0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l 的nacl溶液洗脱的组分分别命名为tabp-2、tabp-3、tabp-4、tabp-5。
46.金耳多糖各组分离子交换柱层析曲线如图2所示,其中tabp-3的得率最高, tabp-1和tabp-4得率次之,其次是tabp-2、tabp-5的得率最少,可忽略不计。
47.实施例2
48.(1)金耳原料预处理:将新鲜的金耳子实体清洗干净,切成1cm
×
1cm大小的块状,放于托盘中,在60℃恒温鼓风干燥箱中干燥48h。粉碎后过40目筛得金耳全粉。按照料液比(g/ml)1:6的比例将金耳全粉与无水乙醇混合,在70℃的水浴锅中加热回流6h,过滤后取残留物,重复上述加热回流步骤3次,最后将残留物置于55℃的鼓风干燥箱中干燥48h。
49.(2)将经过预处理的金耳干粉按照料液比(g/ml)为1:60与水混合,于85℃下浸提6h,重复2次;将料液混合物于8000g的离心力下离心10min,取上清即为金耳多糖提取液,减压浓缩至原体积的1/4,得金耳多糖浓缩液。
50.(3)采用sevag试剂(氯仿:正丁醇=4:1)对金耳多糖浓缩液进行脱蛋白处理,将金耳浓缩液与sevag试剂混合,两者体积比为3:1,震荡混合10min,重复震荡12次,直至肉眼观察不到蛋白残留,静置分层后取上层液;
51.(4)将步骤3)中所得的上层糖液加入大孔树脂ab-8进行脱色,树脂与浓缩液的体积比为1:4,脱色10h,收集滤液得即为脱色后的金耳多糖浓缩液。
52.(5)向步骤4)中所得的脱色后的金耳多糖浓缩液中加入无水乙醇至乙醇占总体积的80%,在4℃中静置36h后,于8000g的离心力下离心15min,得到金耳粗多糖沉淀,冻干后得到金耳粗多糖样品。
53.(6)采用离子交换层析柱对多糖样品进行分离,所用填料为deae-52 cellulose。将步骤5)所得金耳粗多糖加超纯水配置成10mg/ml的多糖水溶液,过0.45μm水系滤膜除去多糖水溶液中的杂质。将该多糖水溶液上样至离子交换层析柱中,依次用超纯水和0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l的nacl 溶液对其进行梯度洗脱,控制洗脱流速在0.8ml/
min,每管8ml,采用苯酚硫酸法对所得各管洗脱液进行多糖含量测定,于490nm下测定吸光值,以管号为横坐标,吸光值为纵坐标绘制多糖洗脱曲线,测定完毕后将同一洗脱峰下的各管洗脱液合并旋蒸浓缩,采用5000da的透析袋对浓缩液透析48h,期间每8小时换一次超纯水,透析温度为4℃,透析完毕后冷冻干燥得金耳多糖各组分。其中用超纯水洗脱的命名为tabp-1,用0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l的 nacl溶液洗脱的组分分别命名为tabp-2、tabp-3、tabp-4、tabp-5。
54.金耳多糖各组分离子交换柱层析曲线与实施例1相似,nacl溶液洗脱的各组分特性基本相同。
55.实施例3
56.(1)金耳原料预处理:将新鲜的金耳子实体清洗干净,切成1cm
×
1cm大小的块状,放于托盘中,在60℃恒温鼓风干燥箱中干燥48h。粉碎后过40目筛得金耳全粉。按照料液比(g/ml)1:7的比例将金耳全粉与无水乙醇混合,在6℃的水浴锅中加热回流8h,过滤后取残留物,重复上述加热回流步骤2次,最后将残留物置于60℃的鼓风干燥箱中干燥24h。
57.(2)将经过预处理的金耳干粉按照料液比(g/ml)为1:60与水混合,于95℃下浸提8h,重复2次;将料液混合物于8000g的离心力下离心15min,取上清即为金耳多糖提取液,减压浓缩至原体积的1/2,得金耳多糖浓缩液。
58.(3)采用sevag试剂(氯仿:正丁醇=4:1)对金耳多糖浓缩液进行脱蛋白处理,将金耳浓缩液与sevag试剂混合,两者体积比为2:1,震荡混合10min,重复震荡8次,直至肉眼观察不到蛋白残留,静置分层后取上层液;
59.(4)将步骤3)中所得的上层糖液加入大孔树脂ab-8进行脱色,树脂与浓缩液的体积比为1:8,脱色10h,收集滤液得即为脱色后的金耳多糖浓缩液。
60.(5)向步骤4)中所得的脱色后的金耳多糖浓缩液中加入无水乙醇至乙醇占总体积的70%,在4℃中静置36h后,于8000g的离心力下离心10min,得到金耳粗多糖沉淀,冻干后得到金耳粗多糖样品。
61.(6)采用离子交换层析柱对多糖样品进行分离,所用填料为deae-52 cellulose。将步骤5)所得金耳粗多糖加超纯水配置成10mg/ml的多糖水溶液,过0.45μm水系滤膜除去多糖水溶液中的杂质。将该多糖水溶液上样至离子交换层析柱中,依次用超纯水和0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l的nacl 溶液对其进行梯度洗脱,控制洗脱流速在1ml/min,每管10ml,采用苯酚硫酸法对所得各管洗脱液进行多糖含量测定,于490nm下测定吸光值,以管号为横坐标,吸光值为纵坐标绘制多糖洗脱曲线,测定完毕后将同一洗脱峰下的各管洗脱液合并旋蒸浓缩,采用3500da的透析袋对浓缩液透析48h,期间每6小时换一次超纯水,透析温度为4℃,透析完毕后冷冻干燥得金耳多糖各组分。其中用超纯水洗脱的命名为tabp-1,用0.1mol/l、0.2mol/l、0.3mol/l、0.4mol/l的 nacl溶液洗脱的组分分别命名为tabp-2、tabp-3、tabp-4、tabp-5。
62.金耳多糖各组分离子交换柱层析曲线与实施例1相似,nacl溶液洗脱的各组分特性基本相同。
63.按以上实施例1制得的新型金耳多糖通过以下所述方法进行结构鉴定和活性分析,实施例2和实施例3的结果与实施例1相似。
64.实施例4:金耳多糖的单糖组成分析
65.采用高效液相色谱测定金耳多糖的单糖组成。多糖样品处理:用超纯水将多糖配置成2mg/ml的多糖水溶液,取100μl多糖溶液于4ml的ep管中,加入 100μl的三氟乙酸(4mol/l),震荡混匀,密封后置于102℃鼓风干燥箱中反应2 h,取出后于70℃下减压蒸干,加入200μl甲醇后蒸干,重复三次以保证完全去除残留的三氟乙酸。样品的pmp衍生化:加入100μlnaoh溶液(0.3mol/l)和 100μlpmp甲醇溶液(0.5mol/l),震荡混匀,密封后置于70℃鼓风干燥箱反应 2h。取出后冷却至室温,向管中加入100μl的hcl溶液(0.3mol/l)混匀,减压蒸干后加入水和氯仿各1.5ml,混匀静置30min,弃上层氯仿,最后将下层水相多糖溶液过0.22μm水系滤膜,上机分析。色谱条件为:采用高效液相色谱仪进行检测,使用c18色谱柱,检测器为紫外检测器;柱温30℃;流速0.8ml/min,进样量20μl,流动相为0.1m的pbs缓冲液-乙腈混合液(83:17)。取各种单糖标准品(木糖、鼠李糖、甘露糖、岩藻糖、半乳糖、葡萄糖、半乳糖醛酸、阿拉伯糖),分别按照上述pmp衍生化步骤处理,并进行色谱分析,根据标准品的保留时间,确定多糖样品中的各单糖组分,并根据单糖峰面积及摩尔质量计算出样品中各单糖组分的摩尔百分比。
66.图3为金耳多糖tabp-3的液相色谱图,由该图可知,tabp-3主要由甘露糖、鼠李糖、葡萄糖、木糖构成。摩尔百分比分别为67.39%,7.87%,1.23%和22.91%。表明该多糖组分为杂多糖,其主链可能由甘露糖基组成。
67.实施例5:分子量的测定
68.多糖样品的分子量采用gpc进行检测,采用安捷伦凝胶渗透色谱仪,色谱柱为tsk-g5000pwxl柱,流动相为0.01mol/l的pbs缓冲液;流速0.6ml/min;柱温45℃,检测器为示差折光检测器。
69.如图4所示,根据标准曲线计算地金耳多糖的平均分子量为428kda。
70.实施例6:金耳多糖的红外光谱分析
71.取2mg金耳多糖tabp-3的红外光谱采用nicolet is50光谱仪(nicolet is50,tmo,美国)测定,在400-4000cm-1
区间进行扫描,采集tabp-3的红外光谱图。
72.如图5所示,多糖样品在3372.8cm-1附近有一个宽大的峰,该峰属于-oh 的特征吸收振动峰;在2932.7cm-1
附近的峰属于c-h的特征吸收振动峰,可以依据这两大类特征峰初步判定该物质属于多糖类化合物。在1600.3cm-1
附近的峰属于乙酰基团或者羧酸酯化合物中的c=o伸缩振动峰,1416.3cm-1处的吸收峰属于-oh的变形振动吸收峰;1246.2cm-1
处的属于o-c-o伸缩振动吸收峰;1046.2 cm-1
处的吸收峰是属于吡喃环的特征吸收振动峰;802.1cm-1
处的吸收峰说明该物质中存在α-构型的葡萄糖单元。
73.实施例7:多糖甲基化分析
74.称取15mg金耳多糖于20ml具塞试管中,加入4ml dmso,超声辅助多糖溶解,向其中加入200mg的naoh粉末,继续超声1h使naoh溶解,反应体系变成黄色,即停止反应。在氮气保护下加入3ml碘甲烷,在干燥、避光的环境中静置12h,加入4ml蒸馏水停止反应。静置分层后,弃上层液,取下层溶液,加蒸馏水重复3次,直至dmso完全被去除。加入4ml氯仿萃取甲基化后的多糖,重复萃取4次,合并萃取后的氯仿萃取液减压浓缩,将浓缩液透析48h,冷冻干燥。取甲基化后的多糖,加5ml三氟乙酸,密封后在102℃环境下反应6 h,减压蒸干。用色谱纯的甲醇洗涤水解物以除去过量的三氟乙酸,减压蒸干后加入3ml超纯水和20mg硼氢化钠,混合均匀。震荡反应10h。反应结束后,用醋酸调节ph为7,旋蒸至干。再用色谱级甲醇反复清
洗3次。随后按体积比1:1 的比例加入醋酸吡啶,轻微震荡。反应完毕后加入2ml超纯水终止反应。再加入2ml二氯甲烷萃取,充分震荡后静置,重复萃取三次,合并二氯甲烷相。加入无水硫酸钠去除多余的水分。过0.22μm滤膜后进gc-ms分析。
75.gc-ms条件:采用配备有hp-5ms(30m
×
0.25mm
×
0.25μm)毛细管柱的安捷伦7890气相色谱仪检测,以高纯氦气为载气,流速1ml/min;进样量1μl,分流比10:1,进样口温度250℃。升温程序为:初始温度150℃,保持2min,然后以10℃/min的速率升温至180℃,保持2min,以15℃/min的速率升温至260℃,保持5min。离子源为电子轰击离子源,离子源温度250℃,碰撞能量为70ev,质量范围为:m/z 33-500。
76.结果表明:金耳多糖主要由(1-3,6)-甘露糖(67.39%),β-木糖(22.91%),鼠李糖(18.23%),(1-4)-葡萄糖(7.87%)构成。
77.实施例8:金耳多糖对α-葡糖苷酶的抑制作用
78.所有样品溶液均由ph=7.0的磷酸盐缓冲液(0.1mol/l)配制。配制1u/ml 的α-葡糖苷酶、5mm的对硝基苯α-d-吡喃葡萄糖苷(ppng)、0.5~3.0mg/ml的金耳多糖溶液。将100μl的α-葡糖苷酶溶液与100μl金耳多糖溶液混合均匀,在 37℃下孵育10min,再向混合溶液中加入100μl的ppng溶液,混合均匀后在37℃下孵育20min。向反应液中加入1ml1 mol/l的碳酸钠溶液以终止反应,于405nm 波长处测定吸光值。按以下公式计算金耳多糖样品对α-葡糖苷酶的抑制率:
79.α-葡糖苷酶抑制率(%)=[1-((a样品-acontrol-1))/(acontrol-2)]
×
100
[0080]
公式中a样品是金耳多糖,酶和ppng混合液的吸光值,acontrol-1是缓冲液代替酶溶液后混合物的吸光度值,acontrol-2是缓冲溶液代替样品溶液的吸光度值,测试结果如图6所示,随着金耳多糖溶液浓度的升高,对α-葡糖苷酶的抑制率也逐渐升高,表明金耳多糖溶液可以抑制α-葡糖苷酶的活性。
[0081]
实施例9:金耳多糖(tabp-3)对hepg2细胞毒性实验
[0082]
将hepg2细胞以2
×
103个/孔接种于96孔板中,过夜培养。弃去原有培养基,给以100μl新鲜培养基配制的不同浓度的tabp-3溶液(2、4、8、16、32、64、 128μm)继续培养24h。培养结束后,采用cck8试剂盒测定毒性。结果如图7 所示,在浓度小于等于1.6mg/ml时,tabp-3组分对hepg2细胞无显著性毒性。
[0083]
实施例10:金耳多糖(tabp-3)辅助二甲双胍降血糖的功效
[0084]
tabp-3单独作用组:将hepg2细胞以2
×
103个/孔铺于96孔板中,培养过夜,待细胞贴壁后弃去原有培养基,设置对照组、模型组、实验组,分别为:
①
对照组:加入200μl新鲜dmem培养基;
②
模型组:每孔加入200μl用完全dmem 培养基配制的16mm的盐酸葡萄糖胺溶液;
③
met阳性组:加入200μl用模型组溶液配制的8μg/ml的二甲双胍(meformin)溶液;
④
tabp-3-l组:加入200 μl用模型组溶液配制的0.1mg/ml的金耳多糖溶液;
⑤
tabp-3-m组:加入200 μl用模型组溶液配制的0.4mg/ml金耳多糖溶液;
⑥
tabp-3-h组:加入200μl 用模型组溶液配制的1.6mg/ml金耳多糖溶液。用葡萄糖含量检测试剂盒检测上清中葡萄糖的含量。葡萄糖吸收量=空白孔中葡萄糖含量-实验组上清中葡萄糖含量。
[0085]
tabp-3+二甲双胍联合作用组:将hepg2细胞以2
×
103个/孔铺于96孔板中,培养过夜,待细胞贴壁后弃去原有培养基,设置对照组、模型组、实验组,分别为:
①
对照组:加入200μl新鲜dmem培养基;
②
模型组:每孔加入200 μl用完全dmem培养基配制的16mm的盐酸葡
萄糖胺溶液;
③
met阳性组:加入200μl用模型组溶液配制的8μg/ml的二甲双胍(meformin)溶液;
④ꢀ
tabp-3-l+met组:加入200μl用阳性组溶液配制的0.1mg/ml的金耳多糖溶液;
⑤
tabp-3-m+met组:加入200μl用阳性组溶液配制的0.4mg/ml金耳多糖溶液;
⑥
tabp-3-h+met组:加入200μl用阳性组溶液配制的1.6mg/ml金耳多糖溶液。用葡萄糖含量检测试剂盒检测上清中葡萄糖的含量。葡萄糖吸收量=空白孔中葡萄糖含量-实验组上清中葡萄糖含量。
[0086]
结果如图8和图9所示,图8为单独添加tabp-3组时hepg2细胞的葡萄糖吸收情况,图9为二甲双胍与tabp-3联合作用时hepg2细胞的葡萄糖吸收情况情况,其中glucosamine为建模使用的盐酸葡萄糖胺溶液,metformin为糖尿病阳性药二甲双胍,tabp-3为金耳多糖。tabp-3单独作用可有效改善胰岛素抵抗, tabp-3和二甲双胍联合使用可有效提高阳性药的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1