用于检测宫颈癌的试剂盒及其应用的制作方法
本发明涉及生物检测领域,特别涉及一种于检测宫颈癌的试剂盒及其应用。
背景技术:
1、dna甲基化为dna化学修饰的一种形式,能够在不改变dna序列的前提下,改变遗传表现。dna甲基化是指在dna甲基化转移酶的作用下,在基因组cpg二核苷酸的胞嘧啶5'碳位共价键结合一个甲基基团。大量研究表明,dna甲基化能引起染色质结构、dna构象、dna稳定性及dna与蛋白质相互作用方式的改变,从而控制基因表达,在肿瘤的发生和发展中起着重要的调控作用。因此,差异表达的甲基化dna是肿瘤早期诊断和预后监测的重要生物标记物。亚硫酸盐依赖的检测方法(bs)是临床上核酸基因甲基化检测的金标准。这种方法是dna经亚硫酸盐处理后,未甲基化的胞嘧啶(c)被转化成尿嘧啶(u),甲基化的胞嘧啶保持不变。处理后的dna通过测序或使用特异性引物pcr得到非常准确的dna序列甲基化位点信息。但是其操作步骤繁琐、耗时时间长、实验条件严苛,加上靶基因易降解、转化不完全且回收率低,这些固有的缺点导致结果基因甲基化(尤其是丰度极低的基因)检测结果分析不准确和结果重复性较差,严重限制了其在临床检测效果。
2、而甲基化敏感限制性内切酶(msre)刚好可以克服bs的缺点,这种方法是利用甲基化敏感性限制性内切酶对甲基化区域不切割的特性,将dna消化为不同大小的片段后再进行后续分析。由于其反应条件较为温和,可以极大的避免了dna的降解。此外,与bs需要产物回收和纯化相比,msre反应的酶切产物通常不需要纯化即可进行后续的检测反应。但是此检测方法通常检测灵敏度比较低,需要产物的进一步扩增,即需要昂贵的pcr仪。pcr是使用最为广泛的核酸扩增技术,以其灵敏性、特异性得到广泛应用,然而pcr需要反复的热变性,无法摆脱依赖仪器设备的局限,从而限制了其在临床现场检测中的应用。
3、自20世纪90年代初,很多实验室开始发展无需热变性的恒温扩增技术,现已开发出重组聚合酶扩增技术(rpa)、环介导等温扩增技术(lamp)、链替代等温扩增技术(sda)、滚环等温扩增技术(rca)等温扩增技术等技术。其中,如sda、rca和rpa已经成功的用于甲基化基因的检测。sda和rca是一个耗时较长的实验,需要数小时才能使目的产物达到峰值,导致其在甲基化检测中灵敏度较低。然而rpa能够在半小时内使目的产物扩增量达到峰值且具有极高的准确度,因此被广泛用于疾病检测中。
4、近年来,基于规律间隔成簇短回文重复序列(crispr)技术的核酸检测如sherlock、detectr,因其快速又灵敏的特性备受关注。在先前的研究中,crispr/cas12b结合bs技术(称为holmesv2)已经被用于dna甲基化检测中。然而,holmesv2检测过程复杂限制了其在临床上的应用。因此,开发快速、灵敏、简单易用的甲基化基因检测技术,对于临床上疾病检测显得非常重要。
技术实现思路
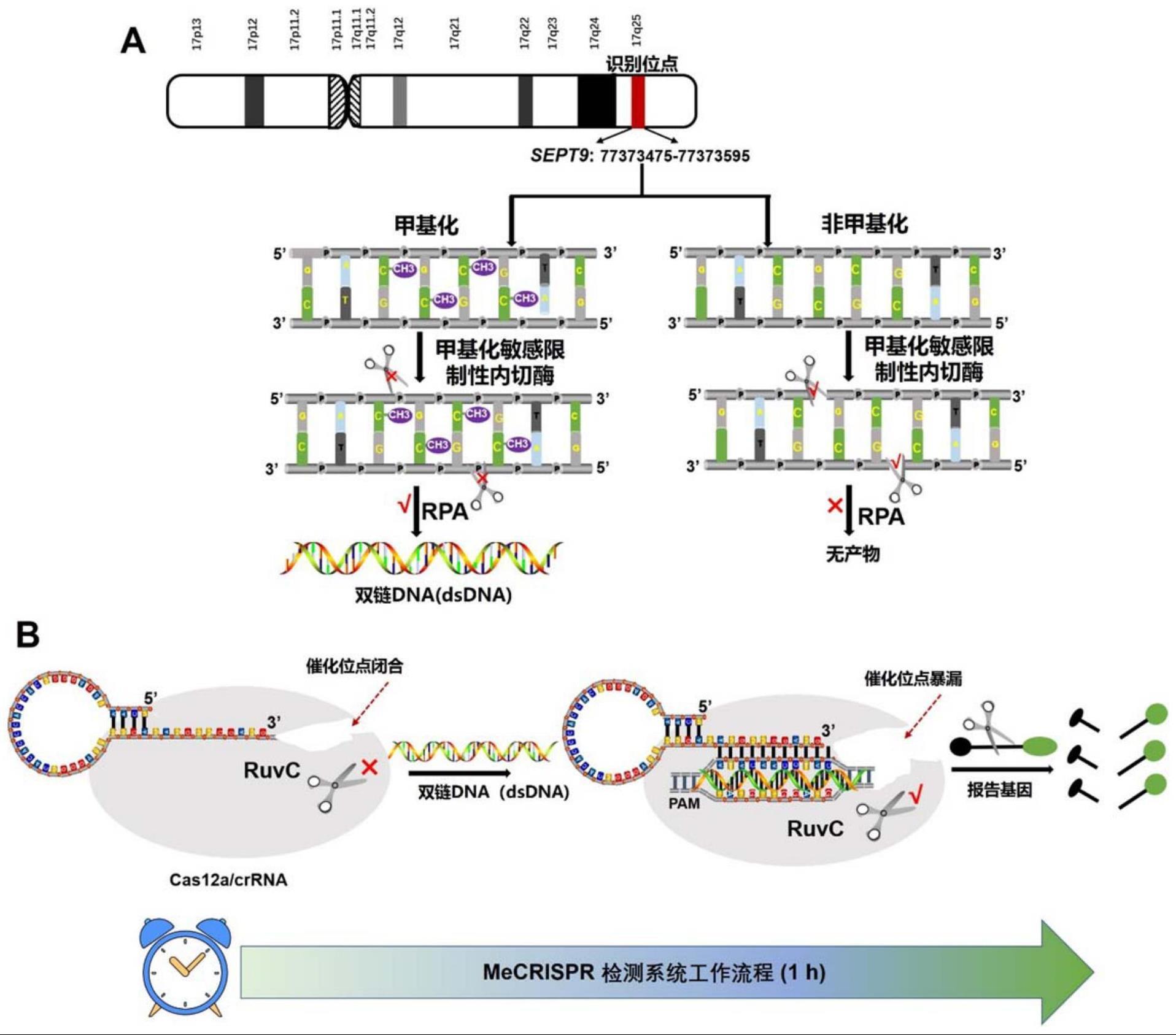
1、为了解决上述问题,本发明提供一种用于检测宫颈癌的试剂盒,所述试剂盒包括检测sept9基因启动子sept9:77373475-77373595的甲基化试剂。
2、本发明提供一种基于等温扩增方法和crispr/cas方法结合直接检测宫颈癌的poct试剂盒,所述试剂盒是检测sept9基因启动子sept9:77373475-77373595片段的甲基化试剂盒,所述试剂盒包括:组分1:其包括甲基化敏感限制性内切酶,所述限制性内切酶消化人基因组dna,此时甲基化修饰的目的序列片段会保持完整而非甲基化的序列片段会被特异性的切割;组分2:其包括等温扩增试剂,所述等温扩增试剂对于所述甲基化修饰的目的序列片段进行扩增,得到双链dna,而所述非甲基化的序列片段则不进行等温扩增;和组分3:crispr/cas12a试剂,所述试剂对所述双链dna进行特异性识别,进而激活cas12a酶反式切割活性切割具有荧光基团的单链报告dna,产生荧光信号以直接检测所述甲基化修饰的目的序列片段。
3、在一种实施方式中,所述甲基化敏感限制性内切酶是核酸内切酶bstui,所述等温扩增试剂是rpa等温扩增试剂。
4、在一种实施方式中,所述crispr/cas12a试剂包括crrna、cas12a酶和具有荧光基团的单链报告dna,所述crrna引导cas12a酶识别所述双链dna,对所述甲基化修饰的目的序列片段进行特异性切割,所述双链dna中包括与crrna特异性结合的核酸片段,该核酸片段起始序列是tttn序列,n为a、c、g三者中任意一种碱基;所述具有荧光基团的单链报告dna被激活的cas12a酶切割后产生荧光信号以进行特异性的检测。
5、在一种实施方式中,所述基因组dna浓度为不高于2.5ng/μl。
6、在一种实施方式中,所述核酸内切酶bstui浓度为不低于0.75u/μl,优选地为1u/μl。
7、在一种实施方式中,所述rpa等温扩增试剂中镁离子浓度为10-25mm,优选地为10mm。
8、在一种实施方式中,所述rpa等温扩增的扩增时间为5-30分钟,优选为15分钟。
9、在一种实施方式中,所述rpa等温扩增试剂中引物浓度为100-600nm,优选地为400nm。
10、在一种实施方式中,所述rpa等温扩增试剂中温度为38-43℃,优选地为42℃。
11、在一种实施方式中,所述cas12a反应温度为35-45℃,优选地为45℃。
12、当前已有的甲基化基因检测方法,如金标准亚硫酸盐依赖方法需要强酸和高温等严苛条件导致的dna降解和检测失败,msre虽然反应条件温和可以避免dna降解,但消化不完全导致检测准确度和灵敏度有待提高。
13、与现有技术的dna甲基化检测方法相比,当前其他技术用的都是线性的dna检测难度较低,没有用具有超螺旋结构的基因组dna,因此本发明所述方法用的是基因组dna更贴近临床应用,且检出限较低,检测范围较宽。此外,整个反应可以在1h内完成,因此非常适合即时检测(poct)。
14、具体地,本发明提供了一种基于甲基化敏感限制性内切酶(msre)技术的等温扩增(rpa)与crispr/cas12a(mecrispr)系统结合dna甲基化检测系统,与传统的甲基化特异性pcr相比,基于核酸内切酶bstui的rpa反应条件温和,检测速度快(整个反应低于1h)。在dna甲基化检测中表现出良好的性能,能够对极低低浓度(1copy/μl)和含量(0.01%)的甲基化水平进行准确检测。此外,mecrispr在宫颈癌临床检测中的灵敏度和特异性可高达100%和92.3%,具有极好的应用价值和前景。
15、本发明利用bstui的特异性,能够对甲基化和非甲基化dna进行有效区分,同时,rpa对靶dna的高效扩增可以产生大量的dsdna(双链dna),随后dsdna被cas12a特异性的识别,识别过程中需要pam位点,从而避免了rpa技术非特异性扩增的缺陷,最后激活crispr/cas12a的反式切割活性对荧光基团修饰的单链报告基因进行非特异性切割产生荧光信号,从而使本发明所述检测方法具有较高的灵敏度和选择性,良好的抗干扰能力和重复性。
16、由于产生的dsdna与crrna部分互补,从而激活cas12a的反式切割活性。cas12a可以任意切割附近的荧光报告探针(诸如fam-dna-bhq1)来释放绿色荧光信号。此外,本发明所述方法还可以通过改变检测方式,使用紫外灯分析以实验可视化即时检测。当sept9存在甲基化修饰时,可以激活rpa反应短时间扩增出大量dsdna,进而激活cas12a的反式切割活性,从而非特异性切割单链的fam-dna-bhq1报告基因。含有fam集团修饰的报告探针切割后,在480nm激发光波长下,在525nm波长下有吸收峰,且在紫外灯下能够检测到绿色荧光信号。相反,未甲基化的sept9,由于无法激活cas12a反式切割活性,因此在480nm激发波长或紫外灯下,无明显的绿色荧光信号。基于传感器的检测原理,可以成功区分sept9的甲基化修饰情况,并可应用于即时检测或高通量检测平台。
17、在本发明中,sept9基因启动子sept9:77373475-77373595(121bp)含有3个5’-cgcg-3’的酶切位点。甲基化dna和未甲基化dna首先经过bstui甲基化敏感限制性内切酶处理,该酶可以识别和消化“5’-cgcg-3’”位点。因此,未甲基化的dna会被bstui切断。非甲基化修饰的sept9完全被bstui消化。相反,甲基化sept9没有影响,结构保持完整。结构完整的甲基化sept9被用来激活rpa扩增反应。在rpa系统中,重组酶与引物结合定位双链中的同源序列,并以指数方式扩增靶区。因此,通过rpa扩增实验可以获得大量的dsdna。同时,获得的dsdna,因pam序列位点的存在,使其可以被cas12a酶特异性识别,增加了其检测的特异性。而crispr/cas12a系统的高特异性和自放大能力进一步提高了本检测系统的检测性能。
18、在本发明中我们所选的msre(bstui)在该片段中能够识别并切割3个含有5'-cgcg-3’的序列,进而保证非甲基化的dna被完全消化。此外,rpa反应扩增出的大量dsdna,在pam位点的辅助下被crispr/cas12a特异性识别,激活其反式切割活性,用于荧光检测(可视化和高通量)。mecrispr系统由于在真实临床样本检测中具有较高的灵敏度和特异性,可用于实际临床诊断中宫颈癌的检测。
- 还没有人留言评论。精彩留言会获得点赞!