腺相关病毒突变体及其应用的制作方法
1.本发明涉及生物医药技术领域,具体涉及一种腺相关病毒突变体及其应用。
背景技术:
2.腺相关病毒(avv)是长约4.7kb单链dna片段组成的非致病缺陷病毒。aav基因组包含于非包膜病毒衣壳中,可分成三个功能区域:两个开放阅读框和末端反向重复序列。重组腺相关病毒载体(raav)源于非致病的野生型腺相关病毒,作为一种重要的基因载体,由于其具有宿主范围广、非致病性、低免疫原性、长期稳定表达外源基因、良好的扩散性能和物理性质稳定等优点,被广泛应用于基因功能研究和基因治疗领域。不同的血清型对组织和细胞有着不同的特异亲嗜性,转染效率有所差别。
3.肿瘤免疫疗法是利用免疫系统自身的特异能力来识别并杀死肿瘤细胞,是当前肿瘤治疗领域应用前景的治疗方法之一。随着近几年对肿瘤免疫疗法的深入研究,多种类型的疗法在难治复发肿瘤中出现很好的疗效,如抗体偶联药物、双靶向抗体、car-t疗法和tcr-t疗法等。在破坏全身患病细胞中,t细胞具有重要作用。免疫检查点抑制剂和肿瘤浸润淋巴细胞的相关研究表明了t细胞治疗癌症的潜力。但t细胞需要适当的肿瘤特异性,有足够的数量,并且克服任何局部免疫抑制因素,才能有效。因此,研发一种对t细胞具有高效靶向性,且不会影响t细胞的活性的病毒体具有巨大的临床价值和商业意义。
技术实现要素:
4.本发明的目的在于克服现有技术的不足之处而提供一种具有静息或激活t细胞靶向性的腺相关病毒突变体及其应用,该腺相关病毒突变体对静息或激活t细胞更好的感染能力,具有剂量低、感染力强、安全性好的优点。
5.为实现上述目的,本发明采取的技术方案如下:
6.第一方面,本发明筛选了一种具有t细胞靶向性的异源肽,所述异源肽的氨基酸序列为如seq id no.1-5中任一所示的序列。
7.本发明筛选包含所述异源肽的aav衣壳蛋白突变体所构建得到的重组腺相关病毒载体靶向静息或激活t细胞的效率高,具有剂量低、感染力强、安全性好的优点。作为本发明所述的异源肽的优选实施方式,所述异源肽的核苷酸序列为如seq id no.6-10中任一所示的序列。
8.第二方面,本发明提供了一种具有t细胞靶向性的avv衣壳蛋白突变体,包括所述的异源肽。
9.本发明筛选所得的aav衣壳蛋白突变体无需整合基因组,所构建得到的重组腺相关病毒感染激活的t细胞可实现快速感染和回输,减少不必要的质检和体外停留时间;本发明所筛选所得的aav衣壳蛋白突变体构建得到的重组腺相关病毒载体感染刺激因子刺激后的t细胞,也具有非常优异的表现。使用本发明筛选所得的aav衣壳蛋白突变体感染静息或激活t细胞具有巨大的临床价值和商业应用场景。
10.作为本发明所述的avv衣壳蛋白突变体的优选实施方式,由所述异源肽插入或置换aav衣壳蛋白的5-20个氨基酸而得。
11.作为本发明所述的avv衣壳蛋白突变体的优选实施方式,所述异源肽的插入位点位于aav衣壳蛋白氨基酸588和589之间。
12.作为本发明所述的avv衣壳蛋白突变体的优选实施方式,其氨基酸序列为如seq id no.11-seq id no.15中任一所示的序列。
13.作为本发明所述的avv衣壳蛋白突变体的优选实施方式,其核苷酸序列为如seq id no.16-seq id no.20中任一所示的序列。
14.第三方面,本发明提供一种具有t细胞靶向性的重组腺相关病毒,包括所述的avv衣壳蛋白突变体。
15.本发明的重组腺相关病毒载体
16.对静息或激活t细胞更好的感染能力,且具有剂量低、感染力强、安全性好的优点。尤其是未激活的t细胞感染可以实现当天收集细胞当天感染,当天回输的优点,极大降低了制备成本,可减少对t细胞活性的影响。
17.作为本发明所述的重组腺相关病毒的优选实施方式,还包括异源目的基因。
18.作为本发明所述的重组腺相关病毒的优选实施方式,所述异源目的基因编码干扰rna、适配体、内切核酸酶、指导rna中任一种基因产物。
19.第四方面,本发明将所述的异源肽、所述的avv衣壳蛋白突变体、所述的重组腺相关病毒在制备用于将基因产物递送至受试者细胞的药物中应用。
20.作为本发明所述应用的优选实施方式,所述细胞为免疫细胞。
21.第五方面,本发明将所述的异源肽、所述的avv衣壳蛋白突变体、
22.所述的重组腺相关病毒在感染静息或激活t细胞中应用。
23.第六方面,本发明将所述的异源肽、所述的avv衣壳蛋白突变体、所述的重组腺相关病毒在制备肿瘤免疫治疗药物中应用。
24.作为本发明所述应用的优选实施方式,所述免疫治疗包括car-t疗法或tcr-t疗法。
25.与现有技术相比,本发明的有益效果为:
26.本发明筛选所得的aav衣壳蛋白突变体构建得到的重组腺相关病毒载体靶向t细胞的效率高,具有剂量低、感染力强、安全性好的优点。本发明筛选所得的aav衣壳蛋白突变体无需整合基因组,所构建得到的重组腺相关病毒感染激活的t细胞可实现快速感染和回输,减少不必要的质检和体外停留时间;本发明所筛选所得的aav衣壳蛋白突变体构建得到的重组腺相关病毒载体感染刺激因子刺激后的t细胞,也具有非常优异的表现。使用本发明筛选所得的aav衣壳蛋白突变体感染静息或激活t细胞具有巨大的临床价值和商业应用场景。
附图说明
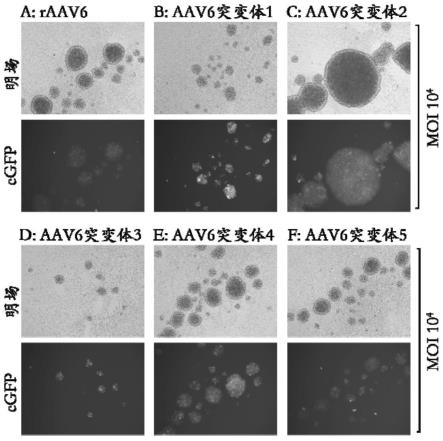
27.图1为荧光显微镜检测不同raav病毒体感染静息t细胞的egfp荧光强度(72h);a为raav6病毒,b-f为aav6衣壳蛋白突变体病毒1-5。
28.图2为荧光显微镜检测不同raav病毒体感染静息t细胞的egfp荧光强度(96h);a为
raav6病毒,b-f为aav6衣壳蛋白突变体病毒1-5。
29.图3为rt-qpcr检测aav6衣壳蛋白突变体病毒1-5感染静息t细胞72h后egfp mrna的相对强度。
30.图4为流式细胞仪检测不同raav病毒体感染静息t细胞96h后表达egfp荧光细胞百分比及强度;a为空白对照,b和c为对照raav6病毒,d-h为aav6衣壳蛋白突变体病毒1-5,h为各组egfp阳性细胞比例统计柱状图。
31.图5为通过荧光素酶活性测定检测不同raav病毒体对静息t细胞的感染能力;a为感染72h后测定荧光素酶活性,b为感染96h后测定荧光素酶活性。
32.图6为荧光显微镜检测参照raav6病毒及aav6衣壳蛋白突变体病毒1在不同moi下感染静息t细胞72h后egfp荧光强度。
33.图7为rt-qpcr检测参照raav6病毒及aav6衣壳蛋白突变体病毒1在不同moi下感染静息t细胞72h后egfp mrna的相对强度。
34.图8为荧光显微镜检测不同raav病毒体感染激活t细胞的egfp荧光强度(72h);a为raav6病毒,b-f为aav6衣壳蛋白突变体病毒1-5。
35.图9为流式细胞仪检测不同raav病毒体在各moi下感染激活t细胞96h后表达egfp荧光细胞百分比及强度;a为对照raav6病毒,b~d为aav6衣壳蛋白突变体病毒1~3,e为各组egfp阳性细胞比例统计柱状图。
36.图10为rt-qpcr检测不同raav病毒体在各moi下感染激活t细胞96h后egfp mrna的相对强度。
具体实施方式
37.为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
38.在以下实施例中所用的试验方法如无特殊说明,均为常规方法;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。aav6 vp1的genbank登录号为af028704.1。
39.实施例1:筛选有效感染未激活t细胞的aav6突变体
40.(1)aav6库骨架载体的构建
41.aav6库骨架载体包含cag启动子、intron、突变的aav6 cap序列[aav6cap序列的t589后序列被去除,n583的t与polya前段的序列构成后续用于酶切骨架的位点bsrg i(tgtaca))]和polya。将上述序列通过基因合成的方式合成,并插入到raav载体的itr之间,形成aav6库骨架载体。
[0042]
(2)突变rep-cap载体的构建
[0043]
通过在aav6中cap序列的vp1、vp2、vp3起始密码的前20bp内引入终止密码子的方式,使rep-cap载体表达rep蛋白,而不能表达cap的vp1、vp2、vp3蛋白,从而避免亲本aav6中cap序列的污染。将上述序列通过基因合成的方式合成,并插入替换rep-cap载体的cap序列。
[0044]
(3)随机7肽载体库的构建
[0045]
设计2条引物(插入位点位于aav6的s588与t589之间,上游引物靶向模板t589后核
酸序列,下游引物靶向cap末端序列),上下游引物5’端均具有与骨架一致的15bp以上同源臂序列。此外上游引物在同源臂序列和靶向序列间引入21bp核酸序列(7*nnk)以将随机7肽引入cap序列中。
[0046]
2条引物(5
’‑
》3’)的碱基序列如下:
[0047]
v6-7p-f:
[0048]
gggactgtggcagtcaatctccagagcagcagcnnknnknnknnkn nknnknnkacagaccctgcgaccggagat;
[0049]
v6-stop-r:
[0050]
cggtttattgattaacaatcgattacaggggacgggtgaggtaac。
[0051]
以包含aav6 cap的载体为模板,利用上述引物pcr扩增获得包含随机序列的片段。将片段进行凝胶电泳和胶回收,得到纯化的随机7肽库的核酸片段;将核酸片段通过gibson同源重组连接的方式连接入aav6库骨架载体(经过bsrg i酶切和胶回收纯化);连接后的载体通过pcr产物纯化试剂盒进行纯化后,用plasmid-safe dnase酶消化,以去除没有连接上的片段;最后再通过pcr产物纯化试剂盒进行纯化后,即得构建好的aav6载体库。
[0052]
(4)aav6突变体病毒库的构建
[0053]
将突变的rep-cap质粒、aav6载体库、phelper质粒共转于hek-293t细胞中,采用碘克沙醇梯度超高速离心纯化腺相关病毒,测量病毒滴度在1
×
10
12
gc/ml~1
×
10
13
gc/ml为合适滴度,得aav6突变体病毒库,放置-80℃备用。
[0054]
(5)t细胞筛选aav6突变体
[0055]
1)t细胞的复苏和aav感染
[0056]
rpmi 1640培养基于37℃预热;取冻存cd3
+
t细胞,快速化冻;将复苏的细胞吸入50ml离心管,加入15ml含1% p/s及10% fbs的rpmi 1640培养基,300g离心10min~15min;用1ml含1% p/s及10% fbs的rpmi 1640培养基重悬细胞,细胞计数(台盼蓝染色,计数细胞总数和死细胞数);在细胞培养板中每孔加入5
×
105细胞悬液;按每孔5
×
108,5
×
109,或5
×
105gc的剂量加入aav6突变体病毒库,感染未激活t细胞。感染1小时或3小时后,每孔加入50u/ml终浓度的rhil-2,用移液枪轻轻吹打混匀。2小时后,以25μl/ml的终浓度每孔加入cd3/cd28 t cell activator,用移液枪轻轻吹打混匀,细胞培养箱中培养48h(37℃,5% co2)。
[0057]
2)总rna提取和rt-pcr
[0058]
将细胞吸入1.5ml离心管中,300g离心10分钟收集细胞,吸去上清。rna提取方法按照transzol up plus rna kit(全式金,er501)说明书。提取rna样品使用primescript
tm iv 1st strand cdna synthesis mix(takara,6215a)进行第一链cdna的合成。随后使用neb q5进行2轮pcr扩增,第一轮使用外侧引物扩增,第二轮使用胶回收的第一轮产物作为模板,或使用ngs引物进行扩增,胶回收对应条带大小的pcr产物送公司进行ngs测序;或使用建库引物进行扩增、胶回收,并按前述的过程进行子载体库的构建、包毒、筛选等过程。筛选出aav衣壳蛋白突变体1-5,其vp1的氨基酸序列分别如seq id no.11-seq id no.15所示、核苷酸序列分别如seq id no.16-seq id no.20所示;vp1中靶向肽的氨基酸序列分别如seq id no.1-seq id no.5所示、核苷酸序列分别如seq id no.6-seq id no.10所示。
[0059]
实施例2:构建aav衣壳蛋白突变体并生产病毒
[0060]
以r aav6为对照,构建aav衣壳蛋白突变体1-5,具体如下:
[0061]
(1)突变型血清型载体的构建和质粒提取
[0062]
将rep-cap质粒用smi i和bsht i双酶切,凝胶电泳并切下5000bp左右的片段条带进行凝胶回收,得到酶切的骨架片段。分别根据筛选获得的目的突变体1-5的cap序列设计引物构建目的突变体aav的质粒。以aav6的rep-cap质粒为模板使用f1+r1引物进行pcr扩增得到目的产物1,同样以aav6的rep-cap质粒为模板用f2+r2引物进行pcr扩增得到目的产物2。骨架与片段,片段与片段间具有同源臂序列,可通过gibson进行多片段组装成完整载体。
[0063]
aav衣壳蛋白突变体1载体构建中pcr产物1的引物为cap-f+ff07-r,pcr产物2的引物为ff07-f+cap-r。所涉及的引物序列(5’至3’)为:
[0064]
ff07-f:
[0065]
ccggctgagaggccgggggtgacagaccctgcgaccggaga;
[0066]
ff07-r:
[0067]
cacccccggcctctcagccgggctgctgctctggagattga。
[0068]
aav衣壳蛋白突变体2载体构建中pcr产物1的引物为cap-f+ff09-r,pcr产物2的引物为ff09-f+cap-r。所涉及的引物序列(5’至3’)为:
[0069]
ff09-f:
[0070]
gatggggcgtttgggtctctgacagaccctgcgaccggaga;
[0071]
ff09-r:
[0072]
cagagacccaaacgccccatcgctgctgctctggagattga。
[0073]
aav衣壳蛋白突变体3载体构建中pcr产物1的引物为cap-f+ff10-r,pcr产物2的引物为ff10-f+cap-r。所涉及的引物序列(5’至3’)为
[0074]
ff10-f:
[0075]
gataataattctaagcagaatacagaccctgcgaccggaga;
[0076]
ff10-r:
[0077]
attctgcttagaattattatcgctgctgctctggagattga。
[0078]
aav衣壳蛋白突变体4载体构建中pcr产物1的引物为cap-f+ff15-r,pcr产物2的引物为ff15-f+cap-r。所涉及的引物序列(5’至3’)为
[0079]
ff15-f:
[0080]
ggtaatgcgtcgaagcaggagacagaccctgcgaccggaga;
[0081]
ff15-r:
[0082]
ctcctgcttcgacgcattaccgctgctgctctggagattga。
[0083]
aav衣壳蛋白突变体5载体构建中pcr产物1的引物为cap-f+ff17-r,pcr产物2的引物为ff17-f+cap-r。所涉及的引物序列(5’至3’)为
[0084]
ff17-f:
[0085]
gctactctgggtgtgtcgactacagaccctgcgaccggaga;
[0086]
ff17-r:
[0087]
agtcgacacacccagagtagcgctgctgctctggagattga。
[0088]
上述aav衣壳蛋白突变体1-5载体构建中涉及的引物cap-f和cap-r的序列为:
[0089]
cap-f:
[0090]
gcatctttgaacaataaatgatttaaatcaggtatgg;
[0091]
cap-r:
[0092]
gttcaactgaaacgaatcaatttattgattaacaggcaattacagg。
[0093]
取1个干净的200μl pcr管做好标记并放在冰盒上,将上述酶切骨架、目的片段1和目的片段2,按骨架:片段摩尔比为1:3配制反应液,pcr仪中50℃反应30min进行重组连接。取50μl感受态细胞在冰上解冻,10μl的连接产物与dh5α感受态细胞混合,冰上放置20min-30min;42℃热激45秒;快速置于冰上冰浴2min,加入400μl复苏soc培养基(不含抗生素),37℃、200rpm培养1h;均匀涂于amp抗性平板(50μg/ml),32℃培养18个小时。挑选单克隆菌,在4ml液体lb培养基(amp+抗性)中扩大培养,32℃培养18小时。
[0094]
菌液经过12000rpm离心1分钟,倒掉上清培养基;加入250μl的buffer p1/rnasea混合液,高速涡旋重悬细菌;加入250μl的buffer p2,上下颠倒8-10次;加入350μl的buffer p3,立即颠倒混匀8-10次让溶液彻底中和;13000rpm离心10分钟,取上清过柱;12000rpm离心1分钟,倒掉废液,加入500μl的pw1,12000rpm离心1分钟,倒掉废液;加入600μl的pw2,12000rpm离心1分钟,倒掉上清;加入600μl的pw2,12000rpm离心1分钟,倒掉上清;12000rpm空转2分钟;加入55℃预热洗脱液30-50μl,静置2分钟,12000rpm离心1分钟。使用微量核酸定量仪进行浓度检测。
[0095]
获得质粒经过浓度检测,经过酶切鉴定的阳性质粒取10μl送测序,阳性质粒保存在-20℃。测序结果表明,获得质粒能够编码变异型衣壳蛋白vp1。最后根据后期测试需要的病毒量提取相关的helper质粒,各组rep-cap质粒(aav6,aav6突变体1-4)质粒以及goi质粒(包含scaav、cag、egfp、wpres、sv40pa)。
[0096]
(2)突变型血清型病毒的包装和纯化
[0097]
将得到的各组(aav6野生型和aav6衣壳蛋白突变体)的rep-cap质粒、表达绿色荧光蛋白(egfp)的质粒或表达萤火虫荧光素酶(firefly luciferase)的质粒、phelper质粒以合适的量共转于hek-293t细胞中,采用碘克沙醇梯度超高速离心纯化aav病毒,测量病毒滴度在1
×
10
12
gc/ml~1
×
10
13
gc/ml为合适滴度,得对照aav6野生型病毒和aav6衣壳蛋白突变体病毒1-5,放置-80℃备用。
[0098]
实施例3:突变血清型感染静息t细胞各指标的对比检测
[0099]
(1)aav感染t细胞和细胞培养
[0100]
设置分组:对照aav6病毒和aav6衣壳蛋白突变体病毒1-5。
[0101]
rpmi 1640培养基于37℃预热;取冻存cd3
+
t细胞,快速化冻;将复苏的细胞吸入50ml离心管,加入15ml含1% p/s及10% fbs的rpmi 1640培养基,300g离心10min~15min;用1ml含1% p/s及10% fbs的rpmi 1640培养基重悬细胞,细胞计数(台盼蓝染色,计数细胞总数和死细胞数);根据细胞计数结果,调整细胞密度为1
×
106cells/ml;按实验分组,在24孔细胞培养板中加入500μl细胞悬液(细胞数为5
×
105细胞/孔),或在96孔细胞培养板中加入100μl细胞悬液(细胞数为1
×
105细胞/孔);每组按moi:1e4(对照aav6高剂量组moi为1e5),分组感染t细胞;moi滴定实验中,每组按moi:1e2、1e3、或1e4分组感染t细胞。感染4小时后,每孔加入50u/ml终浓度的rhil-2,用移液枪轻轻吹打混匀。2小时后,以25μl/ml的终浓度每孔加入cd3/cd28 t cell activator,用移液枪轻轻吹打混匀,置于细胞培养箱中培养(37℃,5% co2)。
[0102]
(2)荧光观察
[0103]
在72h、96h使用荧光显微镜分别对每组t细胞进行荧光拍照(拍照参数和曝光时间保持一致)。
[0104]
(3)目的mrna表达水平检测
[0105]
1)总rna提取:
[0106]
将每组细胞分别吸入1.5ml离心管中,300g,离心15min收集细胞,后吸去液体。rna提取方法按照transzol up plus rna kit(全式金,er501)说明书。每管细胞中加入300μl tranzol up,加60μl氯仿,剧烈震荡30s,室温敷育3min;12,000g,4℃离心10min。转移无色的水相于新的1.5ml rnase-free ep管中,加入等体积的无水乙醇,轻轻颠倒混匀;将得到的溶液和沉淀一起加入离心柱中,12,000g室温离心30s,弃滤液;加500μl cb9,12,000g室温离心30s,弃滤液;重复一次;加入500μl wb9,12,000g室温离心30s,弃滤液;重复一次;12,000g室温离心2min,彻底去除残留的乙醇;将离心柱放入1.5ml rnase-free ep管中,加入50μl rnase-free water在离心柱的中央,室温静置1min;12,000g室温离心1min,洗脱rna;使用微量核酸定量仪检测器进行样品rna浓度检测,测定rna浓度、od260/280、od260/230,把提取好的rna保存于-80℃。每组rna样品使用iii rt supermix for qpcr(+gdna wiper)(诺唯赞,r323)进行第一链cdna的合成。
[0107]
2)定量pcr(qpcr)实验
[0108]
取每组cdna作为模板,按照2
×
sybr green qpcr master mix(bimake,b212203)说明书进行qpcr体系配置,如表1所示:
[0109]
表1 qpcr体系
[0110]
试剂使用量2
×
sybr green qpcr master mix10μl模板1μl上游引物0.5μl下游引物0.5μlrox reference dye0.4μl去离子水up to 20μl
[0111]
引物序列(5
’‑
》3’)如下:
[0112]
egfp-tf:gctggagtacaactacaac;
[0113]
egfp-tr:tggcggatcttgaagttc;
[0114]
gapdh101-f:ctgggctacactgagcacc;
[0115]
gapdh101-r:aagtggtcgttgagggcaatg。
[0116]
qpcr程序设置如表2所示:
[0117]
表2 qpcr程序
[0118][0119]
根据每组的ct值,按公式2^-δδct计算相对表达量。
[0120]
(4)流式细胞仪检测
[0121]
将上述培养96h的各组t细胞收集:每孔细胞和上清收集于1.5ml ep管中,离心8min后去上清。重复洗涤一次,去上清后加入500μl pbs重悬,并用枪头吹散成单细胞悬液,置于冰上待上流式检测。
[0122]
(5)萤火虫荧光素酶活性检测
[0123]
将上述培养72h、96h的各组t细胞转移至荧光素酶检测用96孔板,等体积加入室温的bright-lumi ii萤火虫萤光素酶报告基因检测试剂(碧云天rg052),室温孵育5分钟。使用具有检测化学发光功能的多功能酶标仪进行化学发光检测。
[0124]
实施例4:突变血清型感染激活t细胞各指标的对比检测
[0125]
(1)aav感染t细胞和细胞培养
[0126]
设置分组:对照aav6病毒和aav6衣壳蛋白突变体病毒1-5。
[0127]
rpmi 1640培养基于37℃预热;取冻存cd3
+
t细胞,快速化冻;将复苏的细胞吸入50ml离心管,加入15ml含1% p/s及10% fbs的rpmi 1640培养基,300g离心10min~15min;用1ml含50u/ml终浓度的rhil-2、25μl/ml终浓度的cd3/cd28 t cell activator、1% p/s及10% fbs的rpmi 1640培养基重悬细胞,细胞计数(台盼蓝染色,计数细胞总数和死细胞数);根据细胞计数结果,调整细胞密度为4
×
105cells/ml;按实验分组,在24孔细胞培养板中加入500μl细胞悬液(细胞数为2
×
105细胞/孔);每组按moi:1e2、1e3、1e4或1e5,分组感染t细胞。用移液枪轻轻吹打混匀,置于细胞培养箱中培养(37℃,5%co2)。
[0128]
(2)荧光观察
[0129]
在72h使用荧光显微镜分别对每组t细胞进行荧光拍照。
[0130]
(3)目的mrna表达水平检测
[0131]
1)总rna提取:
[0132]
将每组细胞分别吸入1.5ml离心管中,300g,离心15min收集细胞,后吸去液体。rna提取方法按照transzol up plus rna kit(全式金,er501)说明书。每管细胞中加入300μl tranzol up,加60μl氯仿,剧烈震荡30s,室温敷育3min;12,000g,4℃离心10min。转移无色的水相于新的1.5ml rnase-free ep管中,加入等体积的无水乙醇,轻轻颠倒混匀;将得到的溶液和沉淀一起加入离心柱中,12,000g室温离心30s,弃滤液;加500μl cb9,12,000g室温离心30s,弃滤液;重复一次;加入500μl wb9,12,000g室温离心30s,弃滤液;重复一次;12,000g室温离心2min,彻底去除残留的乙醇;将离心柱放入1.5ml rnase-free ep管中,加
入50μl rnase-free water在离心柱的中央,室温静置1min;12,000g室温离心1min,洗脱rna;使用微量核酸定量仪检测器进行样品rna浓度检测,测定rna浓度、od260/280、od260/230,把提取好的rna保存于-80℃。每组rna样品使用iii rt supermix for qpcr(+gdna wiper)(诺唯赞,r323)进行第一链cdna的合成。
[0133]
2)定量pcr(qpcr)实验
[0134]
取每组cdna作为模板,按照2
×
sybr green qpcr master mix(bimake,b212203)说明书进行qpcr体系配置,如表3所示:
[0135]
表3 qpcr体系
[0136]
试剂使用量2
×
sybr green qpcr master mix10μl模板1μl上游引物0.5μl下游引物0.5μlrox reference dye0.4μl去离子水up to 20μl
[0137]
引物序列(5
’‑
》3’)如下:
[0138]
egfp-tf:gctggagtacaactacaac;
[0139]
egfp-tr:tggcggatcttgaagttc;
[0140]
gapdh101-f:ctgggctacactgagcacc;
[0141]
gapdh101-r:aagtggtcgttgagggcaatg。
[0142]
qpcr程序设置如表4所示:
[0143]
表4 qpcr程序
[0144][0145]
根据每组的ct值,按公式2^-δδct计算相对表达量。
[0146]
(4)流式细胞仪检测
[0147]
将上述培养72h的各组t细胞收集:每孔细胞和上清收集于1.5ml ep管中,离心12min后去上清。重复洗涤一次,去上清后加入500μl pbs重悬,并用枪头吹散成单细胞悬液,置于冰上待上流式检测。
[0148]
上述应用aav衣壳蛋白突变体病毒1-5对静息t细胞感染的结果发现,各衣壳蛋白突变体病毒在不同时间点(72h和96h)较raav6对照病毒具有更高的egfp荧光表达强度。其中,以衣壳蛋白突变体病毒1较raav6对照病毒差异最为明显(图1和图2)。rt-qpcr研究显
示,在相同moi下,衣壳蛋白突变体病毒1-5较raav6对照病毒有28至1.5倍目标基因mrna表达量的提升(图3)。流式细胞仪分析显示,与raav6对照病毒相比,衣壳蛋白突变体病毒1-5均在表达egfp荧光细胞比例上有提升(图4)。值得一提的是,衣壳蛋白突变体病毒2和3在moi:1e4条件下达到对照病毒raav6在moi:1e5条件下对静息t细胞的感染(表达egfp荧光)的比例。尤其,衣壳蛋白突变体病毒2在moi:1e4条件下感染静息t细胞达到30%细胞表达egfp荧光。而对照raav6病毒在moi:1e5条件下感染静息t细胞仅有17.5%细胞表达绿色荧光,仅比moi:1e4条件下对照raav6病毒感染静息t细胞表达绿色荧光细胞比例提升了7.5%。
[0149]
其次,采用对感染后t细胞裂解液荧光素酶活性检测发现,衣壳蛋白突变体病毒1-5在感染后72h和96h,与raav6对照病毒相比,均在t细胞中具有更高的荧光素酶活性(图5)。说明本发明的aav衣壳蛋白突变体对静息t细胞具有更好的感染效果。
[0150]
再次,通过moi滴定实验,我们发现aav衣壳蛋白突变体病毒1在moi:1e2、1e3和1e4感染条件下,较raav6参照病毒在egfp荧光强度和mrna相对表达量上均有显著提升(图6和图7)。这说明本发明的aav衣壳蛋白突变体具有在低剂量下完成高药效的潜质,该潜质具有降低raav在治疗中引起机体免疫反应的优势。
[0151]
另一方面,aav衣壳蛋白突变体病毒1~3在感染激活t细胞时,具有非常优异的表现。流式细胞仪检测发现,在moi:1e2条件下,raav6对照病毒对激活t细胞感染力非常微弱,仅有不足1%细胞表达egfp荧光(见图9)。而该条件下,aav衣壳蛋白突变体病毒1~3感染激活t细胞表达egfp荧光的细胞比例分别为3.8%、7.7%和2.0%。当感染moi提升十倍至moi:1e3时,对照病毒raav6感染激活t细胞表达egfp荧光的细胞比例仍不足1%。而aav衣壳蛋白突变体病毒1~3在moi:1e3条件下感染激活t细胞表达egfp荧光的细胞比例达到20%~30%。在moi达到1e4时,aav衣壳蛋白突变体病毒1~3感染激活t细胞表达egfp荧光细胞比例均在50%以上,而对照病毒raav6仅达到8%。(图9)。rt-qpcr研究显示,与免疫荧光观察和流式细胞仪分析结果一致,在moi:1e4条件下感染激活t细胞时,衣壳蛋白突变体病毒1-3较raav6对照病毒有6至36倍目标基因mrna表达量的提升(图10)。
[0152]
本发明筛选所得的aav衣壳蛋白突变体构建得到的重组腺相关病毒载体靶向静息或激活t细胞的效率高,具有剂量低、感染力强、安全性好的优点。比起现有技术中使用刺激因子刺激后(48h)感染,未激活的t细胞感染可以实现当天收集细胞当天感染,当天回输的优点,极大降低了制备成本。且未经激活的t细胞减少了体外培养和处理时间,可减少对t细胞活性的影响。相较于慢病毒涉及基因组整合,而且感染未激活t细胞的效率相较低,本发明筛选所得的aav衣壳蛋白突变体无需整合基因组,可实现快速感染和回输,减少不必要的质检和体外停留时间。感染刺激因子刺激后的t细胞,本发明所筛选所得的aav衣壳蛋白突变体构建得到的重组腺相关病毒载体也具有非常优异的表现。总之,使用本发明筛选所得的aav衣壳蛋白突变体感染静息或激活t细胞具有巨大的临床价值和商业应用场景。
[0153]
也最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1