一种用于肠道菌群移植的粪菌制备方法与流程
1.本发明涉及一种用于肠道菌群移植的粪菌制备方法,属于肠道菌群移植技术领域。
背景技术:
2.肠道菌群移植也称为粪菌移植(fecal microbiota transplantation,fmt),是一种从健康捐赠者的粪便中分离功能菌群,将其移植至患者消化道,从而重建患者肠道菌群的微生态治疗方法,目前该方法已被用于多种胃肠道和代谢性疾病的治疗,如慢性功能性便秘、难治性艰难梭菌感染、炎性肠病等。
3.追溯fmt的起源,最早用于治疗人类疾病的文字记载是中国东晋时期(公元300-400年)葛洪所著的《肘后备急方》(也称《肘后方》),文中描述用人粪治疗食物中毒、腹泻、发热并濒临死亡的患者,“饮之,即活”。中国明代李时珍所著的《本草纲目》(1596年版)记载了多达二十多种用人粪治病的疗方。近代关于fmt的文献报道可以追溯到1958年,美国科罗拉多大学医学院外科医生beneiseman及其同事,利用健康人的大便制成粪水对4例常规抗生素、激素治疗无效的严重伪膜性肠炎患者实施灌肠。结果成功治愈其中3例垂危患者,另1例患者死于与肠道感染无关的其他疾病。
4.2013年,首项fmt治疗复发性难辨梭状芽孢杆菌性肠炎的临床对照研究证明fmt的疗效显著优于万古霉素。fmt在动物实验和临床试验中均显示出其他治疗方法无法比拟的优越性。《science》和《time》将其评为2013年生物医学的十大突破之一。
5.目前临床开展的肠道菌群移植治疗皆为取供体新鲜粪便制备标准菌液进行治疗。这种新鲜粪菌标准液需要将从粪便采集到治疗过程的时间控制在6h以内,时间紧迫,并且合格供体不易寻找,供体筛选费用较高,这些问题都阻碍了肠道菌群移植的临床应用,因此寻求快捷、高活性的用于肠道菌群移植的粪菌的制备方法尤为重要。
技术实现要素:
6.针对现有技术的不足,本发明提供一种用于肠道菌群移植的粪菌制备方法。
7.本发明的技术方案如下:
8.一种用于肠道菌群移植的粪菌制备方法,包括如下步骤:
9.(1)肠道菌群网状载体制备:将植物纤维编织成网状结构,再将网状结构搭建成圆柱状纤维网,接着将圆柱状纤维网在浓度为2~5%的粘蛋白溶液中摇床浸泡15~20min,摇床转速为10~20rpm,得到肠道菌群网状载体;
10.(2)肠道菌群悬浮液的制备:收集正常健康供体粪便,然后将粪便稀释于生理盐水中,使用均浆机进行摇匀,完成后使用医疗纱布进行过滤,得到肠道菌群悬浮液;
11.(3)仿生肠道的制备:根据医学消化科精准人体肠道解剖模型,制作管状人体肠道模具,然后将透明硅胶注入模具中,固化成型后取出,得到仿生肠道;
12.(4)肠道菌群的体外连续培养:
13.将步骤(1)制备的肠道菌群网状载体置于仿生肠道末端,将步骤(2)制备的肠道菌群悬浮液接种至步骤(3)制备的仿生肠道中,然后依次加入无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶后进行厌氧培养1~4周,每8h重复添加一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶,每24h排出一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶;
14.(5)肠道菌群培养后的收集:
15.取出肠道菌群网状载体,在生理盐水中摇床浸泡4~6次,每次浸泡时间为2~6min,摇床转速为2~10rpm,浸泡后厌氧环境保存,得到用于肠道菌群移植的粪菌。
16.根据本发明优选的,步骤(1)中,所述植物纤维为水果、蔬菜、豆类、坚果、谷物和菌菇的植物纤维。
17.根据本发明优选的,步骤(1)中,所述网状结构的各边线长度一致,为0.1~1cm。
18.根据本发明优选的,步骤(1)中,所述圆柱状纤维网直径为50~100μm,总长度为1.2~1.5m。此圆柱状纤维网形态与后续制备的仿生肠道一致。
19.根据本发明优选的,步骤(2)中,所述粪便和生理盐水的质量体积比为1:(3~30),单位为g/ml。
20.根据本发明优选的,步骤(3)中,所述管状人体肠道模具由芯模和套管构成内部空腔,透明硅胶注入该内部空腔中。
21.根据本发明优选的,步骤(3)中,所述仿生肠道的厚度为1~4mm,长度为9~10m,前4~6m的直径为1~2cm,其余直径为2~3cm。
22.根据本发明优选的,步骤(4)中,所述肠道菌群悬浮液和无菌水的体积比为1:(0.5~1)。
23.根据本发明优选的,步骤(4)中,所述营养剂由以下质量份数的原料组成:
24.水解乳清蛋白2~9份,浓缩乳清蛋白2~10份,大豆分离蛋白2~7份,其他蛋白2~7份,氨基酸预混料1.35~11.5份,核苷酸预混料1~5份,麦芽糊精30~53份,低聚果糖1~5份,低聚半乳糖1~5份,聚葡萄糖1~4份,植物油粉末7~20份,矿物质预混料4~18份,维生素预混料0.23~6.75份;
25.所述的水解乳清蛋白、浓缩乳清蛋白为无乳糖型乳清蛋白;
26.所述其他蛋白为黑豆蛋白、玉米蛋白、小麦蛋白、豌豆蛋白、胶原蛋白、白蛋白或海参蛋白;
27.所述氨基酸预混料以1g计包括:l-谷氨酰胺50~75mg、苏氨酸53~72mg、丝氨酸65~87mg、脯氨酸20~41mg、半胱氨酸2~10mg、牛磺酸0.001~0.006mg,余量为麦芽糊精;
28.所述核苷酸预混料以1g计包括:核苷酸15~35mg,余量为麦芽糊精;所述的核苷酸为5'-单磷酸胞苷(5'-cmp)、5'-单磷酸尿苷(5'-ump)、5'-单磷酸腺苷(5'-amp)、5'-肌苷酸二钠、5'-鸟苷酸二钠、5'-尿苷酸二钠或5'-胞苷酸二钠中的一种或两种以上的混合物;
29.所述矿物质预混料以1g计包括:一水柠檬酸钠128~176mg、氯化钾88~128mg、葡萄糖酸铜0.1~0.8mg、葡萄糖酸镁152~168mg、富马酸亚铁1.5~4mg、葡萄糖酸锌2~6mg、葡萄糖酸锰0.5~3mg、磷酸氢钙97~135mg、碘化钾0.004~0.009mg、亚硒酸钠0.002~0.009mg,氯化铬50~80μg、钼酸铵70~100μg、氟化钾0.3~0.7mg,余量为麦芽糊精;
30.所述维生素预混料以1g计包括:维生素a醋酸酯油0.1~1.5iu、维生素d3 0.01~
0.1iu、维生素e醋酸酯0.1~1mg、维生素k1 0.01~0.1mg、盐酸硫胺素(b1)0.008~0.15mg、核黄素(b2)0.007~0.12mg、盐酸吡哆醇(b6)0.02~0.18mg、氰钴胺(b12)0.01~0.14mg、烟酰胺0.1~1mg、叶酸0.001~0.01mg、d-泛酸钙0.02~0.21mg、l-抗坏血酸1~3mg、生物素0.1~1.4mg、肌醇0.01~0.12mg、左旋肉碱酒石酸盐0.02~0.18mg,余量为麦芽糊精。
31.根据本发明优选的,步骤(4)中,所述淀粉酶的加入量为35~135u/l,蛋白酶的加入量6~20u/l,纤维素酶的加入量为7~15u/l,脂肪酶的加入量为18~30u/l。
32.根据本发明优选的,步骤(4)中,所述厌氧培养过程中仿生肠道ph值为6.5~8.5,仿生肠道外侧为温度为36.9~37.9℃的无菌水,仿生肠道内的气体含量为90~110ml,且通过压力感受器进行监测,压力范围在2~4mm hg;当压力过大时,将多余气体排出,以维持仿生肠道内的气体含量为90~110ml。
33.根据本发明优选的,步骤(4)中,所述厌氧培养过程中仿生肠道分别以分节运动与蠕动相结合的形式进行运动,分节运动为3~5次/分,蠕动的推进速度为0.7~0.9cm/min。所述分节运动的目的是挤压仿生肠道,所述蠕动的目的是将仿生肠道中的物质从上端向下进行推动,分节运动与蠕动均是模拟肠道在人体内部的运动模式。
34.本发明具有的有益效果:
35.1、本发明提供的用于肠道菌群移植的粪菌制备方法通过模拟人体肠道中菌群的生活环境实现了肠道菌群的体外培养,保证了菌群品质和产量的稳定,解除了肠道菌群移植治疗的时间限制,可以根据患者需求及时提供肠道菌群,极大地提升了临床应用的时效性。
36.2、本发明制备的肠道菌群产量大,活性高。相较于传统粪菌,本发明的肠道菌群在缓解炎性肠病患者体重下降、缓解炎性肠病患者食物利用系数下降、缓解炎性肠病患者红细胞数量下降、降低炎性肠病患者白细胞数量和提高肠道有益菌含量方面均有明显提升。
37.3、本发明通过以植物纤维材料为网状载体,然后在网状载体上附着粘蛋白,培养过程肠道菌群附着在网状载体上,使得肠道菌群易于分离和定植,在临床应用上比传统灌肠途径方便,在移植后更容易在体内定植。
38.4、本发明提供的用于肠道菌群移植的粪菌制备方法只需要菌群供体提供少次甚至一次粪菌,克服了菌群供体长期饮食受限,供菌前反复健康体检的问题,降低了肠道菌群移植的费用。并且本发明各流程均为体外人工模拟,从感受上降低操作者及接收者的不适,扩大了应用范围。
具体实施方式
39.下面结合具体实施例来对本发明进行进一步说明,但并不将本发明局限于这些具体实施方式。
40.实施例1
41.一种用于肠道菌群移植的粪菌制备方法,包括步骤如下:
42.(1)肠道菌群网状载体制备:将植物纤维编织成网状结构,再将网状结构搭建成圆柱状纤维网,接着将圆柱状纤维网在浓度为3%的粘蛋白溶液中摇床浸泡18min,摇床转速为15rpm,得到肠道菌群网状载体;
43.所述网状结构的各边线长度一致,均为0.5cm;所述圆柱状纤维网直径为80μm,总
长度为1.35m,此圆柱状纤维网形态与后续制备的仿生肠道一致;
44.(2)肠道菌群悬浮液的制备:收集正常健康人群粪便,然后将粪便按照1:20的质量体积比稀释于生理盐水中,使用均浆机进行摇匀,完成后使用医疗纱布进行过滤,得到肠道菌群悬浮液;
45.(3)仿生肠道的制备:根据医学消化科精准人体肠道解剖模型,制作管状人体肠道模具,所述管状人体肠道模具由芯模和套管构成内部空腔,然后将透明硅胶注入模具内部空腔中,固化成型后取出,得到仿生肠道;
46.所述仿生肠道的厚度为2mm,长度为9.5m,前5m的直径为1.5cm,其余4.5m的直径为2.5cm;
47.(4)肠道菌群的体外连续培养:
48.将步骤(1)制备的肠道菌群网状载体置于仿生肠道末端,将步骤(2)制备的肠道菌群悬浮液接种至步骤(3)制备的仿生肠道中,然后依次加入无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶后进行厌氧培养2周,每8h重复添加一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶,每24h排出一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶;
49.所述肠道菌群悬浮液和无菌水的体积比为1:0.75;所述淀粉酶的加入量为85u/l,蛋白酶的加入量15u/l,纤维素酶的加入量为10u/l,脂肪酶的加入量为25u/l;
50.(5)肠道菌群培养后的收集:
51.取出肠道菌群网状载体,在生理盐水中摇床浸泡5次,每次浸泡时间为5min,摇床转速为5rpm,浸泡后厌氧环境保存,得到用于肠道菌群移植的粪菌。
52.其中,步骤(4)中,所述营养剂由以下质量份数的原料组成:水解乳清蛋白5份,浓缩乳清蛋白6份,大豆分离蛋白5份,其他蛋白5份,氨基酸预混料8份,核苷酸预混料3份,麦芽糊精40份,低聚果糖3份,低聚半乳糖3份,聚葡萄糖3份,植物油粉末10份,矿物质预混料12份,维生素预混料3.5份;
53.所述的其他蛋白为豌豆蛋白、黑豆蛋白、小麦蛋白等重量比的混合物;
54.所述氨基酸预混料,以1g计,原料组成如下:l-谷氨酰胺60.124mg、苏氨酸62.751mg、丝氨酸72.142mg、脯氨酸25.457mg、半胱氨酸5.412mg、牛磺酸0.003mg,余量为麦芽糊精;所述核苷酸预混料,以1g计,核苷酸24.514mg,余量为麦芽糊精;所述核苷酸为5'-单磷酸胞苷(5'-cmp)、5'-单磷酸尿苷(5'-ump)、5'-单磷酸腺苷(5'-amp)和5'-肌苷酸二钠的等重量比例的混合物;所述矿物质预混料,以1g计,原料组成如下:一水柠檬酸钠142.251mg、氯化钾105.542mg、葡萄糖酸铜0.612mg、葡萄糖酸镁158.024mg、富马酸亚铁2.189mg、葡萄糖酸锌4.583mg、葡萄糖酸锰1.521mg、磷酸氢钙120.421mg、碘化钾0.006mg、亚硒酸钠0.005mg,氯化铬71.30μg、钼酸铵85.42μg、氟化钾0.523mg,余量为麦芽糊精;所述维生素预混料,以1g计,原料组成如下:维生素a醋酸酯油0.741iu、维生素d3 0.062iu、维生素e醋酸酯0.584mg、维生素k1 0.068mg、盐酸硫胺素(b1)0.061mg、核黄素(b2)0.053mg、盐酸吡哆醇(b6)0.078mg、氰钴胺(b12)0.07mg、烟酰胺0.557mg、叶酸0.006mg、d-泛酸钙0.135mg、l-抗坏血酸1.687mg、生物素0.738mg、肌醇0.074mg、左旋肉碱酒石酸盐0.084mg,余量为麦芽糊精。
55.所述厌氧培养过程中仿生肠道ph值为7,仿生肠道外侧为温度为37.3℃的无菌水,
仿生肠道内的气体含量为100ml,且通过压力感受器进行监测,压力范围在2~4mm hg;当压力过大时,将多余气体排出,以维持仿生肠道内的气体含量为100ml。
56.所述厌氧培养过程中仿生肠道分别以分节运动与蠕动相结合的形式进行运动,分节运动为4次/分,蠕动的推进速度为0.8cm/min。所述分节运动的目的是挤压仿生肠道,所述蠕动的目的是将仿生肠道中的物质从上端向下进行推动,分节运动与蠕动均是模拟肠道在人体内部的运动模式。
57.实施例2
58.一种用于肠道菌群移植的粪菌的制备方法,包括步骤如下:
59.(1)肠道菌群网状载体制备:将植物纤维编织成网状结构,再将网状结构搭建成圆柱状纤维网,接着将圆柱状纤维网在浓度为2%的粘蛋白溶液中摇床浸泡20min,摇床转速为10rpm,得到肠道菌群网状载体;
60.所述网状结构的各边线长度一致,均为0.1cm;所述圆柱状纤维网直径为50μm,总长度为1.2m,此圆柱状纤维网形态与后续制备的仿生肠道一致;
61.(2)肠道菌群悬浮液的制备:收集正常健康人群粪便,然后将粪便按照1:30的质量体积比稀释于生理盐水中,使用均浆机进行摇匀,完成后使用医疗纱布进行过滤,得到肠道菌群悬浮液;
62.(3)仿生肠道的制备:根据医学消化科精准人体肠道解剖模型,制作管状人体肠道模具,所述管状人体肠道模具由芯模和套管构成内部空腔,然后将透明硅胶注入模具内部空腔中,固化成型后取出,得到仿生肠道;
63.所述仿生肠道的厚度为1mm,长度为10m,前4m的直径为1cm,其余6m的直径为2cm,每隔3cm有弯折;
64.(4)肠道菌群的体外连续培养:
65.将步骤(1)制备的肠道菌群网状载体置于仿生肠道末端,将步骤(2)制备的肠道菌群悬浮液接种至步骤(3)制备的仿生肠道中,然后依次加入无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶后进行厌氧培养1周,每8h重复添加一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶,每24h排出一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶;
66.所述肠道菌群悬浮液和无菌水的体积比为1:0.5;所述淀粉酶的加入量为35u/l,蛋白酶的加入量6u/l,纤维素酶的加入量为7u/l,脂肪酶的加入量为18u/l;
67.(5)肠道菌群培养后的收集:
68.取出肠道菌群网状载体,在生理盐水中摇床浸泡4次,每次浸泡时间为2min,摇床转速为2rpm,浸泡后厌氧环境保存,得到用于肠道菌群移植的粪菌。
69.其中,步骤(4)中,所述营养剂由以下质量份数的原料组成:水解乳清蛋白2份,浓缩乳清蛋白2份,大豆分离蛋白2份,其他蛋白2份,氨基酸预混料1.35份,核苷酸预混料1份,麦芽糊精30份,低聚果糖1份,低聚半乳糖1份,聚葡萄糖1份,植物油粉末7份,矿物质预混料4份,维生素预混料0.23份;
70.所述的水解乳清蛋白、浓缩乳清蛋白为无乳糖型乳清蛋白;
71.所述的其他蛋白为玉米蛋白、黑豆蛋白、胶原蛋白等重量比例的混合物;
72.所述氨基酸预混料,以1g计,原料组成如下:l-谷氨酰胺54.124mg、苏氨酸
55.751mg、丝氨酸66.142mg、脯氨酸30.457mg、半胱氨酸3.412mg、牛磺酸0.002mg,余量为麦芽糊精;
73.所述核苷酸预混料,以1g计:核苷酸18.514mg,余量为麦芽糊精;所述核苷酸为5'-单磷酸腺苷(5'-amp)、5'-肌苷酸二钠、5'-鸟苷酸二钠、5'-尿苷酸二钠和5'-胞苷酸二钠等重量比的混合物;所述矿物质预混料,以1g计,原料组成如下:一水柠檬酸钠131.251mg、氯化钾90.542mg、葡萄糖酸铜0.312mg、葡萄糖酸镁153.924mg、富马酸亚铁1.689mg、葡萄糖酸锌2.983mg、葡萄糖酸锰0.921mg、磷酸氢钙115.296mg、碘化钾0.005mg、亚硒酸钠0.003mg,氯化铬55.30μg、钼酸铵75.42μg、氟化钾0.432mg,余量为麦芽糊精;所述维生素预混料,以1g计,原料组成如下:维生素a醋酸酯油0.241iu、维生素d3 0.022iu、维生素e醋酸酯0.184mg、维生素k1 0.028mg、盐酸硫胺素(b1)0.021mg、核黄素(b2)0.023mg、盐酸吡哆醇(b6)0.038mg、氰钴胺(b12)0.03mg、烟酰胺0.257mg、叶酸0.003mg、d-泛酸钙0.095mg、l-抗坏血酸1.287mg、生物素0.538mg、肌醇0.034mg、左旋肉碱酒石酸盐0.064mg,余量为麦芽糊精。
74.所述厌氧培养过程中仿生肠道ph值为6.5,仿生肠道外侧为温度为37.3℃的无菌水,仿生肠道内的气体含量为100ml,且通过压力感受器进行监测,压力范围在2~4mm hg;当压力过大时,将多余气体排出,以维持仿生肠道内的气体含量为100ml。
75.所述厌氧培养过程中仿生肠道分别以分节运动与蠕动相结合的形式进行运动,分节运动为3次/分,蠕动的推进速度为0.9cm/min。
76.实施例3
77.一种用于肠道菌群移植的粪菌的制备方法,包括步骤如下:
78.(1)肠道菌群网状载体制备:将植物纤维编织成网状结构,再将网状结构搭建成圆柱状纤维网,接着将圆柱状纤维网在浓度为5%的粘蛋白溶液中摇床浸泡15min,摇床转速为20rpm,得到肠道菌群网状载体;
79.所述网状结构的各边线长度一致,均为1cm;所述圆柱状纤维网直径为100μm,总长度为1.5m,此圆柱状纤维网形态与后续制备的仿生肠道一致;
80.(2)肠道菌群悬浮液的制备:收集正常健康人群粪便,然后将粪便按照1:3的质量体积比稀释于生理盐水中,使用均浆机进行摇匀,完成后使用医疗纱布进行过滤,得到肠道菌群悬浮液;
81.(3)仿生肠道的制备:根据医学消化科精准人体肠道解剖模型,制作管状人体肠道模具,所述管状人体肠道模具由芯模和套管构成内部空腔,然后将透明硅胶注入模具内部空腔中,固化成型后取出,得到仿生肠道;
82.所述仿生肠道的厚度为4mm,长度为9m,前6m的直径为2cm,其余3m的直径为3cm,每隔5cm有弯折;
83.(4)肠道菌群的体外连续培养:
84.将步骤(1)制备的肠道菌群网状载体置于仿生肠道末端,将步骤(2)制备的肠道菌群悬浮液接种至步骤(3)制备的仿生肠道中,然后依次加入无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶后进行厌氧培养4周,每8h重复添加一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶,每24h排出一次无菌水、营养剂、淀粉酶、蛋白酶、纤维素酶和脂肪酶;
85.所述的水解乳清蛋白、浓缩乳清蛋白为无乳糖型乳清蛋白。
86.所述的其他蛋白为豌豆蛋白、黑豆蛋白、小麦蛋白、白蛋白等重量比例的混合物;
87.所述氨基酸预混料,以1g计,原料组成如下:l-谷氨酰胺65.124mg、苏氨酸64.751mg、丝氨酸79.142mg、脯氨酸33.457mg、半胱氨酸6.412mg、牛磺酸0.005mg,余量为麦芽糊精;所述核苷酸预混料,以1g计:核苷酸34.514mg,余量为麦芽糊精;所述核苷酸为5'-单磷酸尿苷(5'-ump)、5'-单磷酸腺苷(5'-amp)、5'-肌苷酸二钠和5'-鸟苷酸二钠等重量比例的混合物;所述矿物质预混料,以1g计,原料组成如下:一水柠檬酸钠172.251mg、氯化钾118.542mg、葡萄糖酸铜0.752mg、葡萄糖酸镁165.024mg、富马酸亚铁3.389mg、葡萄糖酸锌5.583mg、葡萄糖酸锰2.521mg、磷酸氢钙125.435mg、碘化钾0.008mg、亚硒酸钠0.008mg,氯化铬78.30μg、钼酸铵96.42μg、氟化钾0.623mg,余量为麦芽糊精;所述维生素预混料,以1g计,原料组成如下:维生素a醋酸酯油1.341iu、维生素d3 0.092iu、维生素e醋酸酯0.884mg、维生素k1 0.088mg、盐酸硫胺素(b1)0.12mg、核黄素(b2)0.099mg、盐酸吡哆醇(b6)0.128mg、氰钴胺(b12)0.11mg、烟酰胺0.857mg、叶酸0.009mg、d-泛酸钙0.185mg、l-抗坏血酸2.687mg、生物素1.238mg、肌醇0.099mg、左旋肉碱酒石酸盐0.114mg,余量为麦芽糊精。
88.所述肠道菌群悬浮液和无菌水的体积比为1:1;所述淀粉酶的加入量为135u/l,蛋白酶的加入量20u/l,纤维素酶的加入量为15u/l,脂肪酶的加入量为30u/l;
89.(5)肠道菌群培养后的收集:
90.取出肠道菌群网状载体,在生理盐水中摇床浸泡6次,每次浸泡时间为6min,摇床转速为10rpm,浸泡后厌氧环境保存,得到用于肠道菌群移植的粪菌。
91.其中,步骤(4)中,所述营养剂由以下质量份数的原料组成:水解乳清蛋白9份,浓缩乳清蛋白10份,大豆分离蛋白7份,其他蛋白7份,氨基酸预混料11.5份,核苷酸预混料5份,麦芽糊精53份,低聚果糖5份,低聚半乳糖5份,聚葡萄糖4份,植物油粉末20份,矿物质预混料18份,维生素预混料6.75份;
92.所述厌氧培养过程中仿生肠道ph值为8.5,仿生肠道外侧为温度为37.3℃的无菌水,仿生肠道内的气体含量为100ml,且通过压力感受器进行监测,压力范围在2~4mm hg;当压力过大时,将多余气体排出,以维持仿生肠道内的气体含量为100ml。
93.所述厌氧培养过程中仿生肠道分别以分节运动与蠕动相结合的形式进行运动,分节运动为5次/分,蠕动的推进速度为0.7cm/min。
94.对比例
95.小鼠肠道菌群液的制备:将小鼠新鲜粪便放在氮气生物工程厨内,称重2g置于搅拌器中,加入10ml无菌0.85%nacl溶液进行第一次均质处理,将粪便浆体经5mm不锈钢滤网过滤去除其中的大颗粒物质;再加入10ml无菌0.85%nacl溶液在匀浆器中进行第二次均质处理得到粪菌浆体;然后将粪菌浆体逐级经过2.0mm、1.0mm、0.5mm和0.25mm的不锈钢滤网过滤以去除未吸收的食物残渣和小颗粒物质;以4000转/分钟的速率离心10min,加入4ml无菌0.85%nacl重悬,得到肠道菌群菌液(传统粪菌)。
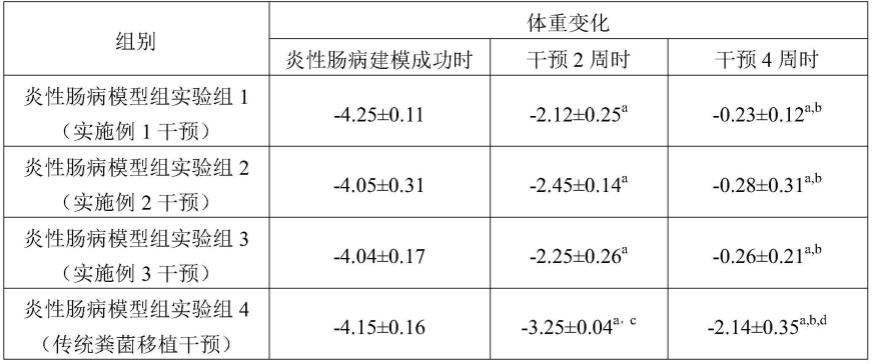
96.实验例
97.1、对小鼠体重的影响
98.分组:spf级balb/c小鼠,雌性,体重为18~22g,将小鼠随机分为4个组,分别炎性肠病模型组实验组1、实验组2、实验组3、实验组4,每组15只炎性肠病模型小鼠。实验组1、2、
3分别采用实施例1、2、3进行干预,实验组4采用传统的肠道菌群液进行干预。
99.炎性肠病模型:炎性肠病模型组给予0.1ml的三硝基苯磺酸和乙醇混合溶液灌胃,建立炎性肠病模型小鼠。混合溶液中三硝基苯磺酸的浓度为20g/l,乙醇浓度为50%。
100.肠道菌群移植前小鼠的处理准备:小鼠肠道菌群移植前,禁食4h,10%水合氯醛(0.03ml/10g~0.04ml/10g)腹腔注射麻醉,约5min后小鼠完全麻醉,仰卧位固定小鼠。
101.实验组1~3的干预方法:分别截取4cm实施例1~3制备带有肠道菌群的网状载体,然后采用小鼠肠镜将带有肠道菌群的网状载体放置在实验组1~3小鼠的远端结肠处。
102.实验组4的干预方法:采用小鼠肠镜将4ml对比例1制备的肠道菌群菌液(传统粪菌)注射在实验组4小鼠的远端结肠处。
103.饲养方式:按照0.6g(小鼠饲料干重粉剂)/10g(小鼠体重)进行灌胃,灌胃溶剂均为0.2ml生理盐水,单笼饲养,计算最终各组小鼠体重的改变,计算结果如表1所示:
104.表1肠道菌群移植对炎性肠病模型小鼠体重的影响
[0105][0106]
注:a:p<0.05vs各组炎性肠病建模后;b:p<0.05vs各组干预2周时;c,d:p<0.05vs干预的不同时期的炎性肠病模型组实验组1、2、3。
[0107]
由表1可知,与炎性肠病建模后对比,采用本发明的实施例1~3制备的用于肠道菌群移植的粪菌及对比例1制备的传统粪菌移植进行干预2、4周后,炎性肠病模型小鼠体重下降均得到了显著缓解(p<0.05),且干预4周的体重高于干预2周时(p<0.05)。但是对比例1制备的传统粪菌与本发明的实施例1~3制备的用于肠道菌群移植的粪菌相比,实验组4的体重下降缓解程度明显低于实验组1~3(p<0.05),说明本发明制备的用于肠道菌群移植的粪菌产量大,活性高,在缓解炎性肠病患者体重下降上明显优于传统粪菌。
[0108]
2、对小鼠食物利用的影响
[0109]
建模、实验分组及干预措施均与方法1中一致。
[0110]
炎性肠病模型小鼠干预期间,单笼饲养,测定其摄入食量及其体重变化,计算食物利用系数,计算结果如表2所示:
[0111]
其中:食物利用系数=体重增长(g)
÷
食物重量(g)
×
100%。
[0112]
表2肠道菌群移植对炎性肠病模型小鼠食物利用系数的影响
[0113][0114]
注:a:p<0.05vs各组炎性肠病建模后;b:p<0.05vs各组干预2周时;c,d:p<0.05vs干预的不同时期的炎性肠病模型组实验组1、2、3。
[0115]
由表2可知,与炎性肠病建模后对比,采用本发明的实施例1~3制备的用于肠道菌群移植的粪菌及对比例1制备的传统粪菌移植进行干预2、4周后,炎性肠病模型小鼠食物利用系数下降均得到了显著缓解(p<0.05),且干预4周的食物利用系数高于干预2周时(p<0.05)。但是对比例1制备的传统粪菌与本发明的实施例1~3制备的用于肠道菌群移植的粪菌相比,实验组4的食物利用系数下降程度明显高于实验组1~3(p<0.05),说明本发明制备的用于肠道菌群移植的粪菌产量大,活性高,在缓解炎性肠病患者食物利用系数下降上明显优于传统粪菌。
[0116]
3、对小鼠血细胞的影响
[0117]
建模、实验分组及干预措施均与方法1中一致。
[0118]
肠道菌群移植前,取各组炎性肠病模型小鼠的血液,检测其血细胞数量;肠道菌群移植2、4周时,取各炎性肠病模型小鼠血液,检测其血细胞数量;并计算血液中血细胞数量的变化,计算结果如表3和表4所示:
[0119]
其中,白细胞和红细胞的测定方法按《临床检验手册》方法测定。
[0120]
表3肠道菌群移植对炎性肠病模型小鼠红细胞数量的影响
[0121][0122][0123]
注:a:p<0.05vs各组炎性肠病建模后;b:p<0.05vs各组干预2周时;c,d:p<0.05vs干预的不同时期的炎性肠病模型组实验组1、2、3。
[0124]
由表3可知,与炎性肠病建模后对比,采用本发明的实施例1~3制备的用于肠道菌群移植的粪菌及对比例1制备的传统粪菌移植进行干预2、4周后,炎性肠病模型小鼠红细胞数量下降均得到了显著缓解(p<0.05),且干预4周的红细胞数量高于干预2周时(p<0.05)。但是对比例1制备的传统粪菌与本发明的实施例1~3制备的用于肠道菌群移植的粪菌相比,实验组4的红细胞数量下降程度明显高于实验组1~3(p<0.05),说明本发明制备的用于肠道菌群移植的粪菌产量大,活性高,在缓解炎性肠病患者红细胞数量下降上明显优于传统粪菌。
[0125]
表4肠道菌群移植对炎性肠病模型小鼠白细胞数量的影响
[0126][0127]
注:a:p<0.05vs各组炎性肠病建模后;b:p<0.05vs各组干预2周时;c,d:p<0.05vs干预的不同时期的炎性肠病模型组实验组1、2、3。
[0128]
由表4可知,与炎性肠病建模后对比,采用本发明的实施例1~3制备的用于肠道菌群移植的粪菌及对比例1制备的传统粪菌移植进行干预2、4周后,炎性肠病模型小鼠白细胞数量升高均得到了显著缓解(p<0.05),且干预4周的白细胞数量低于干预2周时(p<0.05)。但是对比例1制备的传统粪菌与本发明的实施例1~3制备的用于肠道菌群移植的粪菌相比,实验组4的白细胞数量升高程度明显高于实验组1~3(p<0.05),说明本发明制备的用于肠道菌群移植的粪菌产量大,活性高,在降低炎性肠病患者白细胞数量上明显优于传统粪菌。
[0129]
4、对小鼠肠道微生物的影响
[0130]
建模与方法1中一致,建模成功后。将小鼠随机分到4个组,分别为实验组1、实验组2、实验组3、实验组4,每组45只炎性肠病模型小鼠。肠道菌群移植前,每小组取15只炎性肠病模型小鼠,处死后取盲肠内容物培养计数双歧杆菌;肠道菌群移植期间,单笼饲养;肠道菌群移植后2、4周时,各阶段每小组取15只炎性肠病模型小鼠,处死后取盲肠内容物培养计数双歧杆菌;计算肠道菌群移植前、后(第2、4周时)小鼠肠道双歧杆菌的数量变化,计算结果如表5所示。
[0131]
双歧杆菌计数方法为,样品称重后10倍系列稀释,取一定稀释度的稀释液5ul涂布于事先配制好的培养基(西红柿汁400ml、多价蛋白胨15g、酵母浸膏6g、葡萄糖20g、淀粉0.5g、吐温80ml、琼脂粉20g,加热溶解后调ph为6.8~7.0,l15℃灭菌20min,冷却至55~60℃,加入硫酸新霉索使其终浓度100mg/l),每个稀释度设置3组平行,按厌氧罐法于37℃厌
氧培养72h后计数。
[0132]
表5肠道菌群移植对炎性肠病模型小鼠肠道双歧杆菌数量的影响
[0133][0134]
注:表中数据为每克粪便中菌数的常用对数;a:p<0.05vs各组炎性肠病建模后;b:p<0.05vs各组干预2周时;c,d:p<0.05vs干预的不同时期的炎性肠病模型组实验组1、2、3。
[0135]
由表5可知,与炎性肠病建模后对比,采用本发明的实施例1~3制备的用于肠道菌群移植的粪菌及对比例1制备的传统粪菌移植进行干预2、4周后,炎性肠病模型小鼠双歧杆菌数量的降低均得到了显著缓解(p<0.05),且干预4周的双歧杆菌的含量高于干预2周时(p<0.05)。但是对比例1制备的传统粪菌与本发明的实施例1~3制备的用于肠道菌群移植的粪菌相比,实验组4的双歧杆菌的含量明显低于实验组1~3(p<0.05),说明本发明制备的用于肠道菌群移植的粪菌产量大,活性高,在提高炎性肠病患者有益菌含量上明显优于传统粪菌,进而改善其免疫力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1