(2R,3S)-2-氨基-3-羟基-3-(4-(甲基磺酰基)苯基)丙酸的纯化方法与流程
(2r,3s)-2-氨基-3-羟基-3-(4-(甲基磺酰基)苯基)丙酸的纯化方法
技术领域
1.本发明属于生物技术、生物化工领域,具体涉及一种酶转化的(2r,3s)-2-氨基-3-羟基-3-(4-(甲基磺酰基)苯基)丙酸及其衍生物的纯化方法。
背景技术:
2.随着医药技术的发展,每年问世的新药数量逐步提升,其合成所需的药物中间体的相关产业也得到了广泛关注。不同于新药严苛的专利保护,药物中间体的贸易限制更少,并且合成工艺相对简单,要求相对较低,近年来得到了广大研究者和投资人的青睐。氟苯尼考是一种兽医专用氯霉素类的广谱抗菌药,具有较高经济价值,(2r ,3s)-2-氨基-3-羟基-3-(4-(甲基 磺酰基)苯基)丙酸作为其合成中间体也受到广泛关注。相较于传统有机化学合成,使用酶转化合成的方法可以有效减少污染,缓和反应条件,更符合绿色化工的要求。但是,在生物转化过程中引入大量的有机体杂质,包括生物细胞、蛋白、复杂的代谢产物等,导致产物纯化困难,影响后续应用,也对后续的分离纯化提出了新的要求,一种高效快速的分离纯化方法能有效提高产品质量,降低生产成本。
技术实现要素:
3.本发明公开了一种酶转化的(2r ,3s)-2-氨基-3-羟基-3-(4-(甲基 磺酰基)苯基)丙酸及其衍生物的适合于工业应用的纯化方法,该方法采用膜技术,可实现生物发制备该产品技术中的低能耗、低排放、低成本、高收率和较高纯度的纯化分离制备。
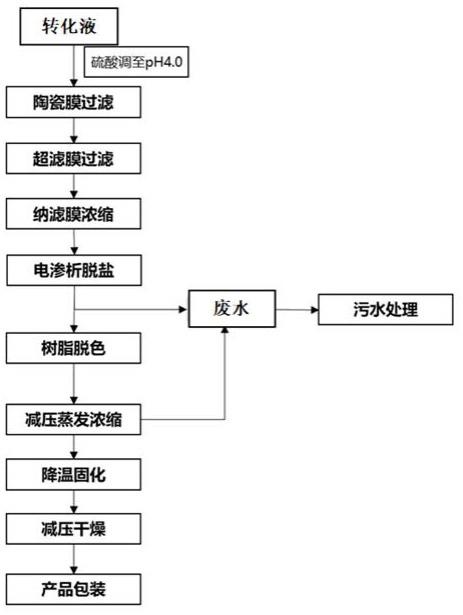
4.本发明提供一种生物转化(2r ,3s)-2-氨基-3-羟基-3-(4-(甲基磺酰基)苯基)丙酸的纯化方法,其包括如下步骤:1)转化液预处理;调节ph至3.0-4.0,50-80℃加热0.5-2小时;2)使用陶瓷膜过滤系统进行过滤,过滤过程中调节浓液回流阀控制柱前压为1.0-3.0 mpa,调节清液阀控制柱压在1.0 mpa;3)使用超滤膜过滤除杂质,采用1000-5000d滤膜对料液进行过滤,过滤过程中调节浓液回流阀控制柱压在5-8 bar;4)纳滤膜浓缩:采用200
ꢀ‑
500d孔径纳滤膜对料液进行浓缩,过滤过程中调节浓液回流阀控制柱压在15-20 bar;5)使用电渗析进行脱盐;6)脱色:使用脱色树脂对进一步浓缩料液进行吸附脱色即得。
5.任选地,还包括7)减压浓缩干燥,得到最终产品。
6.在具体实施方式中,所述生物转化的反应体系由反应液、对甲砜基苯甲醛、苏氨酸、含msps合成酶的重组大肠杆菌发酵液组成。
7.更具体地,反应液采用1 m盐酸和1 m氢氧化钠通过补料泵在线调控整个反应过程中的ph在7.5
±
0.1;对甲砜基苯甲醛在反应体系中的投料量为50 g/l;苏氨酸在反应体系
中的投料量为50 g/l;含msps合成酶的发酵液。反应条件:30℃、200 rpm,反应12小时。
8.在一个优选实施方式中,在第1)步中采用浓硫酸、浓盐酸调节ph。
9.在一个优选实施方式中,在第2)步中,开始过滤5min后再进行清液收集;过滤过程中通过调节冷凝水循环维持浓液温度在30-50 ℃;过滤后期柱前压开始波动并下降时,使用陶瓷膜系统体积的2-4倍系统体积纯水进行洗涤,得到料液。
10.在一个优选实施方式中,在第3)步中,开始过滤5min后再进行清液收集,过滤过程中保持冷凝水循环使浓液温度不超过30 ℃以保护滤膜;过滤即将结束时加入纯水进行洗脱,使用4倍系统体积纯水进行冲洗,得到料液。
11.在一个优选实施方式中,在第4)步中,开始过滤5min后再进行清液收集,过滤过程中保持冷凝水循环使浓液温度不超过50 ℃;过滤即将结束时加入2倍设备系统体积纯水进行洗脱,得到浓缩料液。
12.在一个优选实施方式中,在第5)步中,电渗析参数设置为:极水箱为3%浓度的nacl溶液,浓水箱为纯水,工作电压设置为35 v。
13.进一步优选地,整个过程通过在线ph控制装置,维持料液ph在4-5,待电导率降至0.2 s
·
m-1
,此时停止通电,使用4倍系统体积纯水进行冲洗,得到进一步浓缩料液。
14.在一个优选实施方式中,在第6)步中,脱色树脂采用lx-b14脱色树脂,料液通过树脂柱,控制透光率t430》0.95,经两倍柱体积水洗后获得脱色料液。
15.在一个优选实施方式中,在第7)步中,使用旋转蒸发仪或真空刮板将溶液浓缩,60-80℃,0.085mpa,浓缩后降温形成白色固体;更进一步优选地,进一步对白色固体打碎后进一步采用真空干燥箱干燥,60-100℃,0.085mpa,获得纯白色固体,进一步粉碎后获得白色结晶性粉末。
16.本发明的方法是针对酶转化的(2r ,3s)-2-氨基-3-羟基-3-(4-(甲基 磺酰基)苯基)丙酸及其衍生物的纯化方法进行设计优化的,包括转化结束后的ph范围,加热温度和时间,膜工序组合形式、控制参数、膜孔径选择,浓缩倍数控制等;并且整个工艺流程是从多种工艺中经过优化筛选而获得的针对该产品的工序最简单、收率最高、产物纯度最高、全水相不使用溶剂、综合成本和排废最低的工艺路线。
附图说明
17.图1分离纯化工艺流程图。
具体实施方式
18.以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
19.若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
20.实施例1 重组msps合成酶的大肠杆菌的发酵液制备方法参照中国专利zl202110889151.7中描述的方法(具体采用其说明书的实施例1和2中的方法)。本实施例的具体方法如下:1、种子制备
重组msps合成酶的大肠杆菌平板划线,37℃培养箱培养12 h,挑取平板单克隆接种至转接至600mllb培养基摇瓶,37℃摇床培养8小时,得到种子液od约1.4。
21.2、发酵罐发酵采用的发酵培养基如下:成分浓度kh2po413.4g/l(nh4)2so44g/l一水合柠檬酸1.8g/l硫酸镁0.3g/l葡萄糖10g/l消泡剂0.1ml/l发酵罐灭菌121 ℃ 30 min。
22.3、发酵补料补糖瓶:配置50%葡萄糖至补料瓶中,单独使用灭菌锅灭菌121 ℃ 15 min,灭菌完成冷却后的补糖瓶中混合均匀。
23.补氨瓶:将空补料瓶使用灭菌锅灭菌121 ℃ 15 min,待瓶冷却后加入浓氨水。
24.4、发酵流程控制1)发酵参数初始温度37℃诱导后温度30℃通气量1.8m
³
/hph7.0,使用补氨瓶控制ph转速初始300转,通过溶氧控制,范围300-1000转溶氧关联搅拌,控制在30%2)发酵流程发酵罐灭菌结束后,降温至37℃,连接补糖瓶及补氨瓶,调节ph至7.0,调节转速及通气量,稳定后加入各底料及种子液进行接种,开始发酵。
25.在菌液生长至30 od后,将温度降低至30℃,加入iptg诱导剂(终浓度0.1mm)后继续发酵。诱导后控制残糖低于1g/l,控制在30%;诱导后至少需要继续培养10小时,最终培养至od600nm达到100以上后结束发酵。
26.实施例2 生物转化的反应具体的采用实施例1制作的发酵液用于生物转化。
27.生物转化的反应体系(按100 l计)由反应液、对甲砜基苯甲醛、苏氨酸、msps合成酶溶液组成如下:反应液:采用1 m盐酸和1 m氢氧化钠通过补料泵在线调控整个反应过程中的ph在7.5
±
0.1;对甲砜基苯甲醛在反应体系中的投料量为50 g/l;苏氨酸在反应体系中的投料量为50 g/l;含msps合成酶的发酵液:20 l。
28.反应条件:30℃、200rpm,反应12小时得到转化液。
29.实施例3纯化1.酶转化液预处理使用实施例2得到的转化液体积30l,ph7.5,产物含量68g/l,含产物2040g,手性纯度》99%。采用浓硫酸、浓盐酸调节ph至4.0,60℃加热1小时,使酶失活。
30.2.使用陶瓷膜过滤系统进行过滤酶法转化的转化液中含有大量固形物细胞菌体,在后续处理前采用陶瓷膜过滤去除细胞菌体杂质。过滤过程中调节浓液回流阀控制柱前压为1.0-3.0mpa,调节清液阀控制柱压在1.0mpa。开始过滤5min后再进行清液收集以得到最佳过滤效果。过滤过程中通过调节冷凝水循环维持浓液温度在30-50℃,以加快过滤速度,增强过滤效果。过滤后期柱前压开始波动并下降,表明浓液体积过少开始进气,需要开始加入纯水进行冲洗以提高收率。使用陶瓷膜系统体积约5l,采用3倍系统体积纯水进行洗涤,最终得到料液41.2l,产物收率99%。
31.3.使用超滤膜过滤除杂质使用陶瓷膜过滤后料液中仍残留大量蛋白残留,需要使用超滤膜进行过滤去除以进行后续纯化。为达到最佳过滤效果,减少产物截留,采用3000d滤膜进行过滤。过滤过程中调节浓液回流阀控制柱压在8bar,开始过滤5min后再进行清液收集以得到最佳过滤效果。过滤过程中保持冷凝水循环使浓液温度不超过30℃以保护滤膜。过滤即将结束时加入纯水进行洗脱,需要使用4倍死体积纯水进行冲洗,共计1.6l,最终得到料液45.75l,产物收率99%。
32.4.纳滤膜浓缩经过两步过滤所得料液体积较大,为方便后续纯化,进行一次膜浓缩减少体积。采用500d孔径纳滤膜浓缩,过滤过程中调节浓液回流阀控制柱压在20bar,开始过滤5min后再进行清液收集以得到最佳过滤效果。过滤过程中保持冷凝水循环使浓液温度不超过50℃。过滤即将结束时加入2倍系统体积纯水进行洗脱,共计1.5l,最终得到浓缩料液13.75l,产物收率99%。
33.5.使用电渗析进行脱盐经过三次膜过滤纯化浓缩后,料液中仍含有大量无机盐成分和少量色素,使用电渗析装置进行脱盐以提高最终产品纯度。
34.电渗析参数设置为:极水箱为3%浓度的nacl溶液,浓水箱为纯水,工作电压设置为35v。电渗析工作过程中,检测料液的电导以确定电渗析结束时间。本次料液初始电导率为54.0s
·
m-1
,ph4-5,整个过程通过在线ph控制装置,维持料液ph在4-5,经过1.5h后降至0.2s
·
m-1
,此时停止通电,使用纯水进行冲洗以提高收率,本次使用电渗析系统死体积1l,冲洗需要使用4倍死体积纯水进行,共计4l,最终得到料液18l,产品收率98%。
35.6.脱色经过前几步处理后,已去除大部分杂质,仍含有少量色素和不溶性杂质,为进一步提高产品品质,使用脱色树脂进行吸附脱色。树脂采用lx-b14脱色树脂(西安蓝晓科技有限公司),料液通过1l树脂柱,控制透光率t430》0.95,脱色树脂单次可处理20备柱体积料液,经两倍柱体积水洗后获得20l脱色料液,产品收率98%。
36.7.减压浓缩干燥经过上述工艺后,已得到近无色的(2r ,3s)-2-氨基-3-羟基-3-(4-(甲基 磺酰基)苯基)丙酸水溶液,采用减压浓缩和真空干燥方式得到最终产品。
37.使用旋转蒸发仪将溶液浓缩,60℃,0.085mpa,浓缩至体积越4l,降温形成白色固体,打碎后进一步采用真空干燥箱干燥,80℃,0.085mpa,获得纯白色固体,粉碎后获得白色结晶性粉末1843 g,含水量0.3%,经hplc检测,纯度97%以上,手性纯度》99%,总体收率91.87%。
38.实施例4 纯化1.酶转化液预处理按上述同样的方法,使用重组大肠杆菌发酵液进行生物转化获得(2r ,3s)-2-氨基-3-羟基-3-(4-(甲基 磺酰基)苯基)丙酸酶转化液。转化液体积2000 l,ph 7.5,产物含量70 g/l,含产物140 kg,手性纯度》99%。采用浓硫酸调节ph至4.0,80℃加热1小时。
39.2.使用陶瓷膜过滤系统进行过滤采用陶瓷膜过滤去除细胞菌体杂质。过滤过程中调节浓液回流阀控制柱前压为3.0mpa,调节清液阀控制柱压在1.0 mpa。过滤过程中通过调节冷凝水循环维持浓液温度在40 ℃,以加快过滤速度,增强过滤效果。过滤后期柱前压开始波动并下降,表明浓液体积过少开始进气,需要开始加入纯水进行冲洗以提高收率。使用陶瓷膜系统死体积160 l,采用3倍设备死体积纯水进行洗涤,最终得到料液2500 l,产物收率99%。
40.3.使用超滤膜过滤除杂质采用5000 d超滤膜进行过滤。过滤过程中调节浓液回流阀控制柱压在5-8 bar。过滤过程中保持冷凝水循环使浓液温度不超过30 ℃以保护滤膜。过滤即将结束时加入纯水进行洗脱,系统死体积80 l,需要使用4倍死体积纯水进行冲洗,最终得到料液2800 l,产物收率99%。
41.4.纳滤膜浓缩采用500d孔径纳滤膜浓缩,过滤过程中调节浓液回流阀控制柱压在20 bar。过滤过程中保持冷凝水循环使浓液温度不超过50℃。过滤即将结束时加入2倍系统死体积纯水进行洗脱,最终得到浓缩料液1000 l,产物收率99%。
42.5.使用电渗析进行脱盐使用电渗析装置进行脱盐,参数设置为:极水箱为3%浓度的nacl溶液,浓水箱为纯水,工作电压设置为35 v。电渗析工作过程中,检测料液的电导以确定电渗析结束时间。本次料液初始电导率为60.0 s
·
m-1
,ph 4-5,整个过程通过在线ph控制装置,维持料液ph在4-5,经过4 h后降至0.2 s
·
m-1
,此时停止通电,使用纯水进行冲洗以提高收率,本次使用电渗析系统死体积100 l,纯水进行冲洗,最终得到料液1400 l,产品收率98%。
43.6.脱色使用脱色树脂进行吸附脱色。树脂采用lx-b14脱色树脂(西安蓝晓科技有限公司),料液通过1m
³
树脂柱,控制透光率t430》0.95,脱色树脂单次可处理20备柱体积料液,经两倍柱体积水洗后获得1500 l脱色料液,产品收率98%。
44.7.减压浓缩干燥采用真空刮板浓缩将溶液浓缩至300l,60℃,0.085mpa,降温形成白色固体,打碎
后进一步采用真空干燥箱,80℃,0.085mpa,获得纯白色固体,粉碎后获得白色结晶性粉末131 kg,含水量0.3%,经hplc检测,纯度97%以上,手性纯度》99%,总体收率93.29%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1