制备诊断和治疗蜜蜂微孢子虫病产品的分子靶标及其应用
1.本发明涉及生物技术领域,具体涉及制备诊断和治疗蜜蜂微孢子虫病产品的分子靶标及其应用。
背景技术:
2.作为蜜蜂最主要的病害之一,蜜蜂微孢子虫病每年对我国养蜂业造成的蜂群损失可占到全部病害损失的30%以上,直接经济损失可达上亿元。蜜蜂微孢子虫病又称为东方蜜蜂微孢子虫病,病原体为蜜蜂微孢子虫,主要借助蜜蜂摄入食物时通过消化系统到达中肠并在中肠上皮细胞大量增殖。感染后蜜蜂因为中肠组织细胞被大量破坏引起消化不良和排泄不畅造成个体死亡,而患病蜜蜂的排泄物会含有大量病原微孢子虫,蜂群中其它健康蜜蜂接触会造成传染。
3.由于蜜蜂微孢子虫病是传染性疾病,对该病的早防早治能最大程度地减少养蜂户损失。目前,国内外对蜜蜂微孢子虫病的诊断技术已经比较成熟,且目前的治疗手段也以杀真菌剂等化学药剂或中药或者植物提取物为主,如中国发明专利201510302650.6《一种防治蜜蜂微孢子虫病的中药组合物及用途》、中国发明专利201410672287.2《天然植物提取物及防治蜜蜂微孢子虫病的用途》,尚无从分子靶标角度对蜜蜂微孢子虫病进行诊断和治疗研发的成功报道。
技术实现要素:
4.为了解决以上问题,本发明提出制备诊断和治疗蜜蜂微孢子虫病产品的分子靶标及其应用,所述分子靶标为β-catenin蛋白基因,所述β-catenin蛋白基因在ncbi数据库中的基因编号为gb52616,当待测蜜蜂中肠组织样本中β-catenin蛋白基因表达水平显著升高,则表示该待测蜜蜂感染了微孢子虫病。
5.进一步,当蜜蜂感染蜜蜂微孢子虫病的时间在72小时以上时,所述β-catenin蛋白基因在感染蜜蜂中肠组织中的表达水平是健康蜜蜂的10倍以上。
6.进一步,所述产品中含有检测β-catenin蛋白基因表达水平的试剂,所述试剂包括针对β-catenin蛋白基因的探针、引物。
7.进一步,所述引物为:f:5’ttactgcggaagaacacgaa3’;r:5’ccagcatcgccaagatttcc3’。
8.进一步,所述产品包括芯片、试剂盒或核酸膜条。
9.进一步,所述芯片为基因芯片,所述基因芯片包括用于检测β-catenin蛋白基因表达水平核苷酸探针;所述试剂盒为基因检测试剂盒,所述基因检测试剂盒包括用于检测β-catenin蛋白基因表达水平的试剂或芯片。
10.本发明同时提供了β-catenin蛋白基因表达抑制剂在制备治疗蜜蜂微孢子虫病药物中的应用。
11.进一步,所述β-catenin蛋白基因表达抑制剂包括icrt-5 β-catenin蛋白表达抑制剂。
12.进一步,所述icrt-5 β-catenin蛋白表达抑制剂在药物中的使用浓度为0.5-1 mg/l。
13.本发明的有益效果如下:1、本发明首次公开了β-catenin蛋白基因与蜜蜂微孢子虫相关,并进一步证实了该基因在感染蜜蜂微孢子虫病的蜜蜂中肠组织中表达显著上升,可作为蜜蜂微孢子虫病的分子靶标,对蜜蜂微孢子虫病进行基因检测。
14.、本发明提供的β-catenin蛋白基因分子靶标,可以做到蜜蜂感染微孢子虫病后72小时就能确诊,不仅能够快速有效的做到早期检测,还为基因治疗、药物治疗等临床应用提供了治疗靶点和重要依据。
15.、蜜蜂中肠上皮组织是蜜蜂消化道内外的重要屏障,在吸收营养的同时也负责阻挡外界微生物的侵染,是蜜蜂免疫系统的重要组成部分。蜜蜂感染微孢子虫会影响中肠上皮细胞间的粘附连接,影响中肠上皮细胞的正常增殖,破坏中肠组织的完整性,造成患病蜜蜂对其它病原及农药等敏感性增加。本发明认为,粘附连接是上皮极性和屏障功能的关键调节因子,而β-catenin蛋白与cadherin的结合则被认为是粘附连接的先决条件。β-catenin蛋白通过介导胞膜上的cadherin与胞浆中的α-catenin结合,通过β-catenin的c端链接在细胞骨架上,形成cadherin/catenin adhesive复合体,粘附连接在细胞膜上,在细胞黏附、迁移过程中发挥作用。当β-catenin蛋白在细胞中的量异常增高时会导致细胞凋亡等发生,而蜜蜂微孢子虫侵染可显著上调β-catenin蛋白的表达,造成细胞内β-catenin蛋白的大量积累,从而直接影响中肠上皮细胞间的粘附连接和细胞的正常增殖。因此,抑制β-catenin蛋白基因在感染蜜蜂中的表达水平,能有效降低蜂群对蜜蜂微孢子虫病的患病率。
附图说明
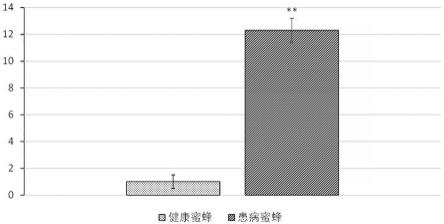
16.图1为本发明的β-catenin蛋白基因特征引物序列与意大利蜜蜂β-catenin蛋白基因序列同源性分析结果示意图;图2为实施例2的β-catenin蛋白基因在自然感染的患病蜜蜂和健康蜜蜂样本中的表达水平对比图;图3为实施例3的不同时间点人工感染的患病蜜蜂和健康蜜蜂样本中β-catenin蛋白基因表达水平对比图;图4为实施例5的使用icrt-5 β-catenin表达抑制剂后不同时间点患病蜜蜂和健康蜜蜂样本中β-catenin蛋白基因表达水平对比图。
具体实施方式
17.以下结合实施例对本发明作进一步说明。
18.实施例1:蜜蜂中肠组织β-catenin蛋白基因特征引物设计本发明的β-catenin蛋白基因是在本发明之前的已知基因,来源于已公开的意大利蜜蜂(apis mellifera)基因组序列,位于蜜蜂10号染色体上,所述β-catenin蛋白基因在
ncbi数据库中的基因编号为gb52616。
19.在ncbi上通过引物设计,获得5对可能的引物,分别将这5对引物进行pcr扩增,将扩增后的产物回收后,在abi 3730 全自动测序仪上测序,核苷酸序列在ncbi上完成同源性分析,其中第二对引物的扩增产物与ncbi公布的意大利蜜蜂β-catenin蛋白基因序列同源性达到100%,见图1,从而确定本发明的β-catenin蛋白基因特征引物序列为:f:5’ttactgcggaagaacacgaa3’r:5’ccagcatcgccaagatttcc3’。
[0020] 实施例2:qpcr验证自然感染蜜蜂微孢子虫病原的蜜蜂中肠组织β-catenin蛋白基因表达情况一、材料:采集自然感染蜜蜂微孢子虫病原的蜜蜂中肠样本2021年取自北京市密云区一户养蜂场,意大利蜜蜂蜂群出现典型东方蜜蜂微孢子虫病症状,包括成年蜜蜂排泄不畅、腹部膨大、无法飞行等。将具有典型症状的蜜蜂样本取回实验室,提取5只蜜蜂中肠,组织匀浆,取小部分匀浆液置于实验室光学显微镜下600倍下观察,可见视野中有大量东方蜜蜂微孢子虫病原。
[0021]
二、方法:(一)患病蜜蜂样本病原种质鉴定1、dna提取从每份样品中取经镜检感染有孢子虫的蜜蜂,将蜜蜂腹部分别液氮冻磨并匀浆,加入300 μl的提取液及4 μl蛋白酶k溶液(20 mg/ml),60℃水浴3 h,水浴后加入等体积(300 μl)的苯酚:氯仿(1:1)混合液,并轻轻混匀;13 000 rpm条件下离心15 min,将上清液移至另一个新管中,再次加入等体积(300 μl)的苯酚:氯仿(1:1)混合液,并轻轻混匀,同样条件下离心,取上清,向上清液中加入等体积(300 μl)的氯仿并轻轻混匀,13 000 rpm条件下离心5 min,将上清液(300 μl)移至新管中,加入预冷的两倍体积(600 μl)的95%的乙醇和1/10体积(30 μl)的3 m的naoac,轻轻混匀,-20℃过夜沉淀,10 000 rpm离心15 min,移去上清,沉淀用1 ml的70%的乙醇洗涤两次,烘干后加入20 μl的ddh2o,置于65℃的条件下水浴10 min,轻轻溶解,混匀每个管中的沉淀物,10 000 rpm条件下离心10 s,-20 ℃保存备用。
[0022]
2、pcr扩增引物、扩增反应体系及反应步骤均参照hamiduzzaman等(hamiduzzaman et al.,2010)所设计并经验证的东方蜜蜂微孢子虫鉴定方法。用所提取的dna样品在同一个pcr反应体系中进行东方蜜蜂微孢子虫的16s rrna以及蜜蜂的actin基因的共扩增反应(见表1)。
[0023]
反应的循环参数为:94℃条件下2.5 min
→
94℃条件下15 s
→
61.8 ℃条件下30 s
→
72℃条件下45 s
→
后三步进行16个循环
→
94℃条件下15 s
→
61.8℃条件下30 s
→
72℃条件下50 s
→
20个循环
→
72℃条件下延伸7 min。
[0024]
引物序列:东方蜜蜂微孢子虫(nosema ceranae):mitoc-f:5’cggcgacgatgtgatatgaaaatattaamitoc-r:5’cccggtcattctcaaacaaaaaaccg产物大小:218bp蜜蜂基因β-actin作为内参:β-actin-f:5
’ꢀ
gcaaaaagaaatcactgccctaβ-actin-r:5
’ꢀ
ggatggtccagactcgtcgtat产物大小:166bp3、扩增产物的分离与鉴定扩增产物用50 bp和100 bp的ladder以及2.5%的琼脂糖凝胶电泳进行分离,120 v电压下进行32 min。用凝胶成像系统对产物进行成像及分析。
[0025]
4、鉴定结果在218 bp和166 bp同时出现条带,可确定样本已经感染蜜蜂微孢子虫病。
[0026]
(二)β-catenin蛋白基因表达1、总rna提取取健康蜜蜂和经前述步骤鉴定患有东方蜜蜂微孢子虫病的蜜蜂中肠组织样本各1组,5只/组,分别置于离心管中,并分别完成如下步骤:(1)样品中加入trizol试剂1 ml,手摇充分混合样品与试剂后,4
ꢀ°
c静置5min,离心机4
ꢀ°
c 、12000转/分离心10 min;(2)在新离心管中加入氯仿750 μl,从离心后的离心管中吸取等体积液体加入新离心管,混匀后静置5 min,使用离心机4
ꢀ°
c、 12000转/分离心15 min;(3)在新离心管中加入异丙醇500 μl,吸取离心后上清液500 μl,震荡混匀后静置10min,使用离心机离心10min,离心后,离心管底部沉淀为rna;
(4)弃上清液,加入75%酒精1ml,震荡后使用离心机4
°
c、7500转/分离心5min;(5)弃上清,4
°
c、7500转/分离心5min;(6)吸出底部残余酒精,干燥5分钟,加入超纯水50μl,4度冷藏保存。
[0027]
2、反转录使用takaraprimescript
™
rtreagentkit(perfectrealtime)试剂盒;反应体系:5
×
primescriptbuffer(forrealtime):2μlprimescriptrtenzymemixⅰ:0.5μloligodtprimer(50μm)*1:0.5μlrandom6mers(100μm)*1:0.5μltotalrna:500ngrnasefreedh2o:upto10μl反应条件:37℃15min;85℃5sec;4℃3、qpcr反应体系:sybrgreeni:5μlprimer:0.25μlcdna:0.5μldepctreatedwater:4μl反应条件:95
˚
c3min;95
˚
c10s,60
˚
c45s40个循环95
˚
c15s60
˚
c1min上、下引物:(实施例1确定的引物)f:5’ttactgcggaagaacacgaa3’r:5’ccagcatcgccaagatttcc3’4、结果与分析qpcr扩增曲线拐点清楚,扩增曲线整体平行性好,表明各反应管的扩增效率相近,基线平而无上扬现象,曲线指数期斜率较大,说明扩增效率较高;样本扩增产物溶解曲线都是单峰,说明扩增产物只有一条,为特异性扩增。
[0028]
根据qpcr的相对定量公式计算β-catenin蛋白基因分别在健康蜜蜂及自然感染东方蜜蜂微孢子虫的蜜蜂样本的中肠组织中的表达水平。
[0029]
结果显示:qpcr扩增结果稳定,β-catenin蛋白基因在患病蜜蜂样本中的表达水平约为健康蜜蜂的13倍,经单因素方差分析结果差异极显著,具体见图2。
[0030]
实施例3:qpcr验证人工感染蜜蜂微孢子虫的蜜蜂中肠组织β-catenin蛋白基因表达情况。
[0031]
一、材料1、感染蜜蜂的蜜蜂微孢子虫病原提纯:取经镜检感染微孢子虫致死的意大利蜜蜂10只,取其腹部,置于放入蒸馏水的研钵中进行研磨,研磨均匀后转入10 ml离心管中,500 rpm地速离心3 min,将上清转入新的10 ml离心管中,弃沉淀,2000 rpm高速离心10 min,弃上清,用清水重新悬浮沉淀,4000 rpm离心10 min,取沉淀,多次重复后,取沉淀,用1 ml生理盐水溶解沉淀,置于4 ℃,储存备用。
[0032]
2、蜜蜂微孢子虫病原鉴定:方法同实施例2。
[0033]
3、蜜蜂微孢子虫对意大利蜜蜂的人工侵染:取新出房的健康工蜂并随机分为处理组和对照组,每组6笼,每笼30只工蜂。
[0034]
处理组:每只工蜂通过微量注射器分别经口饲喂5 μl含有微孢子虫的1:1的糖水,每只蜂的微孢子虫饲喂量为5
×
104个;对照组:每只工蜂同样通过微量注射器分别进行经口饲喂5 μl不含微孢子虫的1:1的糖水;两组工蜂均置于30
ꢀ±ꢀ
0.5 ℃,rh为65%~80%的培养箱中培养,每天提供等量的1:1的糖水作为饲料;分别于感染后0小时、24小时、72小时、120小时各取处理组和对照组蜜蜂30只,提取中肠组织用于β-catenin蛋白基因表达测定。
[0035]
4、蜜蜂中肠组织β-catenin蛋白基因表达测定:方法同实施例2。
[0036]
5、结果与分析qpcr扩增曲线拐点清楚,扩增曲线整体平行性好,表明各反应管的扩增效率相近,基线平而无上扬现象,曲线指数期斜率较大,说明扩增效率较高;样本扩增产物溶解曲线都是单峰,说明扩增产物只有一条,为特异性扩增。
[0037]
根据qpcr的相对定量公式计算β-catenin蛋白基因分别在各处理组和对照组蜜蜂样本的中肠组织中的表达水平,结果显示:qpcr扩增结果稳定,当人工感染72小时开始β-catenin蛋白基因在患病蜜蜂样本中的表达水平与正常蜜蜂的出现显著差异,其中感染72小时后的表达水平约为正常蜜蜂的12倍,感染120小时后的表达水平约为正常蜜蜂的13倍,经单因素方差分析结果差异极显著,具体见图3。说明采用以β-catenin蛋白基因为靶标的分子检测手段,蜜蜂感染后最多72小时就能确诊,因此可以实现蜜蜂微孢子虫病的早期诊断。
[0038]
实施例4:组装蜜蜂微孢子虫感染诊断试剂盒及效果验证基于实施例1得到的引物组,组装本发明所述的用于蜜蜂微孢子虫感染的诊断试剂盒,所述试剂盒包括特异扩增β-catenin蛋白基因的引物、特异扩增内参基因(β-actin) 的引物、还包括sybr green聚合酶链式反应体系,如pcr缓冲液、sybr green荧光染料、dntps等。还包括蜜蜂正常中肠组织cdna:作为阴性对照与检测样本cdna共同定量pcr检测,每个反应体系使用与检测样本cdna相同量。
[0039]
通过对引物浓度和退火温度的优化,确定最佳反应体系如表2所示:
最佳反应条件如下:95
˚
c3min;95
˚
c10s,60
˚
c45s共40个循环95
˚
c15s60
˚
c1min诊断试剂盒效果检验:分别取56例待检蜜蜂微孢子虫蜜蜂中肠组织,使用常规方法从中肠组织中提取总rna,使用试剂盒中试剂,按照最佳反应体系与条件进行pcr反应,使用试剂盒中正常蜜蜂中肠组织cdna作为real-timepcr定量检测中的对照cdna,检测组织样本的β-catenin蛋白基因表达水平。相对正常蜜蜂的中肠组织表达量变化,分析检测结果,样本和对照间比较采用t检验,p《0.05为差异显著,判为检测样本阳性。
[0040]
检测结果显示,56例待检样品中有47例样本的β-catenin蛋白基因表达水平为正常蜜蜂组织表达水平的8-20倍,另外9例样本的表达水平与正常组织没有显著差异。经进一步通过实验室显微镜镜检结果及分子生物学鉴定,结果与本发明制备的试剂盒检测结果基本一致。据此推断,本诊断试剂盒可以明确区分出患有蜜蜂微孢子虫的蜂群,并以此为临床提供诊断线索。
[0041] 实施例5:icrt-5β-catenin表达抑制剂对蜜蜂个体微孢子虫病防治效果实验一、材料1、感染蜜蜂的蜜蜂微孢子虫病原提纯:方法同实施例3。
[0042]
2、蜜蜂微孢子虫病原鉴定:方法同实施例2。
[0043]
3、蜜蜂微孢子虫对意大利蜜蜂的人工侵染:取新出房的健康工蜂并随机分为处理组、对照组和空白组,每组6笼,每笼30只工蜂;处理组:每只工蜂通过微量注射器分别经口饲喂5μl含有微孢子虫的1:1的糖水,每只蜂的微孢子虫饲喂量为5
×
104个,每天将浓度为1.0mg/l的icrt-5dmso溶液与等体积1:1的糖水配制成终浓度为0.5mg/l的icrt-5溶液用于饲料;对照组:每只工蜂同样通过微量注射器分别进行经口饲喂5μl含微孢子虫的1:1的糖水,每只蜂的微孢子虫饲喂量为5
×
104个,每天提供等量的1:1的糖水作为饲料;空白组:每只工蜂同样通过微量注射器分别进行经口饲喂5μl的1:1的糖水,每天
提供等量的1:1的糖水作为饲料;3组工蜂均置于30
ꢀ±ꢀ
0.5 ℃,rh为65%~80%的培养箱中培养;分别于感染后0小时、24小时、72小时、120小时各取处理组、对照组和空白组蜜蜂30只,提取中肠组织用于β-catenin蛋白基因表达测定。
[0044]
4、蜜蜂中肠组织β-catenin蛋白基因表达测定:方法同实施例2。
[0045]
5、结果与分析:qpcr扩增曲线拐点清楚,扩增曲线整体平行性好,表明各反应管的扩增效率相近,基线平而无上扬现象,曲线指数期斜率较大,说明扩增效率较高;样本扩增产物溶解曲线都是单峰,说明扩增产物只有一条,为特异性扩增;根据qpcr的相对定量公式计算β-catenin蛋白基因分别在各处理组和对照组蜜蜂样本的中肠组织中的表达水平。
[0046]
结果显示:qpcr扩增结果稳定,当人工感染72小时开始对照组β-catenin蛋白基因在患病蜜蜂样本中的表达水平与空白组蜜蜂出现显著差异,其中感染72小时后的表达水平约为空白组蜜蜂的11.7倍,感染120小时后的表达水平约为空白组蜜蜂的11.9倍,经单因素方差分析结果差异极显著,而处理组与空白组的表达水平无显著差异。具体见图4。说明icrt-5 β-catenin表达抑制剂可以有效降低感染微孢子虫的蜜蜂的β-catenin蛋白基因的表达,icrt-5 β-catenin表达抑制剂可用作防治蜜蜂微孢子虫的药物。
[0047] 实施例6:icrt-5 β-catenin表达抑制剂对蜂群的蜜蜂微孢子虫病防治效果实验试剂:icrt-5 β-catenin蛋白表达抑制剂试剂基本信息:化学式c
16h17
no5s2;cas号: 18623-44-4 ;分子量: 367.44公司:mce (medchemexpress)实验方法:一、蛋白表达抑制剂对感染蜜蜂微孢子虫病的意大利蜜蜂防治效果评价1、实验蜂群:取意大利蜜蜂(apis mellifera l.), 全部试验用蜂群取自同一个蜂场,并保证所有实验蜂群的群势基本保证一致,实验前对所有蜂群均完成蜜蜂主要病害检查,确保蜂群健康。
[0048]
2、感染蜜蜂的微孢子虫病原提纯:方法同实施例3。
[0049]
3、东方蜜蜂微孢子虫病原鉴定:方法同实施例2。
[0050]
4、防治效果评价:(1)将实验蜂群设为5个组,每组10群蜜蜂,分别做如下设置:空白对照组(不感染不给药)、阴性对照组(感染不给药)、受试药物推荐剂量组、受试药物推荐剂量加倍组、受试药物推荐剂量减半组;(2)将提纯的蜜蜂微孢子虫病原配制成浓度为含有1x107个孢子/ml的悬浮液,除空白对照组外全部直接喷洒至巢脾上,每群蜂50ml;(3)分别配制浓度为0.5 mg/l、1mg/l、2 mg/l共3个浓度的icrt-5 dmso溶液。将该溶液分别与等体积50%的糖水混合,最终制成抑制剂终浓度为0.25 mg/l、0.5 mg/l、1 mg/l的供试药液分别用于药物推荐剂量减半组、药物推荐剂量组及药物推荐剂量加倍组,接种
病原后当天即喷洒药液于巢脾上,每群蜂100 ml,隔天一次,共喷3次;(4)于接种后第10天和第20天观察所有蜂群的症状及患病蜜蜂镜检结果,判断蜂群是否被微孢子感染患病。当蜂群表现出典型蜜蜂微孢子虫症状,显微镜镜检观察有微孢子虫病原时即判定为蜂群被感染患病。
[0051]
患病率%=(患病蜂群数/实验组总蜂群数)x100%5、实验结果:结论:该药剂在推荐剂量下可通过下调β-catenin蛋白表达,保护蜜蜂中肠组织从而起到有效防控蜜蜂微孢子虫对蜜蜂的影响。
[0052]
二、表达抑制剂对蜜蜂急性毒性安全性评估1、实验蜂群取意大利蜜蜂(apis mellifera l.)成年工蜂供试。 全部试验用蜂取自同一个健康蜂群。
[0053]
2、实验步骤(1)取新出房的健康工蜂并随机放入12cmx12cmx12cm的木笼中,每笼30只工蜂。分为别设定为处理组(15笼)、对照组(3笼)和空白组(3笼),共计21笼;(2)试验时将不同浓度的供试溶液浸渍约0. 4 g 脱脂棉,置于小塑料盒中倒置于试验蜂笼的纱网上饲喂蜜蜂;(3)分别配制浓度为1 mg/l;5 mg/l;25 mg/l;125 mg/l及625 mg/l 共5个浓度的icrt-5 dmso溶液。将该溶液分别与等体积50%的糖水混合,最终制成抑制剂终浓度为0.5 mg/l;2.5 mg/l;12.5 mg/l;62.5 mg/l及312.5 mg/l的供试溶液用于实验组,每个浓度饲喂3笼蜜蜂;(4)将dmso与等体积50%的糖水混合,用于饲喂空白组,饲喂3笼蜜蜂;(5)将50%的糖水用于饲喂对照组,饲喂3笼蜜蜂;(6)将供试蜂笼置于温度为30
±ꢀ
2 ℃,相对湿度为50%-80%的微光条件下,观察记录农药处理后蜜蜂中毒症状及48 h死亡数。对照组死亡率小于10%的试验为有效试验。所有实验组及对照组死亡率用空白组做矫正后计算icrt-5对蜜蜂急性致死中浓度lc
50
值及其
95%置信区间。
[0054]
3、实验结果毒力回归方程:y =-2. 008 + 2.105x;lc
50 = 213 mg/l;95%置信区间:160.7 mg/l
ꢀ–ꢀ
274.4 mg/l。
[0055]
结论:借鉴usepa 的生态风险评价准则,当供试农药对蜜蜂的急性毒性lc
50
值大于2000 mg/l时则认为该药剂对蜜蜂毒性极低,说明本供试的icrt-5 β-catenin表达抑制剂在0.5-1 mg/l的有效应用浓度内对蜜蜂安全,为低风险药剂。
[0056]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
[0057]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1