一种催化剂配体材料的合成方法与流程
1.本发明涉及一种催化剂配体材料的合成方法,属于有机化合物制备领域。
背景技术:
2.2-苄氧基-3-溴-5,3,5-三叔丁基联苯作为新型催化剂配体材料,与过渡金属配合形成新型双(酚)醚金属配合物具有八面体含双(酚)醚结构的催化剂,具有高活性和高立体选择性,在a-烯烃聚合领域中有显著催化效果。因此寻找高效合成2-苄氧基-3-溴-5,3,5-三叔丁基联苯的方法具有重要意义。
3.文献journal of the american chemical society(2010).132(16),5566-5567中报道,以2-溴-4-叔丁基苯酚及苄基溴为初始原料,经醚化反应、丁基锂反应、偶联反应、溴代反应、醚化五步反应合成2-苄氧基-3-溴-5,3,5-三叔丁基联苯,总收率为49%。该反应需要-70℃低温,反应条件高,而且反应过程中使用的丁基锂不安全,不环保。反应过程中苄基会脱落,需要再次加苄基溴进行醚化反应,反应步骤长,收率低,不适合批量生产。
技术实现要素:
4.本发明针对现有技术的不足,提供一种催化剂配体材料的合成方法,所述的合成方法中无苄基脱落,反应步骤短,安全环保,收率高,适合批量生产。
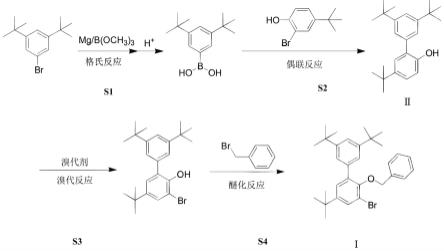
5.本发明解决上述技术问题的技术方案如下:一种催化剂配体材料的合成方法,所述合成方法为:s1、格氏反应:在惰性气体保护下,反应器中加入mg粉,在加热条件下,先滴加3,5-二叔丁基溴苯的有机溶剂溶液,再滴加硼酸三甲酯,反应结束,降温,酸化,经后处理得到格氏产物的有机溶剂溶液,所述格氏产物的结构式为:s2、偶联反应:在惰性气体保护下,向s1步骤得到的格氏产物的有机溶剂溶液中加2-溴-4-叔丁基苯酚,k2co3、水和催化剂,并加热,保温反应,反应结束,经后处理得到中间体ii,中间体ii的结构式为:
s3、溴代反应:在惰性气体保护下,反应器中加入中间体ii、溴代剂及有机溶剂,保温反应,反应结束,得到溴代产物的有机溶剂溶液,所述溴代产物的结构式为s4、醚化反应:在惰性气体保护下,反应器中加入溴代产物的有机溶剂溶液、苄基溴及na2co3,加热并保温反应,得到催化剂配体材料,催化剂配体材料的结构式如下:。
6.进一步的,步骤s1中的反应温度为50~70℃;步骤s2中的反应温度为40~60℃;步骤s3中的反应温度为0~30℃;步骤s4中的反应温度为40~60℃。
7.在上述技术方案的基础上,本发明还可以做如下改进:进一步的,步骤s2中,所述的催化剂为四三苯基膦钯、双(三环己基膦)二氯化钯、双(二叔丁基苯基膦)二氯化钯和双(三苯基膦)二氯化钯中的任意一种或几种组合。
8.优选的,步骤s2中,所述的催化剂为双(三环己基膦)二氯化钯。
9.进一步的,步骤s3中,所述的溴代剂为溴素和n-溴代琥珀酰亚胺(nbs)中的任意一种。
10.优选的,步骤s3中,所述的溴代剂为n-溴代琥珀酰亚胺。
11.进一步的,步骤s1中,所述的3,5-二叔丁基溴苯与mg摩尔比为1:1~1.5;3,5-二叔
丁基溴苯与硼酸三甲酯摩尔比为1:1~1.5;3,5-二叔丁基溴苯与有机溶剂质量比为1:2~10,所述的有机溶剂为thf。
12.优选的,步骤s1中,所述的3,5-二叔丁基溴苯与mg摩尔比为1:1~1.3,3,5-二叔丁基溴苯与硼酸三甲酯摩尔比为1:1~1.3;3,5-二叔丁基溴苯与thf质量比为1:3~6。
13.进一步的,步骤s2中,2-溴-4-叔丁基苯酚与催化剂的质量比为1:0.01~0.05;3,5-二叔丁基溴苯与2-溴-4-叔丁基苯酚的摩尔比为1:1~1.5;3,5-二叔丁基溴苯与k2co3的摩尔比为1:2~5。
14.优选的,步骤s2中,2-溴-4-叔丁基苯酚与催化剂的质量比为1:0.01~0.03;3,5-二叔丁基溴苯与2-溴-4-叔丁基苯酚的摩尔比为1:1~1.3;3,5-二叔丁基溴苯与k2co3的摩尔比为1:2~4。
15.进一步的,步骤s3中,所述的中间体ii与溴代剂的摩尔比为1:1~1.3;中间体ii与有机溶剂的质量比为1:2~10,所述的有机溶剂为二氯乙烷。
16.优选的,步骤s3中,所述的中间体ii与nbs的摩尔比为1:1~1.3;中间体ii与二氯乙烷质量比为1:4~6。
17.进一步的,中间体ⅱ与步骤s4中苄溴的摩尔比为1:1~1.6;中间体ⅱ与步骤s4中na2co3的摩尔比为1:1~3。
18.优选的,中间体ⅱ与步骤s4中苄溴的摩尔比为1:1~1.3;中间体ⅱ与步骤s4中na2co3的摩尔比为1:1~2,保温时间为:2~5h。
19.进一步的,s1-s4步骤中的惰性气体为氮气、氩气、氦气中的一种或多种。
20.优选的,s1-s4步骤中的惰性气体为氮气。
21.本发明的有益效果是:(1)本发明所述合成方法中通过四步反应就能够制备出2-苄氧基-3-溴-5,3,5-三叔丁基联苯,制备方法简单,制备过程中没有苛刻的高温、低温或高压条件,而且无需使用毒性高的危险性原料,此合成工艺绿色环保,条件简单,易操作,安全,产品质量及收率高,能耗小,成本低,克服了现有技术中操作复杂、不环保、安全系数低、收率低、难以工业化生产的缺陷。
22.(2)本发明所述合成方法中,不会有苄基脱落的问题,无需再次补加苄基溴,反应步骤缩短,而且合成的2-苄氧基-3-溴-5,3,5-三叔丁基联苯产品纯度高,收率高,更适合在工业化生产中应用,有效缩短生产周期,降低生产成本。
附图说明
23.图1为本发明所述2-苄氧基-3-溴-5,3,5-三叔丁基联苯的合成路线;图2为实施例1中所述的中间体ii的核磁氢谱图;图3为图2中化学位移6.8-7.7的局部放大图;图4为实施例1中所述的中间体ii的核磁碳谱图;图5为实施例1中所述的目标产物i的核磁氢谱图;图6为图5中化学位移7.0-7.6的局部放大图;图7为实施例1中所述的目标产物i的核磁碳谱图;图8为图7中化学位移30.0-75.0的局部放大图;
图9为图7中化学位移115.0-153.0的局部放大图。
具体实施方式
24.下面对本发明的具体实施方式做详细说明。本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受公开的具体实施例的限制。
25.除非另有定义,本文所使用的所有技术和科学术语与本发明所属技术领域的技术人员通常理解的含义相同。所使用的术语只为描述具体实施方式,不为限制本发明。
26.如图1所示,一种催化剂配体材料2-苄氧基-3-溴-5,3,5-三叔丁基联苯的合成方法,所述的合成方法为:s1、格氏反应:在惰性气体保护下,反应器中加入mg粉,50~70℃下,先滴加3,5-二叔丁基溴苯的thf溶液,再滴加硼酸三甲酯,反应结束,降温,酸化,经后处理得到格氏产物的thf溶液;s2、偶联反应:在惰性气体保护下,向s1步骤得到的格氏产物的thf溶液中加2-溴-4-叔丁基苯酚,k2co3、水和催化剂,40~60℃保温反应,反应结束,经后处理得到中间体ii;s3、溴代反应:在惰性气体保护下,反应器中加入中间体ii、溴代剂及二氯乙烷溶剂,0~30℃下保温反应,反应结束,得到溴代产物的二氯乙烷溶液;s4、醚化反应:在惰性气体保护下,反应器中加入溴代产物的二氯乙烷溶液、苄基溴及na2co3,40~60℃保温反应,得到催化剂配体材料:2-苄氧基-3-溴-5,3,5-三叔丁基联苯。
27.步骤s1中,所述的3,5-二叔丁基溴苯与mg摩尔比为1:1~1.5;3,5-二叔丁基溴苯与硼酸三甲酯摩尔比为1:1~1.5;3,5-二叔丁基溴苯与有机溶剂质量比为1:2~10。
28.步骤s2中,2-溴-4-叔丁基苯酚与催化剂的质量比为1:0.01~0.05;3,5-二叔丁基溴苯与2-溴-4-叔丁基苯酚的摩尔比为1:1~1.5;3,5-二叔丁基溴苯与k2co3的摩尔比为1:2~5。
29.步骤s2中,所述的催化剂为四三苯基膦钯、双(三环己基膦)二氯化钯、双(二叔丁基苯基膦)二氯化钯和双(三苯基膦)二氯化钯中的任意一种或几种组合。
30.步骤s3中,所述的中间体ii与溴代剂的摩尔比为1:1~1.3;中间体ii与有机溶剂的质量比为1:4~10,所述的有机溶剂为二氯乙烷。
31.步骤s3中,所述的溴代剂为溴素和n-溴代琥珀酰亚胺(nbs)中的任意一种。
32.步骤s4中,中间体ⅱ与步骤s4中苄溴的摩尔比为1:1~1.6;中间体ⅱ与步骤s4中na2co3的摩尔比为1:1~3。
33.实施例1通氮气保护体系,向1l三口瓶中依次投入8.3g(0.345mol)mg粉,升温到65℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/400g thf,滴加毕,滴加37.4g(0.36mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
34.以上一步格氏产物的thf溶液为原料,氮气保护,投入82.5g(0.36mol) 2-溴-4-叔丁基苯酚、124.4g(0.9mol) k2co3、500g水、1.4g双(三环己基膦)二氯化钯,升温到50℃,保温反应3.5h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:91.4g,收率:90%,纯度:99.5%(gc),核磁检测图谱如图2-图4所示。
35.以上一步中间体ⅱ为原料,氮气保护,加入57.7g(0.324mol) nbs,450g二氯乙烷,温度为25℃,保温反应2.5h,过滤,得到溴代产物二氯乙烷溶液。
36.以上一步溴代产物溴代产物二氯乙烷溶液为原料,氮气保护下,投入55.4g(0.324mol)苄基溴、57.2g(0.54mol) na2co3,升温至50℃,保温2h,降温,过滤,脱干,得到目标产物ⅰ,称重:136.8,收率:99.8%,纯度:99.6%(hplc),总收率:89.8%。核磁检测图谱如图5-图9所示。
37.实施例2通氮气保护体系,向1l三口瓶中依次投入8.3g(0.345mol)mg粉,升温到50℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/400g thf,滴加毕,滴加37.4g (0.36mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
38.以上一步格氏产物的thf溶液为原料,氮气保护,投入82.5g(0.36mol) 2-溴-4-叔丁基苯酚、124.4g(0.9mol) k2co3、500g水、1.4g四(三苯基膦)钯,升温到40℃,保温反应3h。保温毕,分出有机相,脱干得到中间体
ⅱꢀ
,称重:79.2g,收率:78%,纯度:97.5%(gc)。
39.以上一步中间体ⅱ为原料,氮气保护,加入44.9g(0.281mol)溴素,450g二氯乙烷,温度为0℃,保温反应2h,过滤,得到溴代产物二氯乙烷溶液。
40.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入48.1g(0.281mol)苄基溴、49.8g(0.47mol) na2co3,升温至60℃,保温2h,降温,过滤,脱干,得到目标产物ⅰ,称重:106.9g,收率:90%,纯度:97.6%(hplc),总收率:70.2%。
41.实施例3通氮气保护体系,向1l三口瓶中依次投入8.3g(0.345mol)mg粉,升温到70℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/400g thf,滴加毕,滴加37.4g(0.36mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
42.以上一步格氏产物的thf溶液为原料,氮气保护,投入82.5g(0.36mol) 2-溴-4-叔丁基苯酚、124.4g(0.9mol) k2co3、500g水、1.4g双(二叔丁基苯基膦)二氯化钯,升温到60℃,保温反应5h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:86.3g,收率:85%,纯度:99.0%(gc)。
43.以上一步中间体ⅱ为原料,氮气保护,加入54.5g(0.306mol) nbs,450g二氯乙烷,温度为20℃,保温反应3h,过滤,得到溴代产物二氯乙烷溶液。
44.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入55.4g(0.306mol)苄基溴、54.1g(0.51mol) na2co3,升温至40℃,保温2h,降温,过滤,脱干,得到目标产物ⅰ,称重:129.4,收率:95%,纯度:99.1%(hplc),总收率:80.8%。
45.实施例4通氮气保护体系,向1l三口瓶中依次投入8.3g(0.345mol)mg粉,升温到60℃,滴加
80.8g(0.3mol) 3,5-二叔丁基溴苯/500g thf,滴加毕,滴加37.4g(0.36mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
46.以上一步格氏产物的thf溶液为原料,氮气保护,投入82.5g(0.36mol) 2-溴-4-叔丁基苯酚、124.4g(0.9mol) k2co3、500g水、1.4g双(三苯基膦)二氯化钯,升温到45℃,保温反应4h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:88.3g,收率:87%,纯度:99.3%(gc)。
47.以上一步中间体ⅱ为原料,氮气保护,加入55.7g(0.313mol) nbs,500g二氯乙烷,温度为30℃,保温反应2.5h,过滤,得到溴代产物二氯乙烷溶液。
48.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入53.5g(0.313mol)苄基溴、55.3g(0.522mol) na2co3,升温至60℃,保温3h,降温,过滤,脱干,得到目标产物ⅰ,称重:132.5,收率:96%,纯度:99.5%(hplc),总收率:83.5%。
49.实施例5通氮气保护体系,向1l三口瓶中依次投入7.2g(0.3mol)mg粉,升温到65℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/240g thf,滴加毕,滴加31.2g(0.3mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
50.以上一步格氏产物的thf溶液为原料,氮气保护,投入68.7g(0.3mol) 2-溴-4-叔丁基苯酚、82.9g(0.6mol) k2co3、500g水、0.687g双(三环己基膦)二氯化钯,升温到45℃,保温反应5h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:89.9g,收率:88.5%,纯度:99.3%(gc)。
51.以上一步中间体ⅱ为原料,氮气保护,加入47.3g(0.266mol) nbs,400g二氯乙烷,温度为15℃,保温反应2h,过滤,得到溴代产物二氯乙烷溶液。
52.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入45.4g(0.266mol)苄基溴、28.2g(0.266moll) na2co3,升温至45℃,保温4h,降温,过滤,脱干,得到目标产物ⅰ,称重:135.0,收率:98%,纯度:99.5%(hplc),总收率:86.7%。
53.实施例6通氮气保护体系,向1l三口瓶中依次投入9.4g(0.39mol)mg粉,升温到55℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/480g thf,滴加毕,滴加40.6g(0.39mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
54.以上一步格氏产物的thf溶液为原料,氮气保护,投入89.3g(0.39mol) 2-溴-4-叔丁基苯酚、207g(1.5mol) k2co3、500g水、2.1g双(三环己基膦)二氯化钯,升温到55℃,保温反应4.5h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:90.4g,收率:89%,纯度:99.5%(gc)。
55.以上一步中间体ⅱ为原料,氮气保护,加入57.7g(0.347mol) nbs,450g二氯乙烷,温度为23℃,保温反应2h,过滤,得到溴代产物二氯乙烷溶液。
56.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入59.4g(0.347mol)苄基溴、56.6g(0.534mol) na2co3,升温至45℃,保温5h,降温,过滤,脱干,得到目标产物ⅰ,称重:131.4,收率:97%,纯度:99.5%(hplc),总收率:86.3%。
57.实施例7
通氮气保护体系,向1l三口瓶中依次投入10.8g(0.45mol)mg粉,升温到60℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/808g thf,滴加毕,滴加46.8g(0.45mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
58.以上一步格氏产物的thf溶液为原料,氮气保护,投入103.1g(0.45mol) 2-溴-4-叔丁基苯酚、276.4g(2.0mol) k2co3、3.5g双(三环己基膦)二氯化钯,升温到50℃,保温反应4h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:84.3g,收率:83%,纯度:98.5%(gc)。
59.以上一步中间体ⅱ为原料,氮气保护,加入66.6g(0.374mol) nbs,670g二氯乙烷,温度为20℃,保温反应2h,过滤,得到溴代产物二氯乙烷溶液。
60.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入64g(0.374mol)苄基溴、79.3g(0.75mol) na2co3,升温至60℃,保温3h,降温,过滤,脱干,得到目标产物ⅰ,称重:120.2,收率:95%,纯度:99.2%(hplc),总收率:78.8%。
61.实施例8通氮气保护体系,向1l三口瓶中依次投入7.2g(0.3mol)mg粉,升温到65℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/161.2g thf,滴加毕,滴加31.2g(0.3mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
62.以上一步格氏产物的thf溶液为原料,氮气保护,投入82.5g(0.36mol) 2-溴-4-叔丁基苯酚、124.4g(0.9mol) k2co3、500g水、4.125g双(三环己基膦)二氯化钯,升温到50℃,保温反应3.5h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:91.9g,收率:90%,纯度:99.4%(gc)。
63.以上一步中间体ⅱ为原料,氮气保护,加入72.15g(0.405mol) nbs,367.6g二氯乙烷,温度为25℃,保温反应3h,过滤,得到溴代产物二氯乙烷溶液。
64.以上一步溴代产物二氯乙烷溶液为原料,氮气保护下,投入73.87g(0.432mol)苄基溴、85.85g(0.81mol) na2co3,升温至50℃,保温2h,降温,过滤,脱干,得到目标产物ⅰ,称重:117.67,收率:93%,纯度:99.2%(hplc),总收率:83.7%。
65.对比例1采用实施例1相同的方法制备中间体ii,不同之处在于步骤s2中的催化剂使用二氯化钯,具体步骤如下:通氮气保护体系,向1l三口瓶中依次投入8.3g(0.345mol)mg粉,升温到65℃,滴加80.8g(0.3mol) 3,5-二叔丁基溴苯/400g thf,滴加毕,滴加37.4g(0.36mol)硼酸三甲酯,保温1h。保温毕,倒入80ml 10%盐酸水溶液,水解,分出上层有机相,得到格氏产物的thf溶液。
66.以上一步格氏产物的thf溶液为原料,氮气保护,投入82.5g(0.36mol) 2-溴-4-叔丁基苯酚、124.4g(0.9mol) k2co3、500g水、1.4g二氯化钯,升温到50℃,保温反应3.5h。保温毕,分出有机相,脱干得到中间体ⅱ,称重:60.05g,收率:73%,纯度:95.7%(gc)。
67.以上一步中间体ⅱ为原料,氮气保护,加入57.7g(0.324mol) nbs,450g二氯乙烷,温度为25℃,保温反应2.5h,过滤,得到溴代产物二氯乙烷溶液。
68.以上一步溴代产物溴代产物二氯乙烷溶液为原料,氮气保护下,投入55.4g
(0.324mol)苄基溴、57.2g(0.54mol) na2co3,升温至50℃,保温2h,降温,过滤,脱干,得到目标产物ⅰ,纯度:96.8%(hplc),总收率:64%。
69.从实施例1和对比例1的数据比对可以看出:采用本发明所述的催化剂制备中间体ii,更利于得到高收率、高纯度的中间体ii,从而利于后续2-苄氧基-3-溴-5,3,5-三叔丁基联苯的制备,最终得到高收率、高纯度的2-苄氧基-3-溴-5,3,5-三叔丁基联苯产品。
70.另外,通过实施例1-8的实验数据可以看出,采用本发明所述方法制备2-苄氧基-3-溴-5,3,5-三叔丁基联苯产品,操作简单,无需高温、低温及高压条件,反应条件温和,产品收率高、纯度高,更适合工业化应用。
71.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合穷举,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
72.对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围,本发明的保护范围以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1