一种创制水稻高产优质的方法与流程
1.本发明涉及植物基因工程技术领域,特别是涉及一种创制水稻高产优质的方法。
背景技术:
2.水稻是世界上重要的粮食作物之一,是世界一半以上人口的主要碳水化合物和营养来源。随着经济快速发展和人民生活水平的不断提高,在满足水稻产量需求的同时,人们对稻米品质提出了更高的要求。水稻的高产、优质、适应机械化等一直以来都是育种家研究的重要目标。
3.全球气候变暖,对水稻的产量、品质等造成了不同程度的影响,因此,挖掘和研究能够影响产量和品质的基因具有重要意义。研究表明,多种途径影响了稻米产量和品质的改变。如gs5通过控制水稻粒宽、充实度和千粒重(li et al.,natural variation in gs5 plays an important role in regulating grain size and yield in rice.nat genet,2011,43,1266-1269.);通过调控基因的表达水平来影响水稻产量,如osalaat1在调节水稻胚乳贮藏淀粉和蛋白质积累中起着重要作用,过量表达该基因能增加籽粒重量(zhong,et al,floury endosperm12 encoding alanine aminotransferase 1regulates carbon and nitrogen metabolism in rice.journal of plant biology2019,62.1:61-73.);flo16的过表达增加籽粒重量(teng,et al.,flouryendosperm16encoding a nad-dependent cytosolic malate dehydrogenase plays an important role in starch synthesis and seed development in rice.plant biotechnology journal,2019.)。尽管如此,关于同时影响产量和稻米品质基因的研究,仍然存在大量空白。
技术实现要素:
4.本发明的目的是提供一种创制水稻高产优质的方法,以解决上述现有技术存在的问题。实验验证,本发明提供的基因或载体在提高水稻粒重、水稻单株产量和降低水稻垩白粒率中有一定的作用。
5.为实现上述目的,本发明提供了如下方案:
6.技术方案一:一种oshsp70-2基因,核苷酸序列如seq id no:1所示。
7.技术方案二:一种载体,包括所述的oshsp70-2基因。
8.技术方案三:一种能够提高水稻粒重、单株产量和降低垩白粒率的方法,包括以下步骤:
9.(1)构建pcubi1390-oshsp70-2过表达载体;
10.(2)将所述过表达载体导入农杆菌,得到pcubi1390-oshsp70-2农杆菌;
11.(3)利用所述pcubi1390-oshsp70-2农杆菌去侵染水稻,得到再生苗;
12.(4)标记筛选再生苗获得阳性植株。
13.进一步地,在步骤(3)中,所述水稻的品种包括粳稻中花11、宁粳1号和籼稻华占。
14.进一步地,在步骤(4)中,所述标记筛选包括潮霉素标记筛选和rt-pcr方法。
15.技术方案四:一种所述的基因或如所述的载体在提高水稻粒重中的应用。
16.技术方案五:一种所述的基因或所述的载体在提高水稻单株产量中的应用。
17.技术方案六:一种所述的基因或所述的载体在降低水稻垩白粒率中的应用。
18.本发明公开了以下技术效果:
19.对于水稻热激蛋白oshsp70-2基因,本发明发现过表达水稻中的该基因,导致粒长增加,即得到水稻热激蛋白oshsp70-2基因可以提高水稻籽粒重量,所述oshsp70-2基因的核苷酸序列如seq id no.1所示。将构建的pcubi1390-oshsp70-2载体在不同背景的野生型材料中进行表达,结果显示较野生型,转基因植株的粒长、千粒重以及单株产量显著增加。
20.本发明具体涉及oshsp70-2基因的编码序列,通过构建pcubi1390-oshsp70-2过表达载体,利用农杆菌介导法导入水稻,以潮霉素标记筛选获得阳性转基因植株,进一步采用rt-pcr方法获得表达量较高的阳性植株。在不同遗传背景下oshsp70-2基因的过表达材料的粒长、千粒重以及单株产量均高于野生型。通过系统研究中花11背景下过表达材料的外观品质(垩白粒率)以及营养品质(总淀粉含量、直链淀粉、总蛋白含量),发现oshsp70-2的过表达材料垩白粒率显著低于野生型,总淀粉、直链淀粉以及总蛋白含量均显著高于野生型。
21.本发明基因过表达后能显著提高籽粒重量,降低稻米垩白,改良稻米品质,具有重要的育种利用价值。
附图说明
22.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
23.图1为oshsp70-2基因在水稻不同组织中的时空表达模式分析图;
24.图2为oshsp70-2基因的亚细胞定位图;
25.图3为本发明过表达载体pcubi1390-oshsp70-2图谱,其中,a为载体的线性示意图;b为载体环状示意图;
26.图4为对转基因株系的潮霉素鉴定图,其中,m为marker,1为pcubi1390质粒,2为ddh2o,3为中花11背景下过表达转基因株系,4为宁粳1号背景下过表达转基因株系,5为华占背景下过表达转基因株系,6为中花11野生型株系,7为宁粳1号野生型株系,8为华占野生型株系;
27.图5为中花11背景下过表达oshsp70-2基因的表达水平图;
28.图6为中花11背景下过表达oshsp70-2基因的转基因阳性株系图;
29.图7为中花11背景下过表达oshsp70-2基因的农艺性状统计图,其中,农艺性状包括株高和分蘖;
30.图8为中花11背景下过表达oshsp70-2基因的粒型统计图;
31.图9为中花11背景下过表达oshsp70-2基因的农艺性状统计图,其中,农艺性状包括粒长、粒宽、千粒重和单株产量;
32.图10为宁粳1号背景下过表达oshsp70-2基因的表达水平图
33.图11为宁粳1号背景下过表达oshsp70-2基因的转基因阳性株系图;
34.图12为宁粳1号背景下过表达oshsp70-2基因的农艺性状统计图,其中农艺性状包括株高和分蘖;
35.图13为宁粳1号背景下过表达oshsp70-2基因的粒型统计图;
36.图14为宁粳1号背景下过表达oshsp70-2基因的农艺性状统计图,其中,农艺性状包括粒长、粒宽、千粒重和单株产量;
37.图15为华占背景下过表达oshsp70-2基因的表达水平图;
38.图16为华占背景下过表达oshsp70-2基因的转基因阳性株系图;
39.图17为华占背景下过表达oshsp70-2基因的农艺性状统计图,其中,农艺性状包括株高和分蘖;
40.图18为华占背景下过表达oshsp70-2基因的粒型统计图;
41.图19为华占背景下过表达oshsp70-2基因的农艺性状统计图,其中,农艺性状包括粒长、粒厚、千粒重和单株产量;
42.图20为中花11背景下过表达oshsp70-2基因的稻米垩白粒率统计图;
43.图21为中花11背景下过表达oshsp70-2基因的稻米品质分析统计图,其中稻米品质包括每粒种子的淀粉含量、直链淀粉百分含量以及每粒种子的蛋白含量;
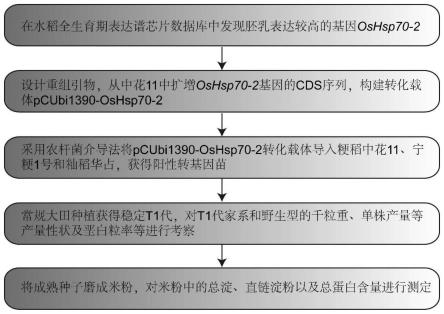
44.图22为本发明提供的一种能够提高水稻粒重、单株产量和降低垩白粒率方法的详细流程图。
具体实施方式
45.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
46.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
47.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
48.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
49.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
50.实施例1
51.本发明所提供的能够提高水稻粒重、单株产量和降低垩白粒率方法的详细流程,
详见图1。
52.水稻热激蛋白基因oshsp70-2的时空表达模式
53.为了获得水稻热激蛋白基因oshsp70-2的表达模式,在水稻的不同生育期对各个部位取样进行rna提取,其中每个样本设置三次重复。其中水稻种子rna的提取是参照玉米胚乳rna提取方法,采用sds-trizol法(joao leiva,ricardo dante and david holding),水稻其他组织(根、茎、叶、穗)rna的提取全部采用trizol法。
54.具体步骤如下:
55.(1)试剂配制与样品准备
56.配制sds-buffer(50mm tris ph 8.0,150mm licl,5mm edtaph 8.0,1%sds)以及所用的容器和枪头均采用depc水;从-80℃冰箱中取出的对应样品,放置于冰上待用,用镊子快速去除颖壳,然后装入放置在冰上的1.5mlrna-free离心管中,每个时期的样品取3-5粒种子即可;
57.(2)sds-buffer提取
58.向上述离心管中加入400μl的sds-buffer,准备酒精火焰上烫好的钢珠,每个离心管中加入一颗,立即放入dna提取打样震荡机内,1min快速将样品碾碎;加入800μl苯酚(平衡在tris ph8.0中)-氯仿(1:1),充分摇匀,冰上放置5min,10,000g,4℃离心10min;吸取上清500μl,至一个新的rna-free的1.5ml离心管中;
59.(3)trizol提取
60.向样品加入1mltrizol提取液;加入200μl氯仿,振荡摇匀,室温放置3min;10,000g,4℃离心10min;
61.(4)rna沉淀
62.小心吸取500μl上清到一个新的rna-free的1.5ml离心管中,加入400μl异丙醇,上下颠倒混匀后置于冰上冰浴10min;10,000g,4℃离心10min,
63.(5)rna清洗和溶解
64.小心倒掉上清,加500μl 75%乙醇(depc水配制),轻轻地将底部的rna沉淀悬浮起来;10,000g,4℃离心5min,小心倒掉上清,再短暂离心15s,采用rna-free枪头吸取残留液体,然后置于超净工作台内风干;加40μl depc水,轻弹,促进rna沉淀的溶解。
65.(6)rna的消化(去除gdna的污染)
66.反应体系为template rna40μl,10x buffer 4.5μl,dnase i,rnase-free 4μl,采用金属浴37℃处理30min,75℃处理5min,存放于-80℃冰箱。
67.(7)第一链cdna的合成
68.采用revertra ace qpcr rt kit(toyobo,osaka,japan)试剂盒进行反转录获取cdna。每个rnase-free离心管中加入等量的消化好的rna,并加入rnase-free water混匀,反转体系如下:total rna(2μg),rna-free water添至22μl,反应条件:采用金属浴75℃处理5分钟,立即放置于冰上待用;每个离心管中继续加入5x quantiscript rt buffer 8μl,dntp 4μl,oligdt(20)2μl,rna inhibitor 2μl,revertraace 2μl,混合成总体积为40μl的反应体系,反应条件为42℃孵育60min,75℃孵育5min终止反应,反应完成后加入等体积rna-free water稀释一倍,混匀后在-20℃冰箱保存备用。
69.(8)实时荧光定量pcr
70.采用试剂盒:sybr green real-time pcrmaster mix(toyobo),反应体系:2x sybr premix ex taq ii 10μl,10μm pcrforward primer 2μl,10μm pcr reverse primer 2μl,cdna模板4μl,用水添至20μl。pcr程序为:95℃30s,95℃5s,60℃30s,循环数为40;95℃15s,60℃1min,95℃15s。
71.(9)结果分析:
72.real-time pcr实验的结果是根据2
‑△△
ct
法来计算与分析,水稻actin1(os03g0718150)基因作为内参。结果表明oshsp70-2在各时期各组织都有表达,其中发育中的种子表达相对较高(如图1所示)。
73.实施例2
74.水稻热激蛋白oshsp70-2的定位
75.选用pan580和1305-ubigfp载体,其中pan580选用spe i和xba i进行双酶切,1305-ubigfp选用kpn i和bamh i双酶切,割胶回收并纯化,备用。将oshsp70-2蛋白,根据其氨基酸序列设计重组引物,用中花11的cdna为模板,进行pcr扩增。用同源重组酶将切开的并纯化好的载体与pcr产物进行连接并转化大肠杆菌,将测序正确的大提质粒并转化水稻原生质体,用激光共聚焦观察荧光表达部位及拍照(lsm710,zeiss,germany),具体操作步骤如下:
76.(1)水稻幼苗培养
77.配置1/2ms,同时将培养瓶一起灭菌,灭菌冷却后加入卡那霉素,等将培养基倒入培养瓶中3cm厚;选取含胚完整93-11米粒,干净,无黑色素,用75%乙醇消毒1min后,用无菌水洗三次,换50%巴氏消毒液消毒30min,在摇床上上下摇动。巴氏消毒后用无菌水洗4次左右,直至气泡消失,将消毒后的种子放置超净台上吹干。转移至1/2ms培养基上,然后将其置于30℃培养箱中培养,2周后幼苗即可用于原生质体的提取。
78.(2)原生质体提取
79.取出15棵10-13天幼苗,于干净的a4纸上切成小于0.5mm片段,及时转入0.6m甘露醇溶液中,待所有的幼苗切完后,置于真空箱中30min,抽去叶片中的空气,通过40μm过滤网去除0.6m甘露醇,加入室温酶解液,于28℃摇床,40rpm酶解4h;酶解完成后,用40μm过滤网去除酶解液,加入10mlw5后,于28℃,40rpm摇床上释放10min,过滤至一个50ml离心管中标记为管1,再加入10mlw5后,于28℃,40rpm摇床上释放10min,过滤至另一个50ml离心管中标记为管2;70g室温离心过滤液5min,水平转头,加速减速设置为1,吸弃上清;加入1mlw5溶液悬浮原生质体,小心地晃动离心管,让原生质体能够充分的在w5溶液中释放。吸取10μl原生质悬浮液并计数,调整原生质体浓度到0.5-1
×
107/ml;于70g室温离心5min,弃去上清,将原生质体重悬于mmg中,并将浓度调整到0.5-1
×
107/ml,准备好需要转化的质粒5μg或10μg,将其稀释至10μl,向每个圆底离心管内加入200μl原生质体悬浮液,用拇指轻弹混匀后,再向离心管内加入peg-cacl2溶液210μl,轻弹混匀。放置于室温环境下10-15min;然后向离心管内加入w5溶液840μl以停止转化;将离心管转移至离心机内(水平转头,100g)离心5min加入0.5mlwi溶液,重悬原生质体,并将其转移到培养板中,培养板中预先加入300μlwi溶液;培养14h。将培养好的原生质体离心5分钟(水平转头,100g),去除上清,剩余部分用于观察荧光信号。
80.(3)结果显示
81.转入空载体质粒的水稻原生质体细胞质和细胞核中都有荧光信号分布,oshsp70-2::gfp融合蛋白绿色荧光都能与叶绿体自发红光发生重叠,表明oshsp70-2可能在叶绿体中发挥作用(如图2所示)。
82.实施例3
83.oshsp70-2基因过表达材料的获得
84.为了获得oshsp70-2基因过表达材料,采用农杆菌介导的遗传转化方法转化。具体操作步骤如下:
85.(1)重组载体的获得
86.根据水稻基因数据库(https://www.ricedata.cn/gene/)网站提供的基因oshsp70-2(搜索号为loc_os12g14070.1)序列信息设计重组引物:
87.oshsp70-2-cds-f:
[0088]5′
ttacttctgcactaggtaccatggcctccttcacctccca-3
′
;
[0089]
oshsp70-2-cds-r:
[0090]5′‑
gaattcccggggatcctcaattgctgtcagtgaaat-3
′
;
[0091]
oshsp70-2基因的核苷酸序列如seq id no:1所示;
[0092]
seq id no:1:
[0093]
atggcctccttcacctcccagctcggcgccatggcgtgcggcgccgccccctccacctcgcccctcgcggcccggaggagcgggcagctgttcgtggggcggaagcccgcggcggcgtcggtgcagatgcgggtgccgcgggcggggcgggcgcggggggtggcgatgcgggtggcgtgcgagaaggtggtggggatcgacctcgggacgaccaactccgcggtggcggcgatggagggcgggaagccgacggtcatcaccaacgccgagggccagcggacgacgccctccgtggtggcgtacaccaagggcggggagcggctggtcgggcagatcgccaagcggcaggccgtcgtcaacccggagaacaccttcttctccgtcaagcgcttcatcggccgcaagatggccgaggtcgacgacgaggccaagcaggtctcctaccacgtcgtccgcgacgacaacggcaacgtcaagctcgactgccccgccatcggcaagcagttcgccgccgaggagatttccgcgcaggtcttgaggaagttggtggacgatgcatctaagtttttgaatgacaaaattaccaaagcagtggttactgttcctgcatacttcaatgactcacagaggacagcaacaaaagatgctggacgtattgcaggattggaagttctccgcattataaatgagccgactgctgcatcccttgcttatggttttgagaagaaaaacaacgaaacgattcttgtgtttgacttgggaggcggtacctttgatgtctctgtattggaggttggagatggtgtgtttgaggtgctttccacatctggtgacacacaccttggtggcgatgacttcgataagaaagttgtggattggcttgctagcaactttaagaaagatgaaggcattgatcttctgaaagacaaacaagccctgcagcgactcactgaggcagcagagaaagcgaagatggaactgtctacgctgtctcagacaaacattagcttgcctttcataactgctactgctgatgggcctaaacacatcgagacaactctctccagagccaaatttgaggagctatgttcggacctcattgataggcttaaaactcctgtcactaatgccttgagagatgccaaactgtctgttgataacctggacgaagtgattcttgttggtggatccactcgtatcccttccgtgcaagagcttgtgaagaagatcactggcaaggatcccaatgtcacagtcaaccctgatgaggttgtttctcttggggcagctgtacagggtggagttttggccggagatgtgaaagatgtcgttcttcttgatgttactccattgtctcttggtctggagacgttgggtggagtgatgaccaagattattcccagaaacacaacactgcccacctcaaaatcagaggtattctccacagctgcagatggacagacaagtgttgagataaatgttcttcagggagagagagagtttgtccgggacaacaagtctcttggaagcttccgcttggatggaatccctcctgcaccacgtggtgttccacaaattgaagtcaagtttgatattgatgccaatggtattctctctgttgctgctattgataagggtactgggaagaaacaggatatcaccatcaccggcgctagtacactgccaaaggatgaggttgagagaatggtggaagaggctgacaagtttgctcaggaggac
aaagagaaaagagatgccattgataccaaaaaccaggcagactctgtggtctaccagactgagaagcaactgaaggagctaggtgacaaggtacctgcacctgtgaaagagaaggtggatgcaaagctcaacgagctcaaagaggccattgcgggtggatcaacacagagcatgaaggatgccatggctgctttaaacgaggaagttatgcagatcggccaggccatgtacaaccagcagcctaatgctggtgctgctggacctactcctggtgccgatgctggaccgacaagctcaggcggtaagggaccgaatgatggagatgttattgatgcggatttcactgacagcaattga。
[0094]
采用上述重组引物,以水稻中花11的cdna为模板进行pcr扩增,将得到的2097bp的pcr产物与切开并纯化好的线性化载体pcubi1390于50℃金属浴上进行连接,然后转化dh5α大肠杆菌感受态,涂布于含有50μg/ml的卡那霉素抗性的lb固体培养基上,于37℃培养12-16h,挑单克隆于卡那霉素抗性的lb液体培养基中,37℃培养至菌液变浑浊,继而采用重组引物对摇混的单克隆菌进行pcr检测,获得阳性重组菌送测序验证,将得到的正确的载体命名为pcubi1390-oshsp70-2,即为基因oshsp70-2的表达载体。将pcubi1390-oshsp70-2转化根癌农杆菌eha105感受态,进行农杆菌转化,获得阳性菌株,将菌株邮寄至转基因公司进行转基因,受体材料分别为中花11、宁粳1号和华占。
[0095]
实施例4
[0096]
过表达oshsp70-2基因转基因株系表达量鉴定
[0097]
为了进一步鉴定上述得到的过表达转基因株系,将得到的转基因苗放在常温光照培养箱中培养一星期左右,然后再进行阳性苗的鉴定,具体步骤如下:
[0098]
(1)潮霉素抗性检测法
[0099]
剪取1-2cm长度左右的新鲜绿色叶片,野生型中花11的叶片作为阴性对照,将叶片直立放入含约1.8ml检测溶液的2ml离心管中,检测液是由50mg/l潮霉素水溶液和0.5mg/l 6-苄氨基嘌呤配制而成,将离心管水平放置于固定的平板内,这样就会让检测液和叶片充分接触。打开培养箱,将光照设置成12h光照/12h黑暗,温度设置成28℃,然后将准备好的样品置于该培养箱内,定期观察离心管内叶片的颜色变色,以判断其抗性水平。非转基因和非抗性的转基因水稻叶片从第二天开始在切口部位发生褐化,时间越长,褐化面积会沿着叶脉深入并扩展,因此大约4-5天即可观察到大面积的褐化病斑,与抗性转基因水稻叶片的新鲜绿色形成鲜明对比。
[0100]
(2)dna分子水平检测法
[0101]
采用ncbi在线设计潮霉素引物,用提取好的过表达转基因植株叶片的dna作为模板,进行pcr扩增,阴性对照一般用水或非转基因材料的叶片dna,将扩增好的样品进行琼脂糖电泳,检测是否有条带,有条带的为阳性植株,引物信息如下:
[0102]
hygf:gacctgatgcagctctcgga;
[0103]
hygr:gctgttatgcggccattgtc。
[0104]
提取过表达转基因株系的rna,反转成cdna,备用。进一步进行qrt-pcr(步骤同实施例1)。所用引物为qrt-hsp70-2f与qrt-hsp70-2r,以水稻组成型表达基因actin1为内参,引物序列如下:
[0105]
actin-f:ccctcctgaaaggaagtacagtgt;
[0106]
actin-r:gtccgaagaattagaagcatttcc;
[0107]
qrt-hsp70-2f:gcctaatgctggtgctgctg;
[0108]
qrt-hsp70-2r:gtcccttaccgcctgagctt。
[0109]
real-time pcr实验的结果是根据2
‑△△
ct
法来计算与分析,水稻actin1(os03g0718150)基因作为内参。结果表明中华11背景下的t2代转基因株系中编号为oe1和oe5的转基因株系中oshsp70-2基因的表达量显著高于野生型中oshsp70-2基因的表达量(如图3所示);宁粳1号下t2代转基因株系中编号为oe1和oe29的转基因株系中oshsp70-2基因的表达量显著高于野生型中oshsp70-2基因的表达量(如图4所示);华占背景下t2代转基因株系中编号为oe1和oe5的转基因株系中oshsp70-2基因的表达量显著高于野生型中oshsp70-2基因的表达量(如图5-9所示)。
[0110]
实施例5
[0111]
过表达oshsp70-2基因转基因株系对水稻产量相关农艺性状的影响
[0112]
大田栽培野生型(zh11、ninggeng01和huazhan)和t2代转基因株系,常规的日照和水肥管理。等生长到分蘖盛期选取oshsp70-2基因的表达量显著升高的株系和其对应的野生型植株各自15株,统计水稻的分蘖数(如图5、10和15所示)。至水稻成熟期,选取oshsp70-2基因的表达量显著升高的株系和其对应的野生型植株各自15株,统计水稻株高(如图6、11和16所示)。同时统计产量性状,粒长、粒宽、千粒重和单株产量(如图5-19所示)。结果显示粳稻(zh11和ninggeng01)背景材料下的oshsp70-2过表达株系的株高和分蘖数比野生型无显著差异,而籼稻(huazhan)背景下oshsp70-2过表达株系的株高比野生型显著降低,分蘖显著增加。三种背景下的oshsp70-2过表达株系的的籽粒粒长、粒宽、千粒重和单株产量较野生型植株相对应指标均有所增加(如图5-19所示)。
[0113]
实施例6
[0114]
中花11背景下过表达oshsp70-2基因转基因株系稻米品质鉴定,结果如图20和图21所示;大田栽培野生型zh11和t2代转基因株系,常规的日照和水肥管理,收获得到成熟种子,用于以下实验。
[0115]
(1)稻米垩白粒率分析
[0116]
对得到的野生型和转基因成熟种子,随机挑取100粒成熟种子,去除种壳后,统计垩白粒率。
[0117]
(2)稻米营养品质分析
[0118]
1.总淀粉含量测定:
[0119]
将野生型和过表达株系成熟种子去壳后磨成米粉,采用100目的网筛小心地将米粉过筛至干净自封袋中,备用。每个样品称取50mg,设置三个重复,放入50ml的离心管中,向离心管中沿着管壁轻轻地加入80%的无水乙醇5ml,将其放置于85℃水浴锅中5min,再次加入5ml的80%无水乙醇,然后离心,转速为4000g,离心10min,用枪小心地吸掉上清,向沉淀中加入80%无水乙醇10ml,轻轻地混匀,进一步常温4000g离心10min,然后快速地将离心好的50ml的离心管倒扣在滤纸上,自然风干里面残留的乙醇。
[0120]
向样品加1ml的ddh2o溶解,沸水浴30min;冷却至室温,加4ml的2mkoh,室温下振荡30min(防止结块);加入16ml的醋酸钠(1.2m,ph=3.8)和200μl淀粉葡萄糖苷酶(3000u/ml),于60℃水浴锅水浴45min,期间振荡2次,最后定容至100ml,轻轻混匀。用god-pap测定葡萄糖含量,取1ml处理好的样品至1.5ml离心管中,4000rpm离心10min,取100μl上清至10ml试管或10ml离心管中,加入3ml god-pap(提前拿出来,用锡箔纸包好,放置在冰上融化),37℃恒温水浴20min,上下颠倒,充分混匀;使用酶标仪(infinite 200pro,tecan,瑞
士)于510nm波长测定吸光值,用100μl的0.1m(ph 4.75)醋酸钠与3ml god-pap试剂在同一条件下处理的反应液来进行空白调零。所有的样品必须在60min内完成测定。梯度葡萄糖溶液标准样品反应液如表1所示。
[0121]
表1梯度葡萄糖溶液标准样品反应液
[0122][0123]
根据酶标仪中测出来的标准样品的吸光值与以及标准样品已知的浓度,建立标准曲线与回归方程,然后,将每一个样品的吸光值代入回归方程中得出对应的葡萄糖含量,最后换算成总淀粉的含量(总淀粉含量等于0.9倍葡萄糖含量,样品水分含量按12%计算),每个样品重复三次;根据千粒重计算出每粒种子重量,进一步将50mg除以每粒种子重量就可以得出50mg米粉对应多少粒种子,再将前面得到的总淀粉含量除以种子粒数即可得出每粒种子的总淀粉含量最后将平均值作为总淀粉的含量,中花11以及oshsp70-2基因过表达两个株系每粒种子总淀粉含量分别为16.3、19.3和20.6毫克。
[0124]
2.直链淀粉含量测定:
[0125]
将需要测定的材料的成熟种子去壳,磨成米粉,用100目的筛子过筛,称量50mg米粉和标样至50ml容量瓶中(每组3个重复),轻轻振荡容量瓶,将容量瓶管壁附着的米粉震荡至瓶底。向50ml容量瓶中加入500μl的无水乙醇,轻轻旋转50ml的容量瓶,以便于米粉能够无水乙醇充分混匀;再加入1m的naoh溶液4.5ml,边加边旋转瓶身,将附着在内壁上的米粉冲至瓶底,室温下24h过夜静置;加ddh2o定容至50ml,轻轻摇晃混匀;吸取5ml ddh2o至10ml试管中,再加入空白、标样以及待测样品各500μl(吸取之前,前面两枪不要,润洗枪头,减少实验误差),向试管中加入100μl的1m的醋酸溶液、200μl的ki-i2和4.2ml的ddh2o,采用涡旋振荡器将溶液充分摇匀,静置20min。使用酶标仪(infinite 200pro,tecan,瑞士)在波长620nm处测定各样品的吸光值od
620
,使用前,用空白反应液调零;绘制标准曲线(标样浓度0.4%,10.3%,16.6%,26.6%),根据做好的标准曲线来计算各样品的直链淀粉含量,中花11以及oshsp70-2基因过表达两个株系直链淀粉百分含量分别为12.4%、13.3%和14.8%。
[0126]
3.总蛋白含量测定:
[0127]
打开消化炉,设定温度为290℃,称取0.1g过筛米粉于100ml消化管内加入5ml h2so4,待温度达290℃时,将样品放置消化炉内,煮沸20min。然后取出消化管轻轻摇匀,再次放入消化炉中,290℃处理1h,中间每隔15min拿出消化管摇匀,1h结束后,取出消化管,冷却至室温。加入1mlh2o2,使其充分混匀,再将消化管放回消化炉中,处理10min后检查样品是否变得澄清(如果10min后,样品仍未变澄清,则加入0.5mlh2o2,再放进消化炉内直到变澄清为止),取出冷却至室温。最后定容到100ml,在foss公司的250型凯氏定氮仪上测定,中花11以及oshsp70-2基因过表达两个株系每粒种子蛋白含量分别3.2、3.6和3.6毫克。
[0128]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1