一种10-羟基-2-癸烯酸的制备方法
1.本发明涉及有机合成技术领域,尤其涉及一种10-羟基-2-癸烯酸的制备方法。
背景技术:
2.10-羟基-2-癸烯酸,又名王浆酸,随着科学家对其不断深入研究,发现王浆酸具有抗菌消炎、抑制病毒感染、延缓衰老、预防老年病以及镇疼、促进细胞再生等作用。由于王浆酸具有诸多优异的生物药理活性,科学家对其应用领域的开发从未停止。在王浆酸的获得方面,由于王浆酸仅存在于蜂王浆和蜂胶中且含量很低,采用物理方法提取成本较高,且提取工艺较为繁琐。对于生物途径合成报道甚微,且无现实生产意义。
3.因此现今主要通过化学方法来合成王浆酸。目前市面上的王浆酸均为化学法生产,其合成方法概括起来主要以辛二酸、6-溴己酸/醇、7-辛醇、8-羟基辛醇、10羟基癸酸等为原料,通过wittig-horner、格氏偶联、knoevenagel缩合法、臭氧氧化法等,以廉价易得的1,8-辛二醇为原料的合成工艺近年来讨论较多。
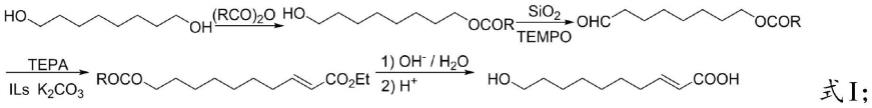
4.现有技术中王浆酸的制备工艺包括:第一种,用酸酐对辛二醇单酯化,在tempo催化剂下用naclo氧化,然后离子液溴化n-甲基吡啶中与膦酰基乙酸三乙酯通过wittig-horner反应,再水解酸化得到王浆酸,反应原理如式i所示:
[0005][0006]
第二种,用二氢吡喃对1,8-辛二醇单边保护,在nabr和负载sio2的tempo催化剂下用naclo氧化,然后与丙二酸和吡啶发生knoevenagel反应,酸化后得到王浆酸,反应原理如式ii所示:
[0007][0008]
第三种,0℃下乙酸酐对辛二醇单酯化,在tempo催化剂下用naclo氧化,然后与膦酰基乙酸三乙酯通过wittig-horner反应,再水解酸化得到王浆酸,反应原理如式iii所示:
[0009][0010]
第四种,以离子交换树脂和乙酸乙酯将1,8-辛二醇进行酯交换得到单酯化醇,接着用沙瑞特氧化后与膦酰基乙酸三乙酯通过wittig-horner反应,再水解酸化得到王浆酸,反应原理如式iv所示:
[0011]
[0012]
第五种,1,8-辛二醇在二氯甲烷中被定量的sio2和nahso4吸附,在tcca和tempo条件下氧化然后与膦酰基乙酸三乙酯通过wittig-horner反应,再水解酸化得到王浆酸,反应原理如式v所示:
[0013][0014]
现有的王浆酸的制备方法均存在收率低的问题。
技术实现要素:
[0015]
有鉴于此,本发明的目的在于提供一种10-羟基-2-癸烯酸的制备方法。本发明的制备方法收率高。
[0016]
为了实现上述发明目的,本发明提供以下技术方案:
[0017]
本发明提供了一种10-羟基-2-癸烯酸的制备方法,包括以下步骤:
[0018]
将1,8-辛二醇、有机羧酸、酸性阳离子交换树脂和有机溶剂混合进行酯化反应,得到酯化产物;
[0019]
将所述酯化产物、自由基捕获剂、催化剂、联吡啶、有机碱、溶剂和氧气混合进行氧化反应,得到氧化产物;所述自由基捕获剂包括2,2,6,6-四甲基哌啶氧化物、阻聚剂701、4-羧基tempo或4-甲氧基tempo;
[0020]
将所述氧化产物、磷酰基羧酸酯、碱性物质和溶剂混合进行wittig-horner反应,得到wittig-horner产物;
[0021]
将所述wittig-horner产物和无机碱性物质混合后,依次进行水解反应和萃取,将所得水相依次进行酸化和纯化,得到所述10-羟基-2-癸烯酸。
[0022]
优选地,所述酸性阳离子交换树脂为nkc-9或amberlyst15。
[0023]
优选地,所述1,8-辛二醇与酸性阳离子交换树脂的用量比为1mol:15~35g。
[0024]
优选地,所述1,8-辛二醇与有机羧酸的摩尔比为1:0.7~0.9。
[0025]
优选地,所述酯化反应的温度为70~110℃,时间为5~12h。
[0026]
优选地,所述氧化反应的溶剂包括乙腈、二氯甲烷、二氯乙烷或氯仿。
[0027]
优选地,所述wittig-horner反应的溶剂为醇-水混合液,所述醇包括乙醇或甲醇。
[0028]
优选地,所述醇-水混合液中醇与水的体积比为1~1.5:1。
[0029]
优选地,所述萃取采用的萃取剂为乙酸乙酯、二氯甲烷、四氢呋喃或甲基叔丁基醚。
[0030]
优选地,所述纯化使用的溶剂为二氯甲烷、乙腈、乙酸乙酯、乙醇、氯仿或1,2-二氯乙烷。
[0031]
本发明提供了一种10-羟基-2-癸烯酸的制备方法,包括以下步骤:将1,8-辛二醇、有机羧酸、酸性阳离子交换树脂和有机溶剂混合进行酯化反应,得到酯化产物;将所述酯化产物、自由基捕获剂、催化剂、联吡啶、有机碱、溶剂和氧气混合进行氧化反应,得到氧化产物;所述自由基捕获剂包括2,2,6,6-四甲基哌啶氧化物、阻聚剂701、4-羧基tempo或4-甲氧基tempo;将所述氧化产物、磷酰基羧酸酯、碱性物质和溶剂混合进行wittig-horner反应,得到wittig-horner产物;将所述wittig-horner产物和无机碱性物质混合后,依次进行水
解反应和萃取,将所得水相依次进行酸化和纯化,得到所述10-羟基-2-癸烯酸。
[0032]
本发明用酸性阳离子交换树脂替代硫酸做催化剂进行酯化反应,可以将二醇与羧酸单边结合形成单酯,选择性高,避免产生更多的双边酯化副产物,且酸性阳离子交换树脂可活化后再次循环利用,减少资源的浪费和环境的污染,能够提高10-羟基-2-癸烯酸的产率。
[0033]
进一步地,本发明氧化反应氧化采用tempo氧化方式,用毒性较小的二氯甲烷替代高毒的乙腈做溶剂,氧化彻底,反应稳定,且不出现过度氧化的问题。
[0034]
进一步地,本发明wittig-horner反应采用甲醇-水的混合溶剂体系比水为溶剂的体系反应更彻底,两相反应,增加甲醇促进两相混合,甲醇起到助溶的作用。
[0035]
进一步地,本发明用乙酸乙酯萃取有机大极性杂质,萃取完杂质进行酸化,酸化完王浆酸从水相中析出,纯度70%以上。
[0036]
进一步地,本发明用二氯甲烷重结晶,二氯甲烷能够提高王浆酸的纯度。
附图说明
[0037]
图1为实施例1制得的10-羟基-2-癸烯酸的氢谱图;
[0038]
图2为实施例1制得的10-羟基-2-癸烯酸的气相色谱检测图。
具体实施方式
[0039]
本发明提供了一种10-羟基-2-癸烯酸的制备方法,包括以下步骤:
[0040]
将1,8-辛二醇、有机羧酸、酸性阳离子交换树脂和有机溶剂混合进行酯化反应,得到酯化产物;
[0041]
将所述酯化产物、自由基捕获剂、催化剂、联吡啶、有机碱、溶剂和氧气混合进行氧化反应,得到氧化产物;所述自由基捕获剂包括2,2,6,6-四甲基哌啶氧化物、阻聚剂701、4-羧基tempo或4-甲氧基tempo;
[0042]
将所述氧化产物、磷酰基羧酸酯、碱性物质和溶剂混合进行wittig-horner反应,得到wittig-horner产物;
[0043]
将所述wittig-horner产物和无机碱性物质混合后,依次进行水解反应和萃取,将所得水相依次进行酸化和纯化,得到所述10-羟基-2-癸烯酸。
[0044]
在本发明中,所述10-羟基-2-癸烯酸的制备原理如式iv所示:
[0045][0046]
在本发明中,若无特殊说明,使用的原料均为本领域市售商品。
[0047]
本发明将1,8-辛二醇、有机羧酸、酸性阳离子交换树脂和有机溶剂混合进行酯化反应,得到酯化产物。
[0048]
在本发明中,所述酸性阳离子交换树脂优选为nkc-9或amberlyst15。
[0049]
在本发明中,所述1,8-辛二醇与酸性阳离子交换树脂的用量比优选为1mol:15~35g。
[0050]
在本发明中,所述有机羧酸优选为乙酸、丙酸、丁酸或异丁酸。
[0051]
在本发明中,所述1,8-辛二醇与有机羧酸的摩尔比优选为1:0.7~0.9,更优选为1:0.8。
[0052]
在本发明中,所述酯化反应的温度优选为70~110℃,更优选为90~100℃,时间优选为5~12h,更优选为8~10h。
[0053]
在本发明中,所述酯化反应的溶剂优选为甲苯、二甲苯、乙腈或二氧六环,更优选为甲苯,所述甲苯做溶剂,酯化反应完优选冷冻即可把少量未彻底反应的原料1,8-辛二醇析出来,过滤可将1,8-辛二醇与酸性阳离子交换树脂分离,二者皆可再次利用。
[0054]
在本发明中,所述酸性阳离子交换树脂失活后,优选用酸性溶液浸泡即可活化。
[0055]
在本发明中,所述酸洗溶液优选为硫酸溶液,所述硫酸溶液的质量浓度优选为5%。
[0056]
在本发明中,所述浸泡的时间优选为8h。
[0057]
所述酯化反应完成后,本发明优选冷却至-20~0℃,过滤除去剩余的1,8-辛二醇和酸性阳离子交换树脂,用饱和碳酸钠溶液洗涤反应混合物,蒸除溶剂后,粗产物经分子蒸馏纯化,得到淡黄色油状化合物,即所述酯化产物。
[0058]
得到酯化产物后,本发明将所述酯化产物、自由基捕获剂、催化剂、联吡啶、有机碱、溶剂和氧气混合进行氧化反应,得到氧化产物;所述自由基捕获剂包括2,2,6,6-四甲基哌啶氧化物、阻聚剂701、4-羧基tempo或4-甲氧基tempo。
[0059]
在本发明中,所述催化剂优选为cu(mecn)4]otf、cuno2、cubr2、cucl2、或cu(oac2)。
[0060]
在本发明中,所述1,8-辛二醇与催化剂的摩尔比优选为1:0.04~0.07,更优选为1:0.05~0.06。
[0061]
在本发明中,所述1,8-辛二醇与联吡啶的摩尔比优选为1:0.04~0.07,更优选为1:0.05~0.06。
[0062]
在本发明中,所述1,8-辛二醇与自由基捕获剂的摩尔比优选为1:0.04~0.07,更优选为1:0.05~0.06。
[0063]
在本发明中,所述氧化反应的溶剂优选包括乙腈、二氯甲烷、二氯乙烷或氯仿。
[0064]
在本发明中,所述氧气优选来自制氧机制氧、医用氧气或工业氧气,更优选为工业氧气。
[0065]
在本发明中,所述有机碱优选为n-甲基咪唑或咪唑,更优选为n-甲基咪唑。
[0066]
在本发明中,所述1,8-辛二醇与有机碱的摩尔比优选为1:0.1。
[0067]
在本发明中,所述氧化反应的温度优选为10~50℃,更优选为室温,时间优选为12~18h。
[0068]
所述氧化反应完成后,本发明优选用5wt%的硫酸洗涤反应混合物以除去催化剂中阳离子,有机层用盐水洗涤,用硫酸钠干燥,然后浓缩,得到淡黄色油状化合物,即为所述氧化产物。
[0069]
得到氧化产物后,本发明将所述氧化产物、磷酰基羧酸酯、碱性物质和溶剂混合进行wittig-horner反应,得到wittig-horner产物。
[0070]
在本发明中,所述磷酰基羧酸酯优选为磷酰基乙酸三甲酯或磷酰基乙酸三乙酯。
[0071]
在本发明中,所述氧化产物与磷酰基羧酸酯的摩尔比优选为1:1.3。
[0072]
在本发明中,所述碱性物质优选为碳酸钾、碳酸钠、三乙胺或吡啶,更优选为碳酸
钾。
[0073]
在本发明中,所述氧化产物与碱性物质的摩尔比优选为1:1.3。
[0074]
在本发明中,所述wittig-horner反应优选在氮气保护下进行,所述wittig-horner反应的温度优选为-30~30℃,更优选为0℃,时间优选为18~24h,所述wittig-horner反应优选在搅拌的条件下进行。
[0075]
在本发明中,所述wittig-horner反应的溶剂优选为醇-水混合液,所述醇优选包括乙醇或甲醇,本发明避免了以水为溶剂,所述氧化产物不能反应完全,延长时间也反应不彻底的问题。
[0076]
在本发明中,所述醇-水混合液中醇与水的体积比优选为1~1.5:1,更优选1:1。
[0077]
在本发明中,所述氧化产物与溶剂的用量比优选为2mol:1l。
[0078]
所述wittig-horner反应完成后,本发明优选蒸出溶剂后,用乙酸乙酯萃取反应混合物,合并有机层并用盐水洗涤,用硫酸钠干燥,然后浓缩,得到橙红色油状化合物,即所述wittig-horner产物,所得粗产物直接用于下一步反应,无需进一步纯化。
[0079]
得到wittig-horner产物后,本发明将所述wittig-horner产物、无机碱性物质混合依次进行水解反应和萃取,将所得水相依次进行酸化和纯化,得到所述10-羟基-2-癸烯酸。
[0080]
在本发明中,所述无机碱性物质优选为氢氧化钠水溶液。
[0081]
在本发明中,所述水解反应的温度优选为30~90℃,更优选为50~60℃,时间优选为8~12h,所述水解反应优选在搅拌的条件下进行。
[0082]
在本发明中,所述萃取的萃取剂优选为乙酸乙酯、二氯甲烷、四氢呋喃或甲基叔丁基醚,更优选为乙酸乙酯,所述乙酸乙酯能够提高10-羟基-2-癸烯酸的纯度。在本发明中,所述萃取的作用是除去有机大极性杂质。
[0083]
在本发明中,所述酸化优选使用硫酸,所述硫酸的浓度优选为5mol/l。
[0084]
所述酸化后,优选分出有机相,即为10-羟基-2-癸烯酸粗产物。
[0085]
在本发明中,所述纯化使用的溶剂优选为二氯甲烷、乙腈、乙酸乙酯、乙醇、氯仿或1,2-二氯乙烷,更优选为二氯甲烷,所述二氯甲烷优选为所述氧化反应回收的二氯甲烷。
[0086]
在本发明中,所述二氯甲烷与10-羟基-2-癸烯酸粗产物的质量比优选为1:1。
[0087]
为了进一步说明本发明,下面结合实例对本发明提供的10-羟基-2-癸烯酸及其制备方法和应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0088]
实施例1
[0089]
乙酸8-羟基辛酯
[0090]
1,8-辛二醇(292.0kg,2000mol)、乙酸(96.0kg,1600mol)和nkc-9树脂(50.0kg)溶于1600l甲苯中,在90℃下搅拌反应8h。然后冷却至-10℃,过滤除去剩余的1,8-辛二醇和催化剂,用饱和碳酸钠溶液洗涤反应混合物,蒸除甲苯后,粗产物经分子蒸馏纯化,得到淡黄色油状化合物,即为乙酸8-羟基辛酯,蒸除甲苯后产量320kg,纯度88%,产率75%,纯化后产量271kg,纯度97%,产率70%。
[0091]
按照表1的参数调整原料的用量和反应参数,得到的乙酸8-羟基辛酯的结果如表1所示。
[0092]
表1调整原料的用量和反应参数得到的乙酸8-羟基辛酯结果
[0093][0094]
乙酸8-氧代辛酯
[0095]
乙酸8-羟基辛酯(94.0kg,500mol)溶于500l二氯甲烷中,加入[cu(mecn)4]otf(25mol,5mol%)、联吡啶(25mol,5mol%)、tempo(25mol,5mol%)和n-甲基咪唑(50mol,10mol%),在室温下通入氧气反应12h。用5%的硫酸洗涤反应混合物以除去铜离子,有机层用盐水洗涤,用硫酸钠干燥,然后浓缩,得到淡黄色油状化合物,即为乙酸8-氧代辛酯,产量93.98kg,纯度95%,产率96%。
[0096]
10-乙酰氧基-2-癸烯酸甲酯
[0097]
在氮气保护和0℃下,将乙酸8-氧代辛酯(186.0kg,1000mol)、磷酰基乙酸三甲酯(237.0kg,1300mol)和碳酸钾(179.0kg,1300mol)加入到250l甲醇和250l水的混合溶液中,所得橙黄色体系在0℃下搅拌反应18h,蒸出甲醇后,用乙酸乙酯(3
×
200l)萃取反应混合物。合并有机层并用盐水洗涤,用硫酸钠干燥,然后浓缩,得到橙红色油状化合物。粗产物直接用于下一步反应,无需进一步纯化。
[0098]
10-羟基-2-癸烯酸
[0099]
将10-乙酰氧基-2-癸烯酸甲酯(242.0kg,1000mol)加入到3mol/l氢氧化钠水溶液(500l,1500mol)中。反应混合物在50℃下搅拌反应8h,用乙酸乙酯(3
×
200l)萃取反应混合物中有机大极性杂质,然后用5mol/l硫酸(400l)酸化,分出有机相即为粗产物(纯度78%),粗产物经重二氯甲烷结晶纯化,二氯甲烷与粗产物的质量比1:1,结晶温度为-10℃,18h后二氯甲烷已结晶,得到白色固体化合物,即为10-羟基-2-癸烯酸,产量130.3kg,经气相色谱检测,纯度99.9%,气相色谱检测结果见表2和图2,产率70%,白色固体,熔点mp 64.6~62.8℃。
[0100]
气相色谱仪检测使用的仪器:福立9720plus
[0101]
色谱柱:30m
×
0.32mm(i.d.),hp-5毛细管柱,膜厚0.25μm;
[0102]
微量进样器:10μl;
[0103]
色谱操作条件
[0104]
一、进样口
[0105]
加热器温度:250℃,压力:62kpa,分流比:30
[0106]
二、柱箱
[0107]
温度(℃):柱温(程序升温:起始温度75℃,以10℃/min速率升至200℃,以20℃/min速率升至260℃,于260℃保持15min)
[0108]
三、检测器:氢火焰离子检测器
[0109]
加热器温度:260℃,氢气流量30ml/min,空气流量400ml/min;
[0110]
尾吹流量(n2):30ml/min;
[0111]
配样:0.01g样品溶于1ml乙酸乙酯中;
[0112]
进样体积(μl):0.1;
[0113]
检测方法:归一法;
[0114]
四、积分条件
[0115]
斜率:100fa/min漂移:0fa/min
[0116]
最小峰宽:1锁定时间:3
[0117]
最小面积:1000停止时间:30
[0118]
最小峰高:1000
[0119]
表2气相色谱检测结果
[0120]
保留时间峰面积峰面积%峰高峰高%2.120545860.02381970.425.647506640.02200340.2213.02327908008399.96911081499.36总数279185333100.009169045100.00
[0121]
对得到的10-羟基-2-癸烯酸进行结构表征,氢谱图见图1,1h nmr(500mhz,dmso-d6)δ12.04(br s,1h),6.80(dt,j=15.5,7.1hz,1h),5.70(d,j=15.5hz,1h),4.28(br s,1h),3.37(t,j=6.5hz,2h),2.21
–
2.09(m,2h),1.45
–
1.33(m,4h),1.31
–
1.19(m,6h).
13
c nmr(126mhz,dmso-d6)δ167.13,148.54,121.90,60.80,32.51,31.46,28.75,28.66,27.58,25.44.
[0122]
实施例2
[0123]
与实施例1相同,区别仅在于分别使用乙酸乙酯、乙醇、石油醚结晶,结晶过程二氯甲烷首先结晶且晶体形态较好。
[0124]
实施例3
[0125]
与实施例1相同,区别仅在于制备10-乙酰氧基-2-癸烯酸甲酯时以水为溶剂,经检测,乙酸8-氧代辛酯剩余10wt%未反应,延长时间也反应不彻底。
[0126]
实施例4
[0127]
与实施例1相同,区别仅在于制备10-乙酰氧基-2-癸烯酸甲酯时将甲醇替换为乙醇,经24h反应完全。
[0128]
实施例5
[0129]
与实施例1相同,区别仅在于制备10-羟基-2-癸烯酸时将乙酸乙酯萃取替换为二氯甲烷,得到的粗品纯度为63%;将乙酸乙酯萃取替换为四氢呋喃,得到的粗品纯度为65%,气味较大,将乙酸乙酯萃取替换为甲基叔丁基醚,得到的粗品纯度为68%,气味较大。
[0130]
以上所述仅是本发明的优选实施方式,并非对本发明作任何形式上的限制。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1